心肌慢性缺氧是临床许多心脏疾病的共同病理生理过程,如紫绀型先心病、高原性心脏病及冠状动脉粥样硬化性心脏病等。在慢性缺氧状态下,心肌逐渐产生一系列适应性变化,如调节代谢相关激酶的活性、促进血管生成、线粒体质量控制等[1]。研究心肌组织对慢性缺氧的适应性反应及其具体机制,对临床治疗紫绀型先心病等相关疾病具有重要意义。
自噬是细胞内高度保守的分解代谢过程,当细胞在营养缺乏、缺氧等因素刺激下,细胞胞质内形成膜结构包裹胞内细胞器、蛋白质等底物,再与溶酶体融合形成自噬溶酶体,从而使底物降解[2]。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3) 是各型自噬泡的共同特征性标志,胞质中LC3蛋白合成后立即被Atg4家族蛋白加工处理,形成胞质型的LC3-Ⅰ;在自噬过程中,LC3-Ⅰ在Atg7、Atg3等自噬相关蛋白的作用下与磷脂酰乙醇胺共价结合形成LC3-Ⅱ,参与自噬泡膜结构的形成,因此常用LC3-Ⅱ/LC3-Ⅰ比值来反映自噬程度[3-5]。p62(ubiquitin-binding protein p62,sequestosome 1) 是另一种被广泛运用的自噬标志物,是连接自噬泡与自噬底物的桥接蛋白,由于其自身在自噬过程中也会与底物一同被降解,故其降解程度可反映自噬降解的程度[4]。临床研究报道紫绀型先心病患者的手术标本检测显示自噬增强[6]。动物实验研究发现,在饥饿、心肌缺血再灌注、慢性缺血以及主动脉弓缩窄 (transverse aortic construction,TAC) 诱导的压力超负荷等情况下,心肌自噬水平会显著增高。
腺苷酸激活蛋白激酶 (adenosine monophosphate-activated protein kinase,AMPK) 是真核细胞中的一种保守的丝/苏氨酸蛋白激酶,由α、β和γ 3个亚基构成,其中α亚基为催化亚基,是AMPK分子发挥功能的主要单元,存在α1、α2两种亚型。心脏中以α2亚型表达为主;β和γ亚基为调节亚基,参与调节α亚基的结构与功能,分别有β1、β2与γ1、γ2、γ3亚型。之前的研究发现,AMPK激活参与了慢性缺氧心肌细胞的适应过程[7-8],而AMPK是自噬的上游分子。因此,慢性缺氧条件下AMPK可能通过调节自噬来参与心肌细胞的适应过程。
本研究旨在观察慢性缺氧情况下小鼠心肌自噬水平的变化,初步探究AMPKα2敲除对该过程的影响,进而探讨自噬作用在心肌慢性缺氧适应过程中的意义,为研究慢性缺氧条件下自噬的调节机制作基础,为临床上慢性缺氧心肌的保护提供新思路。
1 材料与方法 1.1 主要材料 1.1.1 实验动物与分组AMPKα2基因敲除杂合子小鼠 (AMPKα2+/-) 由法国Benoit Viollet教授实验室友情馈赠,由本所实验室保种、繁殖与鉴定。将周龄 (约4周)、体质量 (约20 g) 相近的野生型与AMPKα2-/-雄性C57小鼠均分为常氧组和缺氧组,即野生型常氧组、野生型缺氧组、敲除型常氧组和敲除型缺氧组,每组10只。
1.1.2 主要试剂GoTaq® Green Master Mix (Promega公司),引物由上海生工公司合成 (AMPKα2基因PCR引物序列见表 1),山羊源AMPKα2多克隆抗体 (Santa公司),兔源LC3单克隆抗体 (Sigma公司),兔源p62多克隆抗体 (CST公司),兔源β-actin多克隆抗体 (博奥森公司)。
| 基因 | 引物序列 (5′→3′) | 片段长度 |
| AMPKα2(野生型) | 上游:GCTTAGCACGTTACCCTGGATGG 下游:GTTATCAGCCCAACTAATTACAC |
200 bp |
| AMPKα2(敲除型) | 上游:GCTTAGCACGTTACCCTGGATGG 下游:GCATTGAACCACAGTCCTTCCTC |
600 bp |
1.2 方法 1.2.1 小鼠基因型鉴定
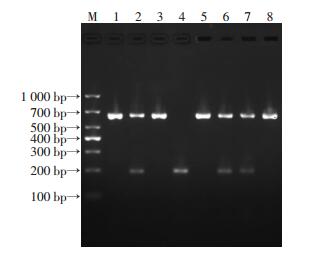
取小鼠尾尖组织约10 mg,加入200 μL裂解缓冲液,剪碎并涡旋混匀,加入10 μL蛋白酶K,混匀,56 ℃消化过夜,13 000×g离心5 min,取上清行常规PCR扩增 (引物序列见表 1)。PCR反应体系:总体积25 μL,Mix 12.5 μL,共同上游引物1 μL,野生型下游引物0.5 μL,敲除型下游引物0.5 μL (引物浓度均为10 μmol/L),模板DNA 1 μL (约200 ng),无酶水9.5 μL。反应条件为:94 ℃预变性3 min,94 ℃变性30 s、55 ℃退火30 s和72 ℃延伸1 min,反应35个循环,72 ℃延伸5 min,4 ℃保存。将所得DNA产物置于2%琼脂糖凝胶电泳,在凝胶成像仪下采集图像,观察DNA条带位置[9]。如图 1所示,DNA琼脂糖凝胶电泳图中,仅在200 bp出现DNA条带的样本为野生型纯合子,仅在600 bp出现DNA条带的样本为敲除型纯合子,在200 bp与600 bp均出现DNA条带的样本为杂合子。
|
| M:标准;4:野生型纯合子,仅在200 bp出现DNA条带;1、3、5、8:敲除型纯合子,仅在600 bp出现DNA条带;2、6、7:杂合子,在200 bp与600 bp均出现DNA条带 图 1 DNA琼脂糖凝胶电泳进行小鼠基因型鉴定 |
1.2.2 动物处理
野生型常氧组与敲除型常氧组小鼠置于常氧环境中饲养4周,野生型缺氧组与敲除型缺氧组小鼠放入10% O2的低氧舱内饲养4周,记录小鼠的一般情况、死亡例数与时间。
1.2.3 小鼠血液标本及心脏标本的收集取小鼠脱颈处死,迅速打开腹腔,经腹主静脉取20 μL血液,加入血常规稀释液中混匀,送检;迅速打开胸腔,取心脏标本,去除心房组织,经冰PBS洗涤,洁净纱布吸去多余液体,垂直心脏长轴切分为两部分 (分别用于提取蛋白和制作冰冻切片),称量,经液氮速冻后放入-80 ℃冰箱保存。
1.2.4 Western blot检测心肌LC3、p62蛋白水平取冻存的心肌组织,按1 mg组织加入10 μL RIPA裂解液 (强) 和0.1 μL PMSF,组织匀浆机匀浆,置于冰上裂解30 min,4 ℃ 12 000×g高速离心30 min,取上清。BCA法测定蛋白浓度,加入1/4体积的5×SDS蛋白上样缓冲液,100 ℃煮沸10 min变性。将样品分别加入12%(检测LC3)、10%(检测AMPKα2、p62) 的SDS-PAGE胶中电泳,然后转到PVDF膜上,5% BSA室温封闭2 h,4 ℃孵育一抗过夜,TBST洗膜10 min×3次,然后室温孵育二抗2 h,TBST洗膜10 min×3次,ECL显影,采集图片,Image J软件分析结果。
1.2.5 免疫荧光检测心肌LC3蛋白水平取冻存的心肌组织,OTC包埋后切6 μm厚冰冻切片,4%多聚甲醛固定,PBST洗涤5 min×3次,山羊血清37 ℃封闭1 h,弃去血清,加LC3一抗4 ℃过夜,PBST洗涤5 min×5次,37 ℃孵育二抗1 h,PBST洗涤5 min×5次,封片,用于共聚焦显微镜检测并拍照。
1.3 统计学分析数据以x±s表示,两组均数比较采用SPSS 13.0统计软件进行独立样本t检验分析,生存曲线采用Graphpad Prism 6进行绘图与分析。
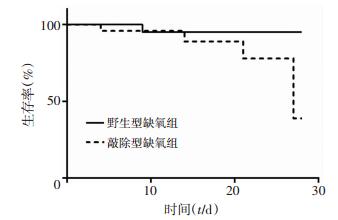
2 结果 2.1 慢性缺氧对小鼠一般情况的影响在常氧组,野生型与敲除型小鼠未见明显异常。缺氧组野生型与敲除型小鼠在入舱第1天即出现呼吸急促、精神不振、嗜睡懒动等表现;在4周的缺氧过程中,小鼠进食量减少、体质量下降且出现死亡个例,野生型小鼠死亡1例,敲除型小鼠死亡4例。缺氧组内野生型与敲除型小鼠生存曲线见图 2,两组小鼠生存曲线差异无统计学意义 (P>0.05),可能因样本量较小所致。
|
| 图 2 缺氧组内野生型与敲除型小鼠生存曲线 |
2.2 慢性缺氧对野生型小鼠血液红细胞及血红蛋白的影响
常氧组红细胞 (9.33±0.15)×1012/L,缺氧组红细胞 (12.78±0.66)×1012/L,比常氧组增加37%,差异有统计学意义 (P < 0.05);常氧组血红蛋白 (135±3) g/L,缺氧组血红蛋白 (192±4) g/L,比常氧组增加42%,差异有统计学意义 (P < 0.05)。表明在缺氧状态下,小鼠血液红细胞增生。
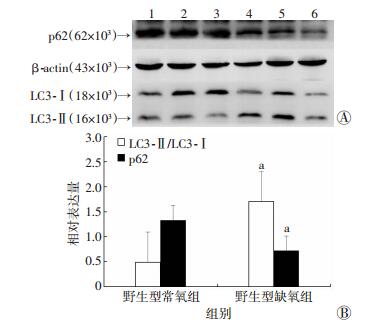
2.3 慢性缺氧对野生型小鼠心肌组织LC3-Ⅱ/LC3-Ⅰ、p62蛋白表达的影响Western blot实验结果见图 3。结果显示,与常氧组比较,缺氧组LC3-Ⅱ/LC3-Ⅰ比值增加[(0.49±0.29) vs (1.70±0.24),P < 0.05];p62表达降低[(1.32±0.57) vs (0.71±0.19),P < 0.05],提示慢性缺氧条件下小鼠心肌自噬水平增高。免疫荧光染色实验显示,与常氧组相比,缺氧组绿色荧光增多 (图 4)。以上结果反映慢性缺氧条件下小鼠心肌组织自噬程度增强。
|
| A:Western blot检测结果 1~3:野生型常氧组3个样本;4~6:野生型缺氧组3个样本;B:半定量分析结果 (n=6,x±s) a:P < 0.05,与野生型常氧组比较 图 3 Western blot检测野生型小鼠心肌组织中LC3-Ⅱ/LC3-Ⅰ和p62的表达 |

|
| 图 4 免疫荧光染色检测小鼠心肌组织冰冻切片中LC3的表达 (激光共聚焦显微镜×400) |
2.4 AMPKα2敲除对小鼠心肌组织LC3-Ⅱ/LC3-Ⅰ比值的影响
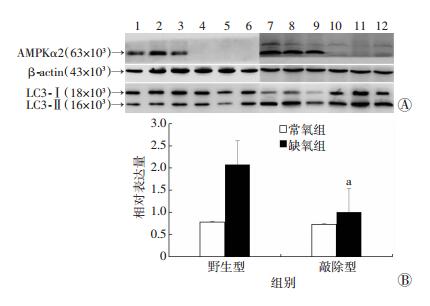
结果见图 5,在常氧条件下,AMPKα2-/-小鼠较野生型小鼠心肌组织LC3-Ⅱ/LC3-Ⅰ比值降低,但差异无统计学意义[(0.78±0.08) vs (0.73±0.34),P>0.05];但在慢性缺氧条件下,AMPKα2-/-小鼠较野生型小鼠心肌组织LC3-Ⅱ/LC3-Ⅰ比值下降,差异有统计学意义[(2.08±0.72) vs (1.01±0.21),P < 0.05]。这提示AMPKα2可能参与了慢性缺氧诱导的心肌自噬过程。
|
| A:Western blot检测结果1~3:野生型常氧组3个样本;4~6:敲除型常氧组3个样本;7~9:野生型缺氧组3个样本;10~12:敲除型缺氧组3个样本;B:半定量分析结果 (n=6,x±s) a:P < 0.05,与野生型比较 图 5 Western blot检测常氧组与缺氧组内野生型与敲除型小鼠心肌组织中LC3-Ⅱ/LC3-Ⅰ比值 |
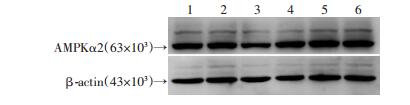
2.5 慢性缺氧对野生型小鼠心肌组织AMPKα2蛋白表达水平的影响
在野生型小鼠中,与常氧组比较,缺氧组小鼠心肌组织中AMPKα2蛋白的表达稍有增高,但差异无统计学意义[(1.14±0.13) vs (1.25±0.19),P>0.05,图 6]。这提示缺氧条件下AMPKα2蛋白总量并无明显增加,可能其活性发生变化。
|
| 1~3:野生型常氧组3个样本;4~6:野生型缺氧组3个样本 图 6 Western blot检测野生型小鼠心肌组织中AMPKα2蛋白的表达 |
3 讨论
既往研究发现,在正常情况下,细胞存在基础水平的自噬,是细胞分解代谢中除泛素化降解蛋白之外的另一条重要分解代谢途径[10-11]。它不仅可以降解蛋白聚合物,也可降解衰老细胞器,对维持细胞内环境稳定具有重要作用。在细胞受刺激的情况下,自噬有利亦有弊,一定程度的自噬可以降解废旧蛋白、细胞器,增加能量代谢的底物供应,但过度的自噬会导致细胞发生自噬性死亡。细胞自噬是细胞内一种高度保守的过程,按降解底物运送至溶酶体途径的不同可分为大自噬 (macroautophagy)、小自噬 (microautophagy) 和分子伴侣介导的自噬 (chaperone-mediated autophagy,CMA)。自噬过程可分为起始、延伸、融合和降解4个阶段,起始即胞质中吞噬泡 (phagophore) 的形成;延伸指自噬相关蛋白结合到吞噬泡上,其中胞质中LC3-Ⅰ与磷脂酰乙醇胺共价结合转化为脂溶性LC3-Ⅱ,在自噬前体周围延伸形成膜结构;融合即自噬体与溶酶体融合而形成自噬溶酶体 (autolysosome);降解是指自噬底物被溶酶体中的酶类降解为小分子化合物的过程。
本研究首先检测慢性缺氧条件下野生型小鼠血液中红细胞和血红蛋白的变化,证实小鼠慢性缺氧模型建立成功。接着检测在慢性缺氧条件下野生型小鼠心肌细胞自噬水平的变化,Western blot结果显示,LC3-Ⅱ/LC3-Ⅰ比值增加,p62蛋白表达水平降低,提示自噬水平增加;免疫荧光结果从形态学水平上证实了Western blot的结论。最后检测了AMPKα2敲除对慢性缺氧条件下小鼠心肌自噬水平的影响,Western blot结果显示,其LC3-Ⅱ/LC3-Ⅰ较野生型小鼠显著降低,提示AMPKα2参与调节慢性缺氧条件下心肌自噬过程。但在慢性缺氧条件下,野生型小鼠AMPKα2总蛋白并无显著增加。这提示其对自噬过程的调节可能并不依赖总蛋白水平,具体机制有待进一步实验验证。
关于AMPKα2的研究在糖代谢与胰岛素抵抗方面报道较多[9, 12-13],而其在心脏中的研究相对较少。Zhang等[14]发现AMPKα2敲除能导致TAC诱导的小鼠左心肥厚与心功能不全发生恶化,Slámová等[15]发现AMPKα2敲除后老年雌鼠心脏对缺血的耐受性下降,均提示AMPKα2对心脏具有保护作用,但其机制并不清楚。本研究显示,AMPKα2敲除后导致慢性缺氧条件下小鼠心肌自噬水平降低,说明AMPKα2可能通过调节自噬而介导了心肌的适应过程。在缺氧过程中,小鼠生存曲线差异无统计学意义,可能因样本量较小所致,但AMPKα2-/-小鼠出现较多死亡例数,而且在慢性缺氧条件下,心肌细胞自噬程度增强,可以降解衰老蛋白质,增加能量代谢的底物供应,也可以清除受损的线粒体,减少活性氧的产生[16]。因此,我们推测AMPKα2参与调节的自噬过程可能是心肌对慢性缺氧的一种适应性机制。在此基础上,进一步研究慢性缺氧条件下心肌自噬的相关机制,可以为临床上慢性缺氧心肌的保护提供新的思路,为慢性缺氧性心肌疾病的治疗提供新的干预靶点。
| [1] | Xiao Y B, Jian Z. Research progress on myocardial adaptation to chronic hypoxia[J]. Med J West China, 2015, 27(3): 321–322. DOI:10.3969/j.issn.1672-3511.2015.03.001 |
| [2] | Yoshii S R, Mizushima N. Autophagy machinery in the context of mammalian mitophagy[J]. Biochim Biophys Acta, 2015, 1853(10PtB): 2797–2801. DOI:10.1016/j.bbamcr.2015.01.013 |
| [3] | Martinez J, Malireddi R K, Lu Q, et al. Molecular characteri-zation of LC3-associated phagocytosis (LAP) reveals distinct roles for Rubicon, NOX2, and autophagy proteins[J]. Nat Cell Biol, 2015, 17(7): 893–906. DOI:10.1038/ncb3192 |
| [4] | Jiang P, Mizushima N. LC3-and p62-based biochemical methods for the analysis of autophagy progression in mammalian cells[J]. Methods, 2015, 75: 13–18. DOI:10.1016/j.ymeth.2014.11.021 |
| [5] | Aparicio I M, Martin Muñoz P, Salido G M, et al. The autophagy-related protein LC3 is processed in stallion spermatozoa during short-and long-term storage and the related stressful conditions[J]. Animal, 2016, 10(7): 1182–1191. DOI:10.1017/S1751731116000240 |
| [6] |
洪毅, 蹇朝, 肖颖彬. 自噬体在紫绀型先天性心脏病患儿心肌中的表达[J].
第三军医大学学报, 2009, 31(23): 2351–2354.
Hong Y, Jian Z, Xiao Y B. Upregulated autophagy in myocardium of infants with cyanotic congenital heart defects[J]. J Third Mil Med Univ, 2009, 31(23): 2351–2354. DOI:10.3321/j.issn:1000-5404.2009.23.016 |
| [7] |
李畑波, 鞠胜杰, 蹇朝, 等. 腺苷酸激活蛋白激酶激活参与促进慢性缺氧时心肌细胞存活[J].
第三军医大学学报, 2015, 37(8): 797–803.
Li T B, Ju S J, Jian Z, et al. AMPK activation participates in promoting myocardial cell survival in chronic hypoxia[J]. J Third Mil Med Univ, 2015, 37(8): 797–803. DOI:10.16016/j.1000-5404.201411089 |
| [8] |
鞠胜杰, 李畑波, 蹇朝, 等. NEDD4调控AMPK活性参与心肌细胞慢性缺氧适应的研究[J].
第三军医大学学报, 2015, 37(9): 891–895.
Ju S J, Li T B, Jian Z, et al. NEDD4 participates in myocardial adaptation to chronic hypoxia by regulating AMPK[J]. J Third Mil Med Univ, 2015, 37(9): 891–895. DOI:10.16016/j.1000-5404.201412262 |
| [9] | Viollet B, Andreelli F, Jørgensen S B, et al. The AMP-activated protein kinase alpha2 catalytic subunit controls whole-body insulin sensitivity[J]. J Clin Invest, 2003, 111(1): 91–98. DOI:10.1172/JCI16567 |
| [10] | Nishida K, Yamaguchi O, Otsu K. Degradation systems in heart failure[J]. J Mol Cell Cardiol, 2015, 84(5089): 212–222. DOI:10.1016/j.yjmcc.2015.05.004 |
| [11] | Lee E, Koo Y, Ng A, et al. Autophagy is essential for cardiac morphogenesis during vertebrate development[J]. Autophagy, 2014, 10(4): 572–587. DOI:10.4161/auto.27649 |
| [12] | Coughlan K A, Valentine R J, Sudit B S, et al. PKD1 Inhibits AMPKα2 through Phosphorylation of Serine 491 and Impairs Insulin Signaling in Skeletal Muscle Cells[J]. J Biol Chem, 2016, 291(11): 5664–5675. DOI:10.1074/jbc.M115.696849 |
| [13] | Amaral M E, Ribeiro R A, Vanzela E C, et al. Reduced AMPKα2 protein expression restores glucose-induced insulin secretion in islets from calorie-restricted rats[J]. Int J Exp Pathol, 2016, 97(1): 50–55. DOI:10.1111/iep.12165 |
| [14] | Zhang P, Hu X, Xu X, et al. AMP activated protein kinase-alpha2 deficiency exacerbates pressure-overload-induced left ventricular hypertrophy and dysfunction in mice[J]. Hypertension, 2008, 52(5): 918–924. DOI:10.1161/HYPERTENSIONAHA.108.114702 |
| [15] | Slámová K, Papoušek F, Janovská P, et al. Adverse effects of AMP-activated protein kinase alpha 2-subunit deletion and high-fat diet on heart function and ischemic tolerance in aged female mice[J]. Physiol Res, 2016, 65(1): 33–42. |
| [16] | Wu H, Chen Q. Hypoxia activation of mitophagy and its role in disease pathogenesis[J]. Antioxid Redox Signal, 2015, 22(12): 1032–1046. DOI:10.1089/ars.2014.6204 |



