现代社会各种负性应激所导致的情感精神疾病(如焦虑症等)发病率逐年上升[1],但目前对其发病机制仍不清。应激是引起焦虑障碍的一种重要影响因素,在应激条件下,内环境平衡易受到破坏,其中下丘脑-垂体-肾上腺(hypothalamus-pituitary-adrenal,HPA)轴的调节是维持内环境稳定的重要机制之一[2]。临床研究表明,焦虑症患者存在明显的HPA轴功能异常,HPA轴调节在其他精神疾病的发生发展中也起着关键作用,如抑郁症[3]、阿尔茨海默病[4]、帕金森病[5]等都有报道。HPA轴发挥正常生理作用与轴本身功能及轴的负反馈调节都密不可分,并相互影响。本实验通过建立大鼠焦虑模型,研究HPA轴功能紊乱是与轴本身异常还是轴负反馈调节作用改变相关,以期为寻找与焦虑症发病机制相关的因素提供实验依据。
1 材料与方法 1.1 主要材料动物:SD健康雄性大鼠46只,体质量180~220 g(动物及饲料由重庆医科大学实验动物研究中心提供)。仪器:高架十字迷宫实验和旷场实验视频跟踪系统及软件数据分析仪(第三军医大学提供)。试剂:大鼠促肾上腺激素(adrenocorticotrophichormone,ACTH)和皮质酮水平(corticosterone,CORT)ELISA试剂盒由上海Elisa生物技术有限公司提供;GR抗体、β-actin抗体购自Abcam公司。SDS配胶试剂盒购自碧云天生物技术有限公司。
1.2 方法 1.2.1 动物饲养及分组实验期间,饲养温度(24±2) ℃、湿度50%~60%,12 h昼夜循环,7: 00开灯,19: 00关灯,自由进食、饮水。实验分组前所有大鼠适应性饲养1周,然后随机分为对照组(n=20) 和模型组(n=26)。
1.2.2 造模方法对照组大鼠正常饲养,模型组大鼠用慢性不可预知的情绪应激方法造模。在文献[6]的方法的基础上给予改进,从造模第1天起,模型组大鼠开始接受不同应激源刺激,包括电击足底、禁水、禁食、热水浴(45 ℃左右)、冷水浴(4 ℃左右)、噪音(5 h)、频闪、摇床(10 min)、行为限制(1 h)、24 h光照、24 h黑暗、昼夜颠倒、空垫料和湿垫料等14种方法,每天安排2种强弱不等的应激源,避免相邻2 d方法重复、相邻周次顺序重复,以免造成大鼠规律性的适应,连续刺激4周。
1.3 行为学检测 1.3.1 一般状态每日观察大鼠毛发色泽、身体姿态、活动情况、精神状态和对外界的反应情况等。每周称量两组大鼠的体质量,并比较体质量的变化。
1.3.2 旷场实验采用50 cm×50 cm×30 cm实验木箱。在测试前1 d,把动物搬进测试室适应环境,测试开始后,每次放置大鼠头部固定朝向一侧。每只大鼠旷场活动10 min,计算机将自动记录下述指标:运动总距离、中央区活动时间百分比、中央区活动路程百分比、中央区活动时间、中央区活动路程和运动平均速度。
1.3.3 高架十字迷宫实验高架十字迷宫由两条开放臂(50 cm×10 cm)和两条封闭臂(50 cm×10 cm× 40 cm)组成,呈十字形交叉,中间由中央区连接(10 cm× 10 cm),距离地面高50 cm,测试前1 d把动物搬进测试室适应环境。实验时,大鼠置于高架十字平台中央区域,头部正对其中一侧开放臂,每只大鼠迷宫时间5 min,计算机将自动记录下述指标:进入开放臂的次数(open arm entry,OE)、进入开放臂次数百分比、进入开放臂时间(open arm time,OT)、进入开放臂时间百分比。
1.4 血清ACTH和CORT测定造模结束后,分别收集对照组和模型组应激前后的颈部大血管血液。血液室温静置20~30 min,在4 ℃、3 000 r/min离心20 min后收集上清,用ELISA试剂盒检测血清中ACTH和CORT水平。
1.5 蛋白免疫印迹(Western blot检测)分别取两组大鼠新鲜海马、下丘脑、垂体和肾上腺组织经匀浆、超声粉碎后高速低温离心(14 000 r/min,4 ℃),提取上清蛋白。BCA法测蛋白浓度,取总蛋白量为40 μg进行8%聚丙烯酰胺凝胶电泳,湿电转法将蛋白转移到PVDF膜上,5%的脱脂奶粉封闭2 h, 加入一抗GR抗体,4 ℃孵育过夜,PBST洗膜后加二抗, 常温孵育1 h,PBST洗膜后, 用ECL发光法显色,Image-Lab凝胶成像系统采集图像。
1.6 统计学分析计量资料数据以x±s表示,应用SPSS 17.0统计软件,进行独立样本t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 行为学检测 2.1.1 一般状态观察刺激1周后,模型组大鼠开始出现精神紧张,随着时间的延长,大鼠逐渐变得警惕性高,稍有声响即成防御姿态。造模结束后,模型组大鼠大多表现为毛发凌乱,易激惹,喜蜷伏于角落,活动度较对照组明显减少。
2.1.2 大鼠体质量2周后,模型组大鼠的体质量增长明显低于对照组,差异有统计意义(P < 0.05,P < 0.01,表 1)。
| 组别 | 应激前 | 刺激第1周 | 刺激第2周 | 刺激第3周 | 刺激第4周 |
| 对照组 | 196.35±10.65 | 223.70±8.05 | 238.96±15.13 | 244.02±14.26 | 252.90±15.13 |
| 模型组 | 196.50±10.32 | 218.50±13.78 | 198.93±12.29a | 194.38±11.12a | 208.63±13.47a |
| a:P < 0.01,与对照组比较 | |||||
2.1.3 旷场实验
与对照组相比,模型组大鼠运动总路程、中央活动路程、中央活动路程百分比、中央活动时间、中央活动时间百分比和运动平均速度均明显降低(P < 0.01, 表 2)。
| 组别 | 总路程(cm) | 中央活动路程(cm) | 中央活动时间(s) | 平均速度(s) | 中央活动时间(%) |
| 对照组 | 4 674.76±1 858.67 | 92.34±55.27 | 7.20±2.49 | 7.79 ±3.09 | 8.53±5.58 |
| 模型组 | 2 837.73±1 819.81a | 16.55±15.81a | 1.99±2.49a | 4.72±2.53a | 4.69±6.69a |
| a:P < 0.01,与对照组比较 | |||||
2.1.4 高架十字迷宫实验
与对照组相比,模型组大鼠进入开放臂的次数、进入开放臂次数百分比、进入开放臂时间和进入开放臂时间百分比均显著降低(P < 0.01,表 3)。
| 组别 | 进入开放臂的次数 | 进入开放臂次数百分比(%) | 进入开放臂时间(s) | 进入开放臂时间百分比(%) |
| 对照组 | 6.85±1.69 | 0.28±0.08 | 94.05±24.82 | 0.31± 0.07 |
| 模型组 | 3.54±1.86a | 0.12±0.07a | 53.54±22.80a | 0.17± 0.07a |
| a:P < 0.01,与对照组比较 | ||||
2.2 旷场应激对大鼠ACTH和CORT分泌的改变
如图 1所示,基础条件下,两组大鼠分泌ACTH和CORT差异无统计学意义(P > 0.05)。5 min旷场应激后,模型组大鼠分泌ACTH和CORT显著高于对照组(P < 0.01)。旷场应激前后相比,对照组大鼠分泌ACTH和CORT无明显增高(P > 0.05),而模型组大鼠5 min旷场后分泌ACTH和CORT均显著增加(P < 0.01)。

|
|
a:P < 0.01,与应激后对照组比较;b:P < 0.01,与应激前模型组比较 A:ACTH表达;B:CORT表达 图 1 旷场应激大鼠血清中ACTH和CORT表达水平测定 |
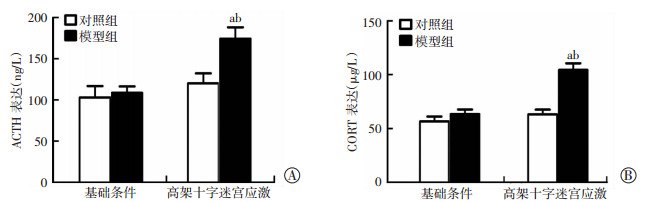
2.3 高架十字迷宫应激对大鼠ACTH和CORT分泌的改变
如图 2所示,基础条件下两组大鼠分泌ACTH和CORT差异无统计学意义(P > 0.05)。5 min高架十字迷宫应激后,模型组大鼠分泌ACTH和CORT显著高于对照组(P < 0.01)。应激前后相比,对照组大鼠分泌ACTH和CORT无明显增高(P > 0.05),而模型组大鼠5 min应激后分泌ACTH和CORT均显著增加(P < 0.01)。
|
|
a:P < 0.01,与应激后对照组比较;b:P < 0.01,与应激前模型组比较 A:ACTH表达;B:CORT表达 图 2 高架十字迷宫应激大鼠血清中ACTH和CORT表达水平测定 |
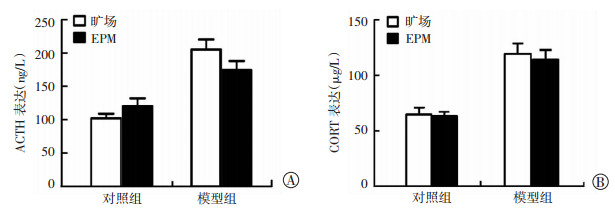
2.4 旷场和高架十字迷宫两种应激源对大鼠分泌ACTH和CORT的影响
如图 3所示,高架十字迷宫和旷场作为两种不同应激源刺激大鼠后,两组大鼠ACTH和CORT分泌均显著增加,但影响差异无统计学意义(P > 0.05)。
|
| A:ACTH表达;B:CORT表达 图 3 旷场和高架十字迷宫应激大鼠血清中ACTH和CORT表达水平测定 |
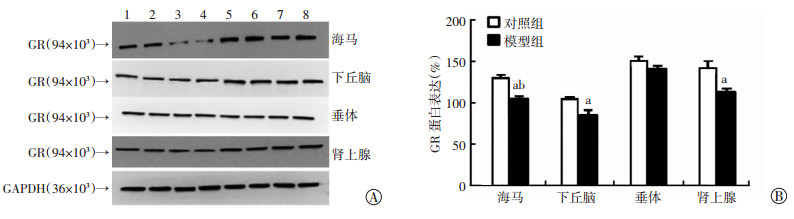
2.5 Western blot检测GR的表达
如图 4所示,与对照组相比,模型组大鼠GR蛋白表达在海马、下丘脑和肾上腺组织中显著降低(P < 0.05,P < 0.01),在垂体中表达差异无统计学意义(P > 0.05)。表明,模型大鼠在应激条件下,HPA轴反应性增高与GR蛋白表达水平降低有关。
|
| A:Western blot检测1~4:模型组大鼠;5~8:对照组大鼠;B:半定量分析a: P < 0.05,b: P < 0.01,与对照组比较 图 4 Western blot检测2组大鼠GR的表达 |
3 讨论
大量研究表明,机体受到强烈、持久的应激时,会增加患各类精神疾病的风险,其中焦虑症已成为一种普遍的精神疾病之一。研究发现焦虑情绪往往伴随着其他情感性精神疾病出现,大多与HPA轴功能紊乱有关[7]。有关报道[8]指出,机体遇到应激事件引起HPA轴功能紊乱会增加患抑郁症的风险,早期很多会出现焦虑行为,故本实验研究关于焦虑模型HPA轴的反应性。
行为学实验结果表明,通过改进后的方法可以成功建立大鼠焦虑模型。实验结果显示,基础条件下,两组大鼠分泌ACTH和CORT无明显差异,说明模型组大鼠HPA轴未因造模过程中的应激而引起功能亢进。造模结束后,选取相对温和的应激方式(旷场和高架)刺激大鼠。结果显示,在应激条件下,两组大鼠分泌ACTH和CORT均出现增加,且模型组增加显著高于对照组,说明较对照组而言,模型组大鼠在应激条件下,HPA轴敏感性增加,所以血清中出现了高浓度的ACTH和CORT。血清学结果显示,两种应激源对大鼠的影响无明显不同。表明焦虑模型大鼠HPA轴本身功能亢进与在应激条件下其轴呈高反应性无直接联系[9]。
压力条件下,应激源激活HPA轴,使糖皮质激素分泌增加,引发HPA轴的负反馈调节系统,进而帮助机体有效对抗外界应激。中枢神经系统内有两类皮质类固醇受体:盐皮质类固醇受体(MR)和GR,其中GR对皮质酮亲和力低,所以在应激条件下,主要是GR负责HPA轴负反馈调节[10]。大量研究表明,正常海马可抑制HPA轴的活性,促进应激状态下亢进的HPA轴尽快恢复到基础水平。海马是HPA轴应激反应的高位调节中枢,也是GR含量最高的脑区之一。本实验显示,模型组大鼠GR蛋白表达在海马、下丘脑和肾上腺均显著降低,说明焦虑模型大鼠HPA轴负反馈调节作用减弱,其中GR蛋白在海马中表达明显减少,也为HPA轴负反馈调节功能减弱提供了组织学依据。
有关报道[11]指出,焦虑往往发生在抑郁之前,实验也发现大鼠在造模过程中,大多先出现焦虑行为,而随着应激时间的延长,则可能出现抑郁行为。综上所述,大鼠在造模过程中,持续高水平的糖皮质激素可能会降低HPA轴GR蛋白的表达,所以造模结束后,模型组大鼠在应激条件下HPA轴出现高反应性,提示HPA轴负反馈调节功能受损。焦虑模型大鼠HPA轴调节异常与GR蛋白表达相关,与文献[12]报道相符。生活中小应激事件时常发生,多数人通过机体自身调节而不影响身体健康,若HPA轴异常,持续表现为高反应性,可能会引起机体分泌高水平的糖皮质激素,对神经星形胶质细胞造成过重的负担,增加患情感精神疾病的风险[13],从而影响我们身心健康。
| [1] | GWYNN R C, MCQUISTION H L, MCVEIGH K H, et al. Prevalence,diagnosis,and treatment of depression and generalized anxiety disorder in a diverse urban community[J]. Psychiatr Serv, 2008, 59(6): 641–647. DOI:10.1176/appi.ps.59.6.641 |
| [2] | KENNY R, DINAN T, CAI G, et al. Effects of mild calorie restriction on anxiety and hypothalamic-pituitary-adrenal axis response to stress in the male rat[J]. Physiol Rep, 2014, 2(3): e00265. DOI:10.1002/phy2.265 |
| [3] | LOK A, MOCKING R J, RUH H G, et al. Longitudinal hypothalamic-pituitary-adrenal axis trait and state effects in recurrent depression[J]. Psychoneuroendocrinology, 2012, 37(7): 892–902. DOI:10.1016/j.psyneuen.2011.10.005 |
| [4] | MINTZER J, O’NEILL C. Depression in Alzheimer’s disease: consequence or contributing factor?[J]. Expert Rev Neurother, 2011, 11(11): 1501–1503. DOI:10.1586/ern.11.145. |
| [5] | JACOB E L, GATTO N M, THOMPSON A, et al. Occurrence of depression and anxiety prior to Parkinson’s disease[J]. Parkinsonism Relat Disord, 2010, 16(9): 576–581. DOI:10.1016/j.parkreldis.2010.06.014 |
| [6] | ROMAN O, SERES J, POMETLOVA M, et al. Neuroendocrine or behavioral effects of acute or chronic emotional stress in Wistar Kyoto(WKY)and spontaneously hypertensive rats[J]. Endocr Regul, 2014, 38(4): 151–155. |
| [7] | DU X, PANG T Y. Is Dysregulation of the HPA-Axis a Core Pathophysiology Mediating Co-Morbid Depression in Neurodegenerative Diseases?[J]. Frontiers in Psychiatry, 2015, 6(32): 32. DOI:10.3389/fpsyt.2015.00032 |
| [8] | CHEN J, WANG Z Z, ZUO W, et al. Effects of chronic mild stress on behavioral and neurobiological parameters-Role of glucocorticoid[J]. Horm Behav, 2016, 2(78): 150–159. DOI:10.1016/j.yhbeh.2015.11.006 |
| [9] | ELNAZER H Y, BALDWIN D S. Investigation of cortisol levels in patients with anxiety disorders: a structured review[J]. Curr Top Behav Neurosci, 2014, 18: 191–216. DOI:10.1007/7854_2014_299. |
| [10] | GHOSAL S, BUNDZIKOVA-OSACKA J, DOLGAS C M, et al. Glucocorticoid receptors in the nucleus of the solitary tract(NTS) decrease endocrine and behavioral stress responses[J]. Psychoneuroendocrinology, 2014, 45: 142–153. DOI:10.1016/j.psyneuen.2014.03.018 |
| [11] | KESSLER R C, KELLER M B, WITTCHEN H U. The epidemiology of generalized anxiety disorder[J]. Psychiatr Clin North Am, 2001, 24(1): 19–39. DOI:10.1016/s0193-953x(05)70204-5 |
| [12] | WANG D C, CHEN T J, LIN M L, et al. Exercise prevents the increased anxiety-like behavior in lactational di-(2-ethylhexyl) phthalate-exposed female rats in late adolescence by improving the regulation of hypothalamus-pituitary-adrenal axis[J]. Horm Behav, 2014, 66(4): 674–684. DOI:10.1016/j.yhbeh.2014.09.010 |
| [13] | KOLBER B J, WIECZOREK L, .MUGLIA L J. Hypothalamic-pituitary-adrenal axis dysregulation and behavioral analysis of mouse mutants with altered glucocorticoid or mineralocorticoid receptor function[J]. Stress, 2008, 11(5): 321–338. DOI:10.1080/10253890701821081. |



