破骨细胞引发的骨吸收和成骨细胞介导的骨形成间的动态转换平衡,在生理状态下能够维持骨微环境的稳态。骨破坏的机制主要是由于破骨细胞功能的增强或者数目的增多导致的过度骨吸收,过度骨吸收可以导致一些疾病的产生,如骨质疏松、肿瘤骨转移、人工关节假体的无菌性松动等[1-3]。在人体内破骨细胞是唯一具有骨吸收功能的细胞,所以靶向性抑制破骨细胞的分化形成是预防和治疗这类疾病最重要的方向。然而对于治疗这类疾病的手段和药物,目前种类比较缺乏,副作用也比较明显和难以控制[4-5]。由此可见,开发对破骨细胞具有靶向性和对人体副作用更轻微的治疗药物迫在眉睫。天然植物化学提取物具有相对有效、副作用小的功效,为治疗骨破坏相关疾病提供了创新的思路。橄榄苦苷(oleuropein)是橄榄油提取物中一种主要的酚类化合物,具有多用途的药理作用, 如治疗动脉粥样硬化、抗氧化、抗炎[6-7]等作用。研究报道橄榄苦苷能够促进骨髓间充质干细胞成骨分化,但抑制成脂分化[8],橄榄苦苷对破骨细胞的影响及分子机制尚不明确。本实验通过检测橄榄苦苷对破骨细胞分化、骨吸收功能及相关信号通路的影响,探讨橄榄苦苷对骨破坏相关疾病的保护机制,以期为治疗骨破坏相关疾病提供理论依据。
1 材料与方法 1.1 药物与试剂4~6周龄雌性BALB/c小鼠30只,体质量约14 g,由重庆医科大学实验动物中心供应[许可证号:SCXK(京)2014-0004]。橄榄苦苷(oleuropein)购自Solarbio公司,鼠源性巨噬细胞RAW264.7细胞株购自ATCC,抗体购自Cell Signaling Technology公司,核因子κB受体活化因子配体(receptor activator of nuclear factor kappa B ligand,RANKL)和巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)购自Prospec公司,抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒购自Sigma公司。
1.2 实验方法 1.2.1 破骨细胞体外培养采用颈椎脱位法处理4~6周龄BALB/c小鼠,75%酒精浸泡死亡的小鼠5 min,钝性分离小鼠双侧股骨和胫骨,用剪刀取下胫骨和股骨,放置于PBS中浸泡清洗后,剪断两端的骨骺端,用消毒后的注射器吸取α-MEM完全培养基冲刷骨髓腔,注射器吸取髓腔细胞液至消毒后的离心管里,1 000 r/min离心5 min,弃上清液,α-MEM完全培养基重悬细胞后接种于T25瓶,在37 ℃,5% CO2细胞孵育箱中培养24 h后,PBS清洗3次去除非贴壁细胞,将得到的细胞在RANKL(50 ng/mL)和M-CSF(30 ng/mL)共同刺激下孵育3~4 d得到骨髓巨噬细胞(bone marrow-derived macrophages,BMMs)之后,以1.5×106/孔接种于24孔板,分为0、12.5、25、50 μmol/L四组,同时加入不同浓度的橄榄苦苷(0、12.5、25、50 μmol/L),细胞培养箱中培养5~7 d,隔天换液,可见破骨细胞形成。
1.2.2 破骨细胞计数用吸管轻柔地吸出24孔板中的细胞液,将去离子水提前放至37 ℃恒温水浴箱中预热,PBS洗样3次,4%多聚甲醛在室温条件下固定20 min,用提前37 ℃预热的去离子水洗涤3次,按照说明书配制TRAP染色液,每孔加300~400 μL TRAP染色液,37 ℃恒温水浴箱中避光孵育30 min,最后用去离子水冲刷3次,显微镜镜下观察,将TRAP染色阳性的含3个以上细胞核的细胞归为破骨细胞。
1.2.3 Annexin Ⅴ/PI染色法检测细胞凋亡将RAW264.7细胞种植到含有2 mL高糖DMEM完全培养基的6孔板中,RANKL(50 ng/mL)诱导,过夜后用不同浓度的橄榄苦苷(0、12.5、25、50 μmol/L)处理并更换培养基和RANKL,24 h以后,PBS清洗1次并收集细胞,结合缓冲液重悬细胞,100 μL细胞悬液加入10 μL PI和2 μL Annexin Ⅴ FITC,避光处理细胞15 min,补加入400 μL缓冲液,流式细胞仪处理获得细胞凋亡率。
1.2.4 Western blot实验把骨髓巨噬细胞接种到6孔板中,隔天更换等量的α-MEM培养基、RANKL、M-CSF,同时加入不同浓度的橄榄苦苷。细胞培养箱中培养5~7 d后,提取各组的总蛋白,聚丙烯酰胺凝胶电泳,按照常规操作进行Western blot实验,ECL试剂盒发光显影,检测总组织蛋白酶K(cathepsin K,CTSK)、激活T细胞核因子1(nuclear factor of activated T-cells 1,NFATC1)、磷酸化p38(p-p38)、p38和内参GAPDH在蛋白水平的变化。
1.2.5 牛骨片实验把经过灭菌以及α-MEM培养基浸泡过的牛骨片放到24孔板中,然后根据分组加入不同浓度的橄榄苦苷(0、12.5、25、50 μmol/L),隔天换液,直至对照组(0 μmol/L)出现大量的破骨细胞。取出骨片,标记有骨吸收的一面用PBS冲洗,用毛刷轻刷后,声波振动法去除骨片表面的细胞及其碎片。2.5%戊二醛预处理2 h后,1%锇酸处理2 h,酒精梯度脱水法处理10 min,醋酸异戊酯处理2次,每次10 min,然后放入液氮冷冻干燥,在真空下喷金后,在扫描电镜(SEM Hitachi S-4800,CamScan, Tokyo, Japan)下观察骨吸收情况并拍照,采用图像分析软件对骨吸收面积进行分析。
1.3 统计学分析采用SPSS 16.0统计软件,计量资料数据以x±s表示,组间比较行t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 橄榄苦苷对破骨细胞分化的影响TRAP染色结果显示:与0 μmol/L组相比,橄榄苦苷能够抑制BMMs破骨分化,并且呈浓度依赖性(0、12.5、25、50 μmol/L组TRAP染色阳性细胞数分别为168.7±9.0、107.3±7.4、55.7±4.9、19.3±3.7,P<0.05), 尤以50 μmol/L的橄榄苦苷对破骨细胞的抑制最强(图 1),提示橄榄苦苷能够抑制破骨细胞的分化形成。
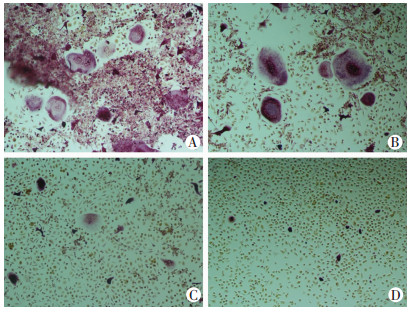
|
| A~D:分别为0、12.5、25、50 μmol/L橄榄苦苷组 图 1 TRAP染色观察不同浓度橄榄苦苷对破骨细胞分化的影响(×200) |
2.2 Western blot检测橄榄苦苷对破骨细胞特异性蛋白CTSK的影响
Western blot检测结果显示:和0 μmol/L组比较,橄榄苦苷能够呈浓度依赖性地下调由RANKL诱导的破骨细胞特异性蛋白CTSK的蛋白表达水平(P<0.05,图 2),以50 μmol/L的橄榄苦苷对破骨细胞特异性蛋白CTSK抑制最强。进一步提示橄榄苦苷能够抑制破骨细胞的分化形成。
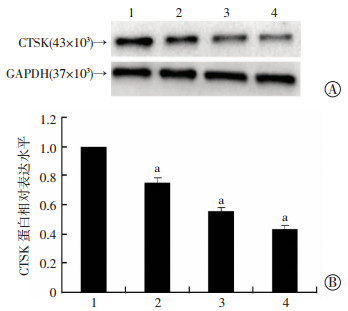
|
| 1~4:分别为0、12.5、25、50 μmol/L橄榄苦苷组;A: Western blot检测;B:半定量分析a: P<0.05,与0 μmol/L比较 图 2 Western blot检测橄榄苦苷对CTSK表达水平的影响 |
2.3 橄榄苦苷对破骨细胞凋亡的影响
和0 μmol/L组破骨细胞凋亡率(4.74±0.58)%比较, 12.5、25、50 μmol/L组破骨细胞凋亡率依次为(4.73±0.49)%、(4.70±0.31)%、(4.77±0.49)%,发现橄榄苦苷对破骨细胞凋亡的影响差异无统计学意义(P>0.05,图 3),提示橄榄苦苷不引起破骨细胞凋亡。
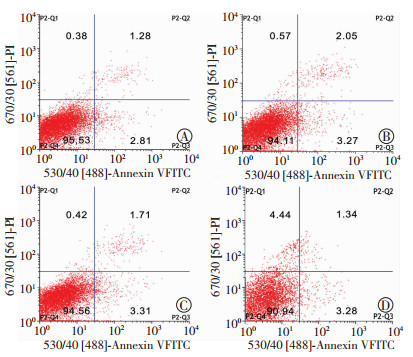
|
| A~D:分别为0、12.5、25、50 μmol/L橄榄苦苷组 图 3 橄榄苦苷对破骨细胞凋亡的影响 |
2.4 橄榄苦苷对骨吸收功能的作用
骨片实验结果显示:0 μmol/L橄榄苦苷组骨吸收陷窝面积为(2.39±0.12) mm2,12.5、25、50 μmol/L组骨吸收陷窝面积依次为(0.830±0.090)、(0.300±0.050)、(0.020±0.008) mm2,发现随着浓度增高,橄榄苦苷组的骨片骨吸收陷窝区域明显减少,50 μmol/L橄榄苦苷组基本看不到有骨吸收的作用(P<0.05,图 4)。提示橄榄苦苷对破骨细胞的骨吸收功能有抑制作用。
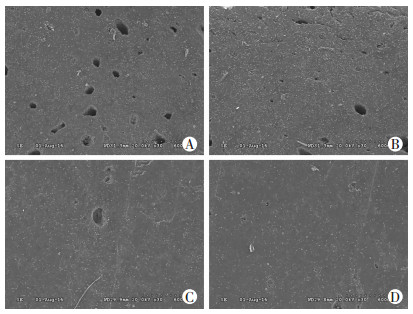
|
| A~D:分别为0、12.5、25、50 μmol/L橄榄苦苷组 图 4 扫描电镜观察不同浓度橄榄苦苷组的骨吸收情况(×600) |
2.5 橄榄苦苷对破骨细胞p38磷酸化水平的影响
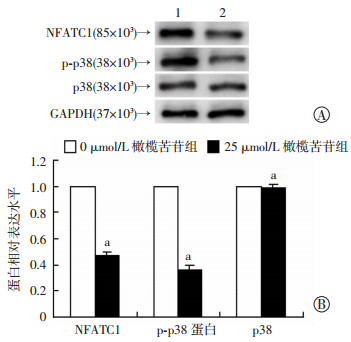
为了探讨橄榄苦苷对破骨细胞影响的分子机制,对0、25 μmol/L橄榄苦苷组,提取总蛋白进行Western blot测定,结果显示,25 μmol/L橄榄苦苷组磷酸化p38(p-p38) 和NFATC1的蛋白表达水平较0 μmol/L橄榄苦苷组有所降低(P<0.05,图 5)。提示橄榄苦苷可能是通过p38/MAPK信号通路抑制破骨细胞的形成分化及骨吸收。
|
| A: Western blot检测1: 0 μmol/L橄榄苦苷组;2:25 μmol/L橄榄苦苷组;B:半定量分析a: P<0.05,与0 μmol/L橄榄苦苷组比较 图 5 Western blot检测橄榄苦苷对NFATC1和p-p38表达水平的影响 |
3 讨论
在我国患有骨破坏相关疾病的患者群体很大,治疗副作用较大,所以对骨破坏相关疾病的发生机制和治疗方面的相关研究很有必要。骨破坏相关疾病与破骨细胞之间有着密切的关联,因此围绕破骨细胞的研究是很重要的方向。SANTIAGO-MORA等[8]报道橄榄苦苷能够促进骨髓间充质干细胞向成骨分化,抑制其向成脂分化,可以防治与年龄增长正相关的骨丢失及骨质疏松。HAGIWARA等[9]研究报道,对小鼠行卵巢摘除术,建立去势后骨质疏松动物模型,发现橄榄苦苷对其骨小梁有保护作用,对皮质骨未见明显的影响。CHIN等[10]研究发现不仅橄榄苦苷在小鼠骨质疏松模型体内具有骨保护作用,在人体内也有提高骨密度、骨转换标志物的作用,但是没有增强生物力学强度。在本研究中,发现橄榄苦苷能够抑制破骨细胞形成及其骨吸收功能,并可能与p38/MAPK信号通路相关。
RANKL是来源于成骨细胞、骨细胞和间充质干细胞,可以和核因子κB受体活化因子(receptor activator of nuclear factor kappa B,RANK)联合,而RANK是在破骨前体细胞的膜上[11]。RANK和RANKL特异性联合后,RANK胞浆内部分快速与TRAF6相联合,把信号往下游传导,激活破骨相关信号通路。而RAW264.7细胞为在体外实验中常作为替代BMMs的破骨前体细胞,在RANKL的诱导下可以形成破骨细胞[12], 本研究将其用于细胞凋亡的检测。
本研究从小鼠胫骨和股骨中提取得到BMMs,并在M-CSF和RANKL诱导培养下获到成熟的破骨细胞,在实验组中加入不同浓度的橄榄苦苷,观察对破骨细胞分化形成、凋亡和对骨吸收功能的影响,及其可能调控机制。发现橄榄苦苷可以抑制TRAP染色阳性的破骨细胞的分化形成,但并不会诱导破骨细胞发生凋亡。而临床上常用的二磷酸盐以及其他植物提取物(比如佛手柑内酯等)会引起细胞的凋亡[13-15]。这说明橄榄苦苷对破骨细胞的抑制作用不是通过使其凋亡实现。CTSK是破骨细胞特异性的标志物,属于一种半胱氨酸蛋白酶,可以对Ⅰ型胶原有切开作用,作用位置位于胶原纤维间隙的边缘,有降解胶原的功能[16]。在骨破坏相关疾病中,在破骨细胞数量增长的同时破骨细胞骨吸收活性也会加强。在本研究中,通过牛骨片实验,发现橄榄苦苷对破骨细胞的骨吸收功能也有抑制作用。NFATC1是RANKL诱导的破骨细胞分化的重要调控因子,位于p38/MAPK信号通路的下游[17-18]。本研究发现,在破骨细胞中,橄榄苦苷能够下调p38/MAPK信号通路,同时下调NFATC1。这表明橄榄苦苷可能是通过p38/MAPK信号通路抑制破骨细胞的形成分化及骨吸收。
综上所述,在体外实验中,橄榄苦苷对破骨细胞分化及骨吸收功能均有抑制作用, 这可能和下调p38/MAPK信号通路有关,这可为防治多种骨破坏相关疾病提供理论和实验基础。但橄榄苦苷对多种骨破坏相关动物模型的体内作用机制还不完全清楚, 仍需要进一步研究。
| [1] | LUO D, REN H, LI T, et al. Rapamycin reduces severity of senile osteoporosis by activating osteocyte autophagy[J]. Osteoporos Int, 2016, 27(3): 1093–101. DOI:10.1007/s00198-015-3325-5 |
| [2] | FANALE D, AMODEO V, BAZAN V, et al. Can the microRNA expression profile help to identify novel targets for zoledronic acid in breast cancer?[J]. Oncotarget, 2016, 7(20): 29321–2932. DOI:10.18632/oncotarget.8722am |
| [3] | EASTWOOD S E, JOHN A, JONES S A, et al. Osteoclastogenesis-related cytokines and peri-prosthetic osteolysis in revision metal-on-metal total hip replacements[J]. HipInt, 2015, 25(4): 355–360. DOI:10.5301/hipint.5000241 |
| [4] | KOTIAN P, BOLOOR A, SREENIVASAN S. Study of Adverse Effect Profile of Parenteral Zoledronic Acid in Female Patients with Osteoporosis[J]. J Clin Diagn Res, 2016, 10(1): OC04–6. DOI:10.7860/JCDR/2016/17061.7021 |
| [5] | BEAUDOIN C, JEAN S, BESSETTE L, et al. Denosumab compared to other treatments to prevent or treat osteoporosis in individuals at risk of fracture: a systematic review and meta-analysis[J]. Osteoporos Int, 2016, 27(9): 2835–2844. DOI:10.1007/s00198-016-3607-6 |
| [6] | CAGLAYAN K, GüNGöR B, CINAR H, et al. Effects of oleuropein on serum inflammatory cytokines and histopathological changes in rats with pancreatitis[J]. Adv Clin Exp Med, 2015, 24(2): 213–218. DOI:10.17219/acem/40453 |
| [7] | VIRRUSO C, ACCARDI G, COLONNA-ROMANO G, et al. Nutraceutical properties of extra-virgin olive oil: a naturalremedy for age-related disease[J]. Rejuvenation Res, 2014, 17(2): 217–220. DOI:10.1089/rej.2013.1532 |
| [8] | SANTIAGO-MORA R, CASADO-DíAZ A, DECASTRO M D, et al. Oleuropein enhances osteoblastogenesis and inhibits adipogenesis: the effect on differentiation in stem cells derived from bone marrow[J]. Osteoporos Int, 2011, 22(2): 675–684. DOI:10.1007/s00198-010-1270-x |
| [9] | HAGIWARA K, GOTO T, ARAKI M, et al. Olive polyphenol hydroxytyrosol prevents bone loss[J]. Eur J Pharmacol, 2011, 662(1-3): 78–84. DOI:10.1016/j.ejphar.2011.04.023 |
| [10] | CHIN K Y, IMA-NIRWANA S. Olives and Bone: A Green Osteoporosis Prevention Option[J]. Int J Environ Res Public Health, 2016, 13(8): 755. DOI:10.3390/ijerph13080755 |
| [11] | KURODA Y, MATSUO K. Molecular mechanism of triggering, amplifying and targeting RANK signaling in osteoclasts[J]. World J Orthop, 2012, 3(11): 167–174. DOI:10.5312/wjo.v3.i11.167 |
| [12] |
付生龙, 庞浩, 吴雪晖, 等. 小鼠EPCs和RAW264.7细胞株体外联合培养体系的建立[J].
第三军医大学学报, 2013, 35(2): 119–122.
FU S L, PANG H, WU X H, et al. Establishment of co-culture system of mouse endothelial progenitor cells and RAW264.7 cells[J]. J Third Mil Med Univ, 2013, 35(2): 119–122. DOI:10.16016/j.1000-5404.2013.02.007 |
| [13] | TSUBAKI M, KOMAI M, ITOH T, et al. Nitrogen-containing bisphosphonates inhibit RANKL-and M-CSF-induced osteoclast formation through the inhibition of ERK1/2 and Akt activation[J]. J Biomed Sci, 2014, 21(1): 10. DOI:10.1186/1423-0127-21-10 |
| [14] | HE L G, LI X L, ZENG X Z, et al. Sinomenine induces apoptosis in RAW 264.7 cell-derived osteoclasts in vitro via caspase-3 activation[J]. Acta Pharmacol Sin, 2014, 35(2): 203–210. DOI:10.1038/aps.2013.139 |
| [15] | ZHENG M, GE Y, LI H, et al. Bergapten prevents lipopolysaccharide mediated osteoclast formation, bone resorption and osteoclast survival[J]. Int Orthop, 2014, 38(3): 627–634. DOI:10.1016/10.1007/s00264-013-2184-y |
| [16] | VERBOVšEK U, MOTALN H, ROTTER A, et al. Expression Analysis of All Protease Genes Reveals Cathepsin K to Be Overexpressed in Glioblastoma[J]. PLoS 0ne, 2015, 10(10): e0142116. DOI:10.1371/journal.pone.0142116 |
| [17] | DEEPAK V, KRUGER M C, JOUBERT A, et al. Piperine alleviates osteoclast formation through the p38/c-Fos/NFATc1 signaling axis[J]. Biofactors, 2015, 41(6): 403–413. DOI:10.1002/biof.1241 |
| [18] | MOON S H, CHOI S W, KIM S H. In vitro anti-osteoclastogenic activity of p38 inhibitor doramapimod via inhibiting migration of pre-osteoclasts and NFATc1 activity[J]. J Pharmacol Sci, 2015, 129(3): 135–142. DOI:10.1016/j.jphs.2015.06.008 |



