2. 400038 重庆,第三军医大学基础医学部生理学教研室,重庆市神经科学研究所
2. Department of Physiology, Chongqing Institute of Neurosciences College of Basic Medical Sciences, Third Military Medical University, Chongqing, 400038, China
正常的睡眠对于维持神经元代谢稳态、突触可塑性具有重要作用[1-5]。大量研究表明,睡眠剥夺 (sleep deprivation, SD) 可引起神经元的代谢紊乱和认知功能受损[6-10],但其具体细胞机制尚不清楚。睡眠-觉醒状态的维持依赖于睡眠-觉醒系统的调节[11],因此睡眠剥夺引起的觉醒延长很有可能影响觉醒系统神经元自身活动的改变。蓝斑是脑内促觉醒系统的重要组成部分。Zhang等[12]发现短时间的全睡眠剥夺导致蓝斑神经元的抗氧化 (antioxidant) 水平升高,长时程的全睡眠剥夺则会使抗氧化与氧化系统失衡引起过度的氧化应激,进而造成神经元代谢紊乱及凋亡。众所周知,抗氧化反应对维持神经元代谢稳态起着重要作用[13]。然而,不同时程和类型的睡眠剥夺对蓝斑神经元的抗氧化水平及其他维持神经元代谢稳态的重要活动 (如自噬) 会产生何种影响,目前尚不清楚。
自噬 (autophagy) 是细胞对外源性刺激的一种适应性反应和防御机制。自噬对维持神经元的能量代谢稳态同样有至关重要的作用[14]。Chen等[15]发现小鼠皮层神经元基础自噬活动表现出明显的节律性。基础水平的自噬不但可以调控长寿蛋白、过氧化物以及细胞器的更新,同时可以清除神经元内受损的细胞器、代谢废物等。自噬活动异常又会造成神经元的代谢环境紊乱、基因损伤等[13]。有研究发现慢性睡眠剥夺引起的海马和皮层脑区神经元自噬活动的异常可能与睡眠剥夺所致的认知功能下降有关[16]。而自噬在睡眠剥夺所致神经元稳态中的作用尚少见报道。因此,本研究采用不同时程和类型的睡眠剥夺模型,通过Western blot和免疫组化的方法检测蓝斑神经元SOD2、catalase、LC3-Ⅱ、P62以及LAMP-1蛋白的表达,探究睡眠剥夺对蓝斑神经元抗氧化水平及自噬活动的影响。
1 材料与方法 1.1 实验动物及分组SPF级成年 (8~10周) 雄性C57BL/6小鼠,体质量23~26 g,由第三军医大学实验动物中心提供。所有小鼠饲养于正常昼夜节律条件下,每日06:00开灯,18:00关灯,自由摄食饮水,环境温度23~26 ℃。小鼠分为SD 6 h组与其正常对照组 (n=8)、SD 12 h组与其正常对照组 (n=8) 以及RSD组与其正常对照组 (n=11,其中蛋白免疫印迹8只、免疫组化3只)。
1.2 全睡眠剥夺模型的建立采用轻柔刺激法进行全睡眠剥夺,睡眠剥夺期间持续灯光照射,小鼠可自由饮水、摄食。小鼠的睡眠-觉醒状态可根据其行为学进行判断。清醒时表现为摄食、走动、梳理或者俯卧但睁目并且偶尔活动等行为;而睡眠时表现为身体蜷缩或贴地、静止不动闭目,若进入快动眼睡眠期可以观察到胡须、耳朵等有轻微、快速的活动[6]。当发现小鼠有进入睡眠的相关行为时,轻拍笼壁,拨动其周围的垫料,轻轻晃动笼子,或者用毛笔轻触其躯干毛发,使其维持清醒。睡眠剥夺开始前3 d,每天对所有动物 (包括对照组) 均使用轻柔刺激法进行适应操作1 h (20:00~21:00),适应过后,动物对操作不表现出强烈的反应,如惊慌逃跑,跳动,快速躲避等。SD 6 h和SD 12 h从08:00开始 (SD 6 h:08:00~ 14:00,SD 12 h:08:00~20:00)。对照组和睡眠剥夺组置于相同的环境中,但不对其睡眠-觉醒状态进行干扰。
1.3 REM睡眠剥夺模型的建立利用改良多平台法 (modified multiple platform method,MMPM) 建立REM睡眠剥夺模型。使用38 cm×31 cm×17 cm的塑料箱,箱底放置8个直径2.5 cm,高4 cm的平台,水面距平台0.5 cm。小鼠可在平台之间随意活动,自由进食饮水。当其进入REM睡眠后,因肌张力松弛而低头碰触到水或者掉落水中而清醒。对照组使用直径6 cm的大平台,其他的条件同小平台组。实验前3天,每天将对照组和剥夺组小鼠放入相应的箱内适应1 h (17:00~18:00)。连续剥夺7 d,每天剥夺20 h (11:00至次日07:00)。实验期间每天更换箱中的水。
1.4 Western blot检测睡眠剥夺结束后,腹腔注射3%戊巴比妥钠 (3 μL/g) 麻醉。断头取脑,使用震动切片机将脑组织块按冠状面切成1 mm薄片,根据蓝斑和外侧下丘脑的解剖定位用玻璃电极分离出微组织块。每个组织块标本加入含蛋白酶抑制剂的蛋白裂解液,冰面上匀浆,冰冻离心机离心取上清液。BCA法蛋白定量。对照组和睡眠剥夺组以每孔10 μL蛋白上样。SDS聚丙烯酰胺凝胶电泳,SOD2、catalase、LC3-Ⅱ和P62使用12%的分离胶进行电泳,全湿式电转法将胶上的蛋白转移到聚偏二氟乙烯 (PVDF) 膜上。5 %的脱脂奶粉室温封闭1.5 h,一抗4 ℃过夜,使用的一抗为SOD2 (1:10 000,Novus)、catalase (1:1 500,Abcam)、LC3-Ⅱ (1:1 000,Sigma)、P62 (1:1 500,Abcam)。一抗稀释液为含5%脱脂奶粉的Tris-HCl缓冲液 (TBST)。TBST洗脱后,加入二抗 (1:5 000,生工),室温孵育1 h。ECL试剂盒显影。检测条带使用Quantity One软件 (Bio-Rad) 进行灰度半定量分析。每种蛋白灰度值均以对应的b-actin进行标准化,各组数据再以各自对照组均值进行标准化处理。
1.5 免疫荧光染色睡眠剥夺结束后进行灌注固定。37 ℃生理盐水经左心室灌注,4 ℃、4%多聚甲醛固定后取脑。取出的全脑在4%多聚甲醛中过夜后再转移到30%蔗糖溶液中脱水,沉底后进行包埋、冰冻切片,按冠状面进行切片,厚度为20 μm。挑选含蓝斑的脑片,10%驴血清室温封闭1 h。孵育一抗,一抗LAMP-1 (1:500,Abcam)、酪氨酸羟化酶 (trosine hydroxylase,TH) (1:500,Abcam) 使用含0.3%的Triton X-100的5%的驴血清稀释,4 ℃过夜。次日,磷酸盐缓冲液 (PBS) 漂洗3次,5 min/次,加入荧光素标记的相应二抗 (1:500,Thermo),室温避光孵育2 h,PBS漂洗3次后进行贴片,风干后封片。在共聚焦显微镜 (Zesis) 下于同一位置、同一倍数下拍照观察分析。
1.6 统计学分析应用SPSS 18.0统计软件进行统计分析。结果以x±s表示。实验数据采用独立样本的t检验。
2 结果 2.1 睡眠剥夺对蓝斑神经元SOD2和catalase表达的影响分别使用轻柔刺激法和改良多平台法行全睡眠剥夺和REM睡眠剥夺,采用Western blot检测蓝斑神经元的SOD2和catalase表达水平。SOD2和catalase是抗氧化系统中对抗活性氧簇的两个关键酶[14-17],其水平的高低与抗氧化水平呈正比。结果显示,与其对照组[SOD2 (1.00±0.09);catalase (1.00±0.08)]相比,SD 6 h组[SOD2 (1.70±0.16);catalase (1.35±0.13)]显著升高蓝斑神经元SOD2 (P < 0.01) 和catalase (P < 0.05) 表达水平;SD 12 h对蓝斑神经元的SOD2和catalase表达均无明显影响;与RSD对照组[SOD2 (1.00±0.08);catalase (1.00±0.12)]相比,RSD组[SOD2 (0.70±0.09);catalase (0.63±0.12)]使蓝斑神经元SOD2(P < 0.05) 和catalase (P < 0.05) 表达量均显著下调 (图 1)。外侧下丘脑 (lateral hypothalamus,LH) 是除蓝斑外另一重要促觉醒脑区[11, 18],作为对照脑区,SD 6、12 h和RSD对外侧下丘脑神经元SOD2和catalase表达量均无明显影响 (图 1)。以上结果表明,不同时程和类型的睡眠剥夺对蓝斑神经元抗氧化水平有不同的影响。然而,睡眠剥夺对外侧下丘脑神经元的抗氧化水平无显著影响。
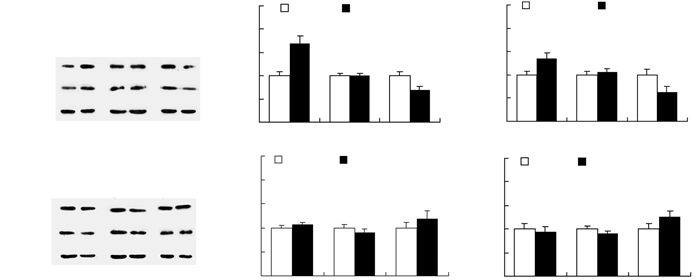
|
| 1:SD 6 h对照组;2:SD 6 h组;3:SD 12 h对照组;4:SD 12 h组;5:RSD对照组;6:RSD组A:LC神经元SOD2和catalase的Western blot检测结果;B:LC神经元SOD2蛋白表达半定量分析;C:LC神经元catalase蛋白表达半定量分析;D:LH神经元SOD2和catalase的Western blot检测结果;E:LH神经元SOD2蛋白表达半定量分析;F:LH神经元catalase蛋白表达半定量分析a:P < 0.05,b:P < 0.01,与对照组比较 (n=8,x±s) 图 1 Western blot检测各组LC和LH神经元的SOD2和catalase表达 |
2.2 睡眠剥夺对蓝斑神经元LC3-Ⅱ、P62表达的影响
采用Western blot检测蓝斑神经元自噬相关蛋白LC3-Ⅱ和P62。自噬过程中LC3-Ⅰ转化为LC3-Ⅱ,LC3-Ⅱ/LC3-Ⅰ比值大小与自噬活动呈正相关。P62是LC3-Ⅱ与泛素化底物相结合的中间介质,随自噬底物在溶酶体中同时被降解。结果显示,SD 6、12 h对蓝斑神经元LC3-Ⅱ/LC3-Ⅰ和P62表达水平均无显著影响;RSD组[LC3-Ⅱ/LC3-Ⅰ:(0.88±0.06);P62:(1.63±0.21)]与其对照组[LC3-Ⅱ/LC3-Ⅰ:(1.00±0.13);P62:(1.00±0.14)]相比,显著下调蓝斑神经元LC3-Ⅱ/LC3-Ⅰ的表达 (P < 0.05),同时P62的表达量显著升高 (P < 0.05,图 2)。而SD 6、12 h和RSD对外侧下丘脑神经元的LC3-Ⅱ和P62的表达水平均无显著影响 (图 2)。以上结果表明,SD 6、12 h对蓝斑神经元的自噬活动无显著影响,而RSD使蓝斑神经元自噬活动显著下调。睡眠剥夺未引起外侧下丘脑神经元自噬活动的明显变化。
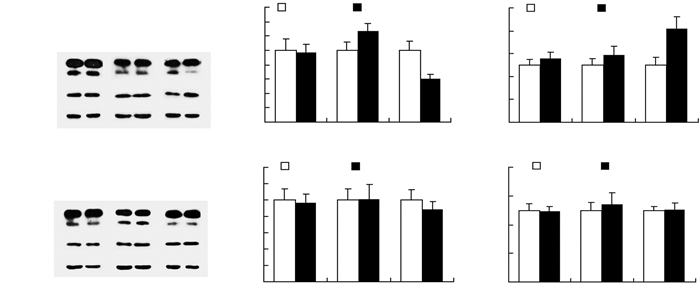
|
| 1:SD 6 h对照组;2:SD 6 h组;3:SD 12 h对照组;4:SD 12 h组;5:RSD对照组;6:RSD组A:LC神经元LC3-Ⅱ/LC3-Ⅰ和P62的Western blot检测结果;B:LC神经元LC3-Ⅱ/LC3-Ⅰ蛋白表达半定量分析;C:LC神经元P62蛋白表达半定量分析;D:LH神经元LC3-Ⅱ/LC3-Ⅰ和P62的Western blot检测结果;E:LH神经元LC3-Ⅱ/LC3-Ⅰ蛋白表达半定量分析;F:LH神经元P62蛋白表达半定量分析a:P < 0.05,与对照组比较 (n=8,x±s) 图 2 Western blot检测各组LC和LH神经元的LC3-Ⅱ和P62情况 |
2.3 RSD对蓝斑神经元LAMP-1表达的影响
进一步采用免疫荧光染色观察RSD对蓝斑神经元自噬活动的影响。LAMP-1表达水平的变化反映了自噬溶酶体途径的激活状态,其表达量与自噬活动水平呈正相关。结果显示,RSD使TH标记的蓝斑去甲肾上腺素能神经元LAMP-1表达水平减弱 (P < 0.05,图 3)。进一步提示RSD显著下调蓝斑神经元的自噬活动。
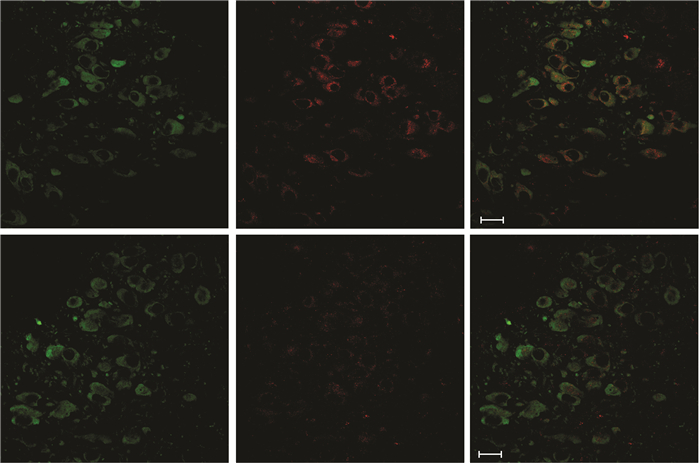
|
| RSD组和其对照组蓝斑神经元TH (绿色) 和LAMP-1(红色) 染色 图 3 免疫荧光染色观察蓝斑神经元LAMP-1的表达情况 |
3 讨论
睡眠对维持神经元代谢稳态有重要的作用,觉醒期间神经元代谢活动增强,相应的代谢产物累积,睡眠期间可清除觉醒期间累积的代谢产物[19]。神经元抗氧化反应和自噬活动在维持神经元代谢稳态中起着关键性的作用[20-21]。然而,睡眠如何通过调节神经元抗氧化反应和自噬活动来进一步维持神经元代谢稳态,目前尚不清楚。本研究通过建立不同时程和类型的睡眠剥夺模型,探究睡眠剥夺对蓝斑神经元抗氧化反应和自噬活动的影响,以揭示睡眠在维持神经元代谢稳态中的作用。
蓝斑作为重要的促觉醒脑区,在觉醒期间神经元持续放电,因而在觉醒期有较大的代谢需求。在神经元供能的同时会产生大量的活性氧簇 (reactive oxygen species,ROS),ROS若不及时清除,则造成神经元氧化应激,代谢紊乱[7]。实验结果表明,SD 6 h引起蓝斑神经元抗氧化水平升高,这种高水平的抗氧化反应足以对抗ROS以维持氧化还原平衡。而此时的自噬活动仍处在基础水平,并未发生明显的变化。SD 12 h对神经元抗氧化水平和自噬活动均为引起显著影响,我们推测抗氧化活动可能从一高反应状态逐渐减弱,而氧化系统的ROS不能及时清除,氧化系统与抗氧化系统不能维持在平衡状态,可能引起氧化应激,但是,此时自噬活动尚不能及时启动或增强对抗氧化应激。RSD显著降低抗氧化水平,表明RSD可能造成蓝斑神经元氧化应激进一步加重,代谢稳态严重失衡。此时RSD因抗氧化水平降低使ROS累积,导致神经元代谢紊乱,可能致自噬活动减弱。在RSD造成的自噬活动减弱之前是否有因氧化应激导致的自噬增强还不得而知[13],也是需要进一步探讨的内容。同时,由于本实验主要观察睡眠剥夺对抗氧化反应和自噬的影响,未检测ROS变化,没有进一步观察是否发生了氧化应激,上述推测仍需进一步实验证实。
本实验中同时还发现睡眠剥夺对外侧下丘脑神经元的抗氧化水平无明显影响。睡眠剥夺引起蓝斑和外侧下丘脑神经元不同的抗氧化反应,提示促觉醒脑区对睡眠剥夺导致的损伤存在敏感性差异,这可能与其在觉醒发生和维持中的作用不同有关[11]。睡眠剥夺对外侧下丘脑神经元自噬活动无明显影响,可能与抗氧化反应尚能维持神经元代谢稳态有关。
综上所述,本研究通过分子生物学和形态学手段,观察了睡眠剥夺对蓝斑神经元代谢活动的影响。尽管Western blot存在的一定局限,无法区分睡眠剥夺的产生的影响是发生在神经元还是胶质细胞中,但实验中我们同时采用免疫组化的方法定位分析蓝斑核中促觉醒神经元 (即TH标记的去甲肾上腺素能神经元) 的LAMP-1,其变化与Western blot结果所反映的自噬趋势相一致。因此,这两部分结合起来即可以阐明我们所关注的问题。实验发现,短时全睡眠剥夺引起蓝斑神经元抗氧化反应一过性升高而自噬活动无明显影响,REM睡眠剥夺后蓝斑神经元抗氧化水平和自噬活动均减弱。更重要的是,本研究从抗氧化反应和自噬活动的角度探讨了睡眠在维持神经元代谢稳态中的重要作用,从而对睡眠的生理功能有了更深入的认识和了解。
| [1] | Xie L, Kang H, Xu Q, et al. Sleep drives metabolite clearance from the adult brain[J]. Science, 2013, 342(6156): 373–377. DOI:10.1126/science.1241224 |
| [2] | Vyazovskiy V V, Harris K D. Sleep and the single neuron:the role of global slow oscillations in individual cell rest[J]. Nat Rev Neurosci, 2013, 14(6): 443–451. DOI:10.1038/nrn3494 |
| [3] | Yang G, Lai C S, Cichon J, et al. Sleep promotes branch-specific formation of dendritic spines after learning[J]. Science, 2014, 344(6188): 1173–1178. DOI:10.1126/science.1249098 |
| [4] | Hengen K B, Torrado Pacheco A, McGregor J N, et al. Neuronal Firing Rate Homeostasis Is Inhibited by Sleep and Promoted by Wake[J]. Cell, 2016, 165(1): 180–191. DOI:10.1016/j.cell.2016.01.046 |
| [5] | Dudai Y, Karni A, Born J. The Consolidation and Transformation of Memory[J]. Neuron, 2015, 88(1): 20–32. DOI:10.1016/j.neuron.2015.09.004 |
| [6] | Xie M, Yan J, He C, et al. Short-term sleep deprivation impairs spatial working memory and modulates expression levels of ionotropic glutamate receptor subunits in hippocampus[J]. Behav Brain Res, 2015, 286: 64–70. DOI:10.1016/j.bbr.2015.02.040 |
| [7] | Villafuerte G, Miguel-Puga A, Rodr guez E M, et al. Sleep deprivation and oxidative stress in animal models:a systematic review[J]. Oxid Med Cell Longev, 2015, 2015: 234952. DOI:10.1155/2015/234952 |
| [8] | Xie M, Li C, He C, et al. Short-term sleep deprivation disrupts the molecular composition of ionotropic glutamate receptors in entorhinal cortex and impairs the rat spatial reference memory[J]. Behav Brain Res, 2016, 300: 70–76. DOI:10.1016/j.bbr.2015.10.002 |
| [9] | Lima A M, de Bruin V M, Rios E R, et al. Differential effects of paradoxical sleep deprivation on memory and oxidative stress[J]. Naunyn Schmiedebergs Arch Pharmacol, 2014, 387(5): 399–406. DOI:10.1007/s00210-013-0955-z |
| [10] |
胡志安, 夏建霞. 觉醒系统的活动对学习记忆的影响[J].
第三军医大学学报, 2011, 33(11): 1091–1094.
Hu Z A, Xia J X. Influence of activities in arousal system on learning and memory[J]. J Third Mil Med Univ, 2011, 33(11): 1091–1094. DOI:10.16016/j.1000-5404.2011.11.001 |
| [11] | Sakurai T. The neural circuit of orexin (hypocretin):maintaining sleep and wakefulness[J]. Nat Rev Neurosci, 2007, 8(3): 171–181. DOI:10.1038/nrn2092 |
| [12] | Zhang J, Zhu Y, Zhan G, et al. Extended wakefulness:compromised metabolics in and degeneration of locus ceruleus neurons[J]. J Neurosci, 2014, 34(12): 4418–4431. DOI:10.1523/JNEUROSCI.5025-12.2014 |
| [13] | Filomeni G, De Zio D, Cecconi F. Oxidative stress and autophagy:the clash between damage and metabolic needs[J]. Cell Death Differ, 2015, 22(3): 377–388. DOI:10.1038/cdd.2014.150 |
| [14] | Galluzzi L, Pietrocola F, Levine B, et al. Metabolic control of autophagy[J]. Cell, 2014, 159(6): 1263–1276. DOI:10.1016/j.cell.2014.11.006 |
| [15] | Chen X, Kondo K, Motoki K, et al. Fasting activates macroautophagy in neurons of Alzheimer's disease mouse model but is insufficient to degrade amyloid-beta[J]. Sci Rep, 2015, 5: 12115. DOI:10.1038/srep12115 |
| [16] |
邱红艳, 李崧, 乐卫东. 慢性睡眠剥夺对小鼠学习记忆及神经元自噬和凋亡的影响[J].
中华神经外科杂志, 2015, 48(7): 564–569.
Qiu H Y, Li S, Yue W D. Impacts of chronic sleep deprivation on learning and memory, autophagy and neuronal apoptosis in mice[J]. Chinese Journal of Neurology, 2015, 48(7): 564–569. DOI:10.3760/cma.j.issn.1006-7876.2015.07.005 |
| [17] | Pi H, Xu S, Reiter R J, et al. SIRT3-SOD2-mROS-dependent autophagy in cadmium-induced hepatotoxicity and salvage by melatonin[J]. Autophagy, 2015, 11(7): 1037–1051. DOI:10.1080/15548627.2015.1052208 |
| [18] | Chen Q, de Lecea L, Hu Z, et al. The hypocretin/orexin system:an increasingly important role in neuropsychiatry[J]. Med Res Rev, 2015, 35(1): 152–197. DOI:10.1002/med.21326 |
| [19] | Petit J M, Burlet-Godinot S, Magistretti P J, et al. Glycogen metabolism and the homeostatic regulation of sleep[J]. Metab Brain Dis, 2015, 30(1): 263–279. DOI:10.1007/s11011-014-9629-x |
| [20] | Yamamoto A, Yue Z. Autophagy and its normal and pathogenic states in the brain[J]. Annu Rev Neurosci, 2014, 37: 55–78. DOI:10.1146/annurev-neuro-071013-014149 |
| [21] | Menzies F M, Fleming A, Rubinsztein D C. Compromised autophagy and neurodegenerative diseases[J]. Nat Rev Neurosci, 2015, 16(6): 345–357. DOI:10.1038/nrn3961 |



