2. 400038 重庆, 第三军医大学西南医院超声科;
3. 430072 武汉,中国科学院水生生物研究所淡水生态与生物技术国家重点实验室
2. Department of Ultrasonography, Southwest Hospital, Third Military Medical University, Chongqing, 400038;
3. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan, Hubei Province, 430072, China
G250抗原于1986年被发现,因其在85%以上的肾癌细胞中表达,而在正常肾脏及良性肾脏病变如肾盂肾炎、肾囊肿等不表达,又被称为肾癌相关抗原,是一种跨膜蛋白,可作为靶向治疗的靶标[1]。后来发现G250与在HeLa细胞中发现的MN/碳酸酐酶Ⅸ(CA Ⅸ) 是同一种物质,具有碳酸酐酶活性,参与肿瘤生长和转移[2]。既往的研究中,我们将G250单克隆抗体与超声纳米微泡相连,制备出了靶向纳米微泡,发现其对肾癌细胞具有特异性靶向结合作用[3]。由于单克隆抗体相对分子质量大、体积大,不利于超声微泡的小型化和组织穿透性,而纳米抗体作为最小的功能性抗原结合片段,其独特的生物学结构特征赋予了它们许多优势,如体积非常小、稳定性强、可溶性好、免疫原性低、容易表达等[4],因此,我们拟采用纳米抗体取代单克隆抗体。本研究通过真核表达G250抗原胞外区,以其免疫骆驼,制备抗G250胞外区的纳米抗体并鉴定,为下一步的靶向显像和治疗奠定基础。
1 材料与方法 1.1 材料 1.1.1 质粒与细胞株包含人源G250基因cDNA序列的质粒pMD-CAIX购自北京义翘神州生物技术有限公司,真核表达载体pRAG2a (含Sig-BM40信号肽和C端6His-tag标签) 购自上海锐劲生物技术有限公司。HEK 293F细胞购自Invitrogen,HeLa细胞和肾细胞腺癌细胞株ACHN购自中科院上海细胞库。噬菌体载体pMECS、大肠杆菌Top 10、ER2738、HB2151为本实验室保存。
1.1.2 主要试剂限制性内切酶和其他工具酶主要购自美国NEB和Thermo Scientific公司,PCR反应均使用日本TaKaRa公司的KOD plus酶,质粒抽提及DNA回收试剂盒购自美国Axygen公司,mRNA纯化试剂盒购自美国Promega公司,cDNA合成试剂盒购自Thermo Scientific公司。转染所用的阳离子脂质体293fectin购自美国Invitrogen公司。鼠抗人G250抗体购自武汉三鹰生物技术有限公司,Anti-M13-HRP鼠单抗购自GE Healthcare公司,羊抗鼠-FITC和羊抗鼠-HRP购自上海康成生物工程有限公司。所有引物由苏州金维智生物科技有限公司合成,细胞培养中用到的培养基和胎牛血清购均自美国Gibco公司,其他化学试剂购自国药集团和美国Sigma公司。
1.2 方法 1.2.1 G250胞外区的真核表达利用引物对G250ECD-VF (5′-GATCAGCTAGCACAGAGGTTGCCC-CGGATGCA-3′) 和G250ECD-VR (5′-CATGACTCGAGGTCACCAGCAGCCAGGCAG-3′) 从模板质粒pMD-CAIX中扩增出包含G250胞外区Gln38至Asp414区间 (以下简称G250蛋白) 的DNA片段,使用NheⅠ和XhoⅠ限制性内切酶将其插入到真核表达载体pRAG2a中。构建的重组质粒转化到感受态细胞E.coli Top 10,通过菌落PCR鉴定出阳性克隆,并最终经测序验证得到正确的质粒pRAG2a-huG250ECD。大量抽提所得质粒后,使用293fectin将质粒DNA转染到HEK 293F细胞进行悬浮培养和目的蛋白的瞬时表达。细胞培养5 d后,离心收集培养上清,使用Ni-6FF (TED) 镍柱纯化目的蛋白,并用SDS-PAGE凝胶电泳分析各组分和纯化的G250蛋白。将纯化后的蛋白进行SDS-PAGE后,电转移到PVDF膜上,用5%脱脂牛奶封闭后,加入鼠抗人G250抗体 (1 :1 000稀释),于4 ℃孵育过夜,漂洗后加入羊抗鼠-HRP并于室温下孵育1 h,漂洗后加氟显色液进行显影。
1.2.2 免疫纳米抗体库的构建2头约两岁的雄性新疆双峰骆驼被用于免疫,免疫注射共进行了8次,持续时间为105 d。前2次的免疫时间点分别为第0天和第17天,每只骆驼每次注射的抗原用量分别为50 μg和100 μg。随后的免疫时间点分别在第40、59、74天和第87天,注射的抗原用量为每次300 μg。最后2次的加强免疫在1周内完成,时间点分别是第102天和第105天。1周后,分别从每只骆驼采集200 mL外周血,用于免疫文库构建。
经TRIzol试剂提取骆驼外周血淋巴细胞的总RNA,提取mRNA,并mRNA反转录为cDNA。然后使用两步法PCR扩增出骆驼重链抗体的重链可变区 (variable domain of heavy chain of heavy-chain antibody, VHH) 基因片段。第1步PCR使用引物对为CALL001(5′-GTCCTGGCTGCTCTTCTACAAGG-3′) 和CALL002(5′-GGTACGTGCTGTTGAACTGTTCC-3′)[5]。通过凝胶电泳切胶回收700 bp的DNA片段,然后以其为模板,使用引物对VHH-Back (5′-GATGTGCAGCTGCAGGAGTCTGGRGGAGG-3′) 和PMCF (5′-CTAGTGCGGCCGCTGAGGAGACGGTGACCTGGGT-3′)[6]进行第2次PCR扩增,得到条带大小约为400 bp的VHH基因片段。通过琼脂糖凝胶电泳分离目的片段,纯化后使用PstⅠ和NotⅠ进行双酶切,使用T4 DNA连接酶连接到同样经PstⅠ/NotⅠ双酶切的pMECS载体。连接产物与3 mL新鲜制备的感受态大肠杆菌TG1细胞混合,分装到60只转化杯进行电转化。转化后的细胞重悬于50 mL SOC培养基,在37 ℃保温1 h后,涂布在包含100 μg/mL氨苄青霉素和质量浓度为2%的葡萄糖的2×TY平板,37 ℃培养过夜。最后,从平板上刮下来的菌落重悬于100 mL LB培养基,加入15%终浓度的甘油后,分装冻存于-80 ℃。
1.2.3 针对G250胞外区的纳米抗体的淘选使用上述构建的噬菌体展示VHH免疫文库。针对G250蛋白进行了3轮体外定向筛选,以分离出能与G250特异性结合的纳米抗体。简而言之,从文库中取出约4×1010转化后的TG1细胞,接种到包含100 μg/mL氨苄青霉素和质量浓度为1%的葡萄糖的2×TY培养基进行培养。2 h后,加入4×1010辅助噬菌体M13KO7,在室温下孵育30 min进行感染。离心收集感染后的细胞,重悬于包含100 μg/mL氨苄青霉素和50 μg/mL卡那霉素的2×TY培养基,于37 ℃和220 r/min条件下培养过夜。离心分离培养上清,加入PEG 6 000/NaCl (20% PEG 6 000和2.5 mol/L NaCl) 溶液沉淀和浓缩噬菌体颗粒,并最终重悬于无菌和预冷的PBS缓冲液。
定向筛选实验采用固相淘选方法,在Maxisorp ELISA 96孔板上进行了3轮筛选。每轮具体的操作方法如下:用碳酸盐缓冲液 (pH=9.6) 将G250蛋白稀释成100 μg/mL,每孔加入100 μL,4 ℃包被过夜;用PBS洗1次,加入2% BSA-PBS溶液在室温下封闭2 h;用PBST (含0.1% Tween-20) 洗3次后,加入含1% BSA和0.1% Tween-20的噬菌体抗体库,于37 ℃孵育2 h,用PBST洗涤20次 (逐轮增加10次) 以去除不能结合或弱结合的噬菌体颗粒。最后以100 μL洗脱液 (甘氨酸-盐酸,pH=2.2) 洗脱吸附的噬菌体颗粒,重复洗脱1次,随后用中和液 (Tris-HCl,pH=9.1) 中和酸性的洗脱液,加入到对数生长中期的大肠杆菌ER2738进行感染、计数和扩增,然后用于下一轮筛选。
1.2.4 Monoclonal phage-ELISA鉴定阳性克隆从第2轮和第3轮筛选后的克隆中,随机挑选单克隆进行培养和噬菌体援救,随后进行monoclonal phage-ELISA实验,以鉴定出能特异性结合G250蛋白的阳性纳米抗体克隆。为此目的,分别将2 μg/mL的G250蛋白以及阴性对照蛋白牛血清白蛋白 (BSA) 包被到96孔ELISA平板,用PBS洗1次,加入2% BSA在室温下封闭2 h。用PBST洗板3次后,每孔加入100 μL含1% BSA和0.1% Tween-20的噬菌体样品,同时以不展示VHH的野生型M13KO7噬菌体为阴性对照样品,在37 ℃孵育2 h。用PBST洗板3次后,每孔加入100 μL含1% BSA的anti-M13-HRP抗体 (1 :5 000稀释),在37 ℃孵育1 h。用PBST洗板6次后,每孔加入TMB显色液100 μL,在室温下反应15 min,随后加入50 μL硫酸 (浓度为2 mol/L) 终止显色,并在酶标仪上使用双波长法测定光密度值[D(450~630)]。
1.2.5 阳性克隆的细胞ELISA鉴定分别以2×104/孔的量接种G250表达阳性的HeLa细胞和表达阴性的ACHN细胞于96孔细胞培养板,100 μL/孔,过夜培养。用含1% BSA的PBS溶液洗涤1次后,以4%多聚甲醛固定,并滴加3%过氧化氢溶液以阻断内源性过氧化物酶活性,于室温下孵育30 min。PBS洗板3次,加入含2% BSA的PBS溶液于37 ℃孵育2 h进行封闭。按照1.2.4的方法,同样加入待分析样品和阴性对照样品M13KO7,进行后续实验。
1.2.6 针对G250胞外区的纳米抗体的原核表达及纯化将包含噬菌体质粒的大肠杆菌ER2738接种到400 mL 2×TY培养基,培养至D(600) 约为0.6时,加入1 mmol/L的异丙基硫代半乳糖苷 (IPTG) 进行诱导表达,于28 ℃培养过夜。收集菌体,使用TES缓冲液进行周质腔蛋白抽提。G250特异的纳米抗体C端融合了6His-tag,可以通过Ni-6FF (TED) 镍柱纯化,使用250 mmol/L咪唑缓冲液洗脱。使用超滤管将洗脱样品的缓冲液置换为PBS (pH=7.4),使用BCA法测定蛋白浓度,并用SDS-PAGE电泳分析蛋白纯度,最后加入5%甘油,分装保存。
1.2.7 流式细胞仪鉴定纳米抗体的特异性细胞结合活性分别将HeLa细胞和ACHN细胞用含1%胎牛血清 (FBS) 的PBS溶液 (简称为FBS-PBS溶液) 洗涤1次,分装为5×105/管用于实验。每种细胞分别加入100 nmol/L浓度的纳米抗体,冰浴1 h;同样条件下分别加入PBS作为阴性对照。用FBS-PBS溶液洗涤2次后,加入1 :100稀释的二抗anti-HA鼠单抗,冰浴1 h。用FBS-PBS溶液洗涤2次后,加入FITC标记的羊抗鼠 (1 :100稀释),冰浴1 h。用FBS-PBS溶液洗涤2次后,加入200 μL FBS-PBS溶液,使用Beckman Coulter的MoFlo XDP进行检测。
2 结果 2.1 G250蛋白胞外区的表达质粒pRAG2a-huG250ECD构建和转化后,采用菌落PCR对随机挑取的菌落进行鉴定,并进行琼脂糖凝胶电泳分析。目标条带长度为1 266 bp (图 1),挑取的2个克隆均为阳性克隆,经DNA测序和比对,克隆序列与G250蛋白的对照序列完全一致。对纯化后的G250蛋白进行SDS-PAGE凝胶电泳分析,在预期位置出现明确条带,纯度大于90%(图 2A)。使用鼠抗人G250单抗对纯化的G250蛋白进行Western blot检测 (图 2B),结果表明该重组蛋白成功在真核细胞HEK 293F中高效表达。
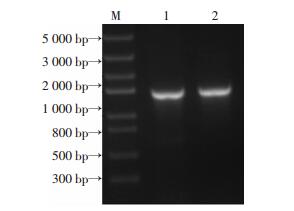
|
| M:DNA标准;1、2:随机挑取的细菌克隆的PCR产物,其PCR条带与1 266 bp的目标条带长度一致 图 1 G250真核表达质粒的细菌克隆PCR电泳结果 |

|
| A:G250蛋白纯化中各组分的SDS-PAGE电泳结果在还原条件下,G250蛋白的相对分子质量为50×103;1:表达上清;2:流穿样品;3:洗杂样品;4:50 mmol/L咪唑洗脱样品;5: 250 mmol/L咪唑洗脱样品使用anti-G250抗体进行检测,目的条带相对分子质量约为50×103;M:蛋白标准;B:Western blot检测结果 图 2 G250蛋白表达纯化及鉴定结果 |
2.2 免疫纳米抗体库的构建
以免疫后的骆驼外周血淋巴细胞总RNA为源头,经mRNA分离和反转录后得到的cDNA为模板,使用巢式PCR经2次扩增得到VHH抗体DNA片段。第1次扩增得到了缺少CH1结构域的VHH抗体基因片段 (长度约700 bp的主带) 以及传统的骆驼抗体基因片段 (长度约1 000 bp)(图 3A)。通过切胶回收700 bp的条带,并以此为模板,进行第2次PCR得到长度约400 bp的VHH基因片段 (图 3B)。经过PstⅠ和NotⅠ双酶切的VHH片段与经同样双酶切的pMECS载体连接后,电转化到TG1感受态细胞。pMECS噬菌体载体在VHH的C端融合了HA-tag和6His-tag,便于阳性克隆的鉴定和VHH抗体纯化。多次电转化后的梯度计数结果显示:最终成功得到了库容为2.87×109的噬菌体展示骆驼VHH免疫文库。
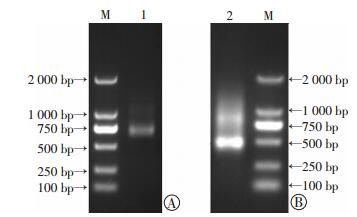
|
| A:第1次PCR鉴定结果;B:第2次PCR鉴定结果M:DNA标准; 1:第1次PCR产物,得到约700 bp的目的片段和约1 000 bp的传统骆驼抗体基因片段;2:第2次PCR产物,得到含PstⅠ和NotⅠ酶切位点约400 bp的VHH DNA片段 图 3 VHH DNA片段扩增的琼脂糖凝胶电泳结果 |
2.3 针对G250蛋白的噬菌体展示库淘选结果
为了从免疫库中筛选到与G250蛋白结合能力强的纳米抗体,采用了逐轮增加筛选压力的策略,主要包括降低抗原用量、增加表面活性剂浓度和洗涤次数的方法。各轮筛选的数据,包括投入噬菌体数量 (Input)、洗脱后得到的噬菌体数量 (Output)、回收率 (Output/Input) 以及富集度如表 1所示。结果表明:在每轮的Input略微减少的情况下,尽管筛选压力逐轮增大,Output中噬菌体数量仍然有明显提升,其中第2轮的富集度最高,第3轮富集度降低为6.2倍,推测阳性噬菌体颗粒在第3轮筛选后已经得到足够富集。
| 筛选轮数 | Input | Output | 回收率 | 富集度 |
| 第1轮 | 2.1×1012 | 2.6×106 | 1.2×10-6 | - |
| 第2轮 | 1.2×1012 | 6.3×107 | 5.3×10-5 | 44.2 |
| 第3轮 | 8.0×1011 | 2.6×108 | 3.3×10-4 | 6.2 |
将各轮的Input噬菌体分别对G250蛋白和阴性对照蛋白BSA进行phage pool ELISA检测 (图 4),结果表明:随着筛选次数的增加,用于筛选的混合噬菌体颗粒对G250蛋白的识别信号明显增强,而对BSA的结合信号基本不变。
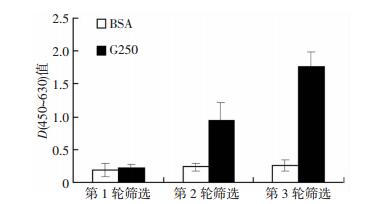
|
| 图 4 各轮筛选中Input phage pool ELISA结果 |
采用各轮筛选的Input噬菌体样品分别对G250蛋白和对照蛋白BSA进行phage ELISA检测。结果显示:Input phage样品与G250蛋白的结合信号逐轮增强。
从第2轮和第3轮筛选后的Output中,分别随机挑取188个单克隆菌落,通过Monoclonal phage ELISA方法鉴定与G250蛋白特异性结合的纳米抗体。结果表明:以对G250的结合值大于BSA对照组结合值[D(450~630)]大于3倍为标准,从第2轮鉴定出35个阳性克隆,阳性率为18.6%;从第3轮鉴定出102个阳性克隆,阳性率为54.3%。分别挑取不同结合强度的克隆,对其中60个克隆进行测序分析后,最终得到9个不同序列的VHH抗体克隆,其phage ELISA结果如图 5所示。
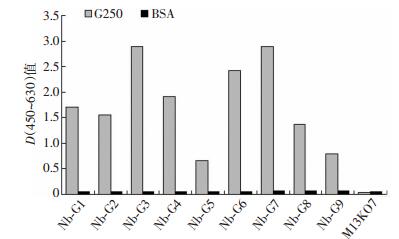
|
| 图 5 9个VHH抗体克隆对G250蛋白作用的monoclonal phage ELISA鉴定结果 |
从第2轮和第3轮筛选后的阳性克隆中共鉴定出9个不同的VHH抗体克隆,这些克隆在monoclonal phage ELISA实验中显示出对G250蛋白的特异性结合能力。
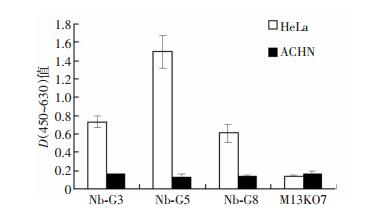
2.4 细胞ELISA鉴定为了验证筛选到的纳米抗体的细胞结合活性,通过细胞ELISA检测了9个具有抗原结合活性的纳米抗体噬菌体颗粒。其中克隆Nb-G3、Nb-G5和Nb-G8能特异性结合G250表达阳性的HeLa细胞,不与G250表达阴性的ACHN细胞结合。其余克隆不具有细胞结合活性,推测是由于G250蛋白分子与细胞表面的G250构象上的差异造成。
纳米抗体Nb-G3、Nb-G5和Nb-G8能特异性结合G250表达阳性的HeLa细胞,不与G250表达阴性的ACHN细胞结合 (图 6)。M13KO7为野生型噬菌体作为阴性对照样品。
|
| 图 6 细胞ELISA检测纳米抗体克隆与HeLa细胞和ACHN细胞的结合情况 |
2.5 纳米抗体的表达和纯化
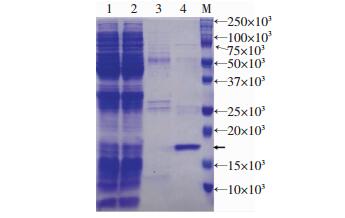
为了表达和纯化筛选得到的纳米抗体,包含Nb-G5纳米抗体序列质粒的大肠杆菌ER2738被直接用于培养和诱导表达。ER2738是琥珀终止子抑制型大肠杆菌,约20%的琥珀终止子能被翻译为谷氨酸 (Glu),因此,目的蛋白中约20%为纳米抗体与g3蛋白形成的融合,其余为不含g3蛋白的纳米抗体。使用TES缓冲液将周质腔中的可溶性纳米抗体抽提出来后,通过镍柱进行纯化。SDS-PAGE电泳结果显示,纯化后的纳米抗体具有很好的纯度 (图 7),其纯度约为90%。G250特异的纳米抗体Nb-G5的产量为1.5 mg/L培养物。
|
| 1:未诱导的菌液;2:诱导表达的菌液;3: 50 mmol/L咪唑洗脱样品;4: 250 mmol/L咪唑洗脱样品;M:蛋白质标准 图 7 纯化后的纳米抗体Nb-G5的SDS-PAGE电泳结果 |
2.6 流式细胞仪鉴定纳米抗体的特异性结合活性
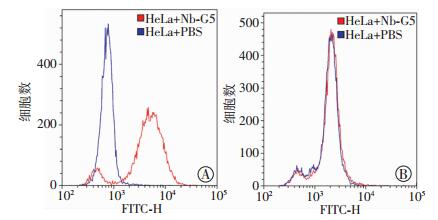
为了检验得到的纳米抗体的特异性细胞结合能力,使用流式细胞仪分别检测了纳米抗体Nb-G5与G250表达阳性的HeLa细胞和表达阴性的ACHN细胞的结合情况 (图 8)。检测所用的纳米抗体的浓度为100 nmol/L,Nb-G5和PBS对照与HeLa细胞的平均荧光强度 (MFI) 分别为9 723.2和749.8,与ACHN细胞的MFI分别为4 343.5和3 183.5。在与HeLa细胞的直方图上,纳米抗体Nb-G5显示出强烈的荧光信号偏移。由此可见,Nb-G5具有很好的细胞结合能力和结合特异性。
|
| A:纳米抗体Nb-G5和阴性对照PBS与G250表达阳性的HeLa细胞的结合情况; B:Nb-G5和PBS与G250表达阴性的ACHN细胞的结合情况 图 8 流式细胞仪检测纳米抗体Nb-G5与HeLa细胞和ACHN细胞的结合情况 |
使用流式细胞仪检测纳米抗体Nb-G5和PBS (阴性对照) 与G250表达阳性的HeLa细胞和表达阴性的ACHN细胞的结合情况。二抗和三抗分别为anti-HA鼠单抗 (1 :100稀释) 和羊抗鼠-FITC (1 :100稀释)。纳米抗体Nb-G5显示出与G250表达阳性的HeLa细胞良好的特异性结合能力。
3 讨论Hamers-Casterman等[7]在1993年发现,骆驼抗体天然缺失轻链,只含有重链,因此又称重链抗体 (heavy chain antibodies,HCAbs)。另有研究者发现,骆驼抗体中还缺少CH1,克隆重链抗体的可变区得到只由一个重链可变区组成的单域抗体,称为VHH抗体[8]。VHH晶体相对分子质量为15×103,仅为常规抗体的1/10左右,直径2.5 nm,长4 nm,因此又称为纳米抗体 (nanobody,Nb) [9],是自然存在的可与抗原结合的最小片段。其主要特点有:①在体内具有高度稳定性和与抗原结合的高亲合力;②纳米抗体的制造较单克隆抗体容易,并且制造成本低、产量大;③它的免疫原性很低,在动物实验中,纳米抗体的重复给药未检测到任何体液和细胞免疫反应。纳米抗体具有的颗粒尺寸小、比表面积大、表面能高等特点,以及表面效应、尺寸效应和宏观量子隧道效应,使得纳米抗体在诸多方面均优于传统抗体[10],对疾病的检测、诊断和治疗具有潜在的、极高的应用价值,具有广阔的应用前景[4]。
肾癌相关抗原G250于1986年被发现并对其进行了系统、深入的研究, G250抗原具有良好的肾癌特异性。免疫组化研究表明:85%以上的原发性肾癌和转移性肾癌表达G250抗原, 而占肾癌90%的肾透明细胞癌几乎全部表达此抗原, 正常的肾组织则不表达G250抗原[1]。G250属于单次跨膜蛋白,位于VHL肿瘤抑制基因的下游,由缺氧诱导因子-1途径激活[11-12]。G250本身是由酸性氨基酸组成的跨膜糖蛋白, 作为CO2水化可逆反应的催化剂, 能催化CO2水化生成H+和HCO3-, HCO3-与细胞内C1-交换, 维持细胞内碱性环境而有利于细胞的生长;细胞内H+则通过离子泵、H+-Na+交换等方式运输到细胞外, 使细胞外为酸性微环境, 可以激活细胞表面蛋白,有利于肿瘤生长和转移[13],目前普遍认为G250参与肿瘤形成和进展的过程。肾癌相关抗原G250的基因序列和cDNA序列已被克隆,其碳酸酐酶活性催化区位于胞外部分,由外显子2~8编码。
G250被视为肿瘤特异的蛋白,特别是对于肾癌的诊断、靶向治疗具有重要价值。Bleumer等[14]采用G250单克隆抗体对患者进行了免疫治疗 (Ⅱ期临床试验),发现肾癌进展期患者病情可得到缓解,进一步的研究还在进行中。我们前期的研究将G250单克隆抗体与纳米微泡相连,证实其可很好地实现对肾癌的靶向黏附,在超声辐照下可增强裸鼠移植瘤的组织显影[3]。该针对肾癌的靶向纳米微泡,G250抗原作为靶标,特异性非常好。
本研究发现单克隆抗体修饰的靶向超声微泡存在一些不够理想的地方,如单克隆抗体免疫原性强、稳定性差、单克隆抗体-微粒复合物相对分子质量大、组织穿透力弱、实际到达靶组织的浓度低等,这些都制约了超声分子成像的临床应用。因此,寻找一种特异性高、穿透力强的小型化抗体对于肿瘤的靶向诊断和治疗具有重要意义。纳米抗体体积小,特异性强,与纳米微泡相连,有助于实现靶向微泡的小型化和靶向性。
本研究制备出了能特异性结合G250抗原的纳米抗体。通过对2头新疆双峰骆驼8次的免疫,提取免疫后的骆驼外周血淋巴细胞总RNA,经mRNA分离和反转录后得到的cDNA为模板,使用巢式PCR经2次扩增得到VHH抗体DNA片段,多次电转化后构建了骆驼VHH免疫文库。由于其体内产生的抗体在抗原的刺激下经过了体细胞突变且对抗原有针对性,相较于天然纳米抗体库,骆驼VHH免疫文库能产生高亲和力和高特异性的纳米抗体[15]。在免疫纳米抗体库中通过噬菌体展示技术,我们淘选出与G250抗原结合活性高的纳米抗体。Monoclonal phage ELISA实验证实淘选出的VHH克隆显示出对G250蛋白的特异性结合能力,细胞ELISA及流式细胞实验数据显示该纳米抗体与HeLa细胞具有特异性结合活性。由于我们制备的纳米抗体针对的是G250蛋白的胞外区,保证了其在穿出血管进入组织间隙后能与表达G250抗原的细胞结合。
本研究成功制备了针对G250抗原蛋白胞外区的纳米抗体,在后续的工作中,我们准备将其与纳米微泡相连,制备靶向于G250的纳米抗体靶向的纳米微泡,用于包括肾癌在内的表达G250抗原肿瘤的早期诊断和靶向治疗。
| [1] | Oosterwijk E, Ruiter D J, Hoedemaeker P J, et al. Monoclonal antibody G 250 recognizes a determinant present in renal-cell carcinoma and absent from normal kidney[J]. Int J Cancer, 1986, 38(4): 489–494. DOI:10.1002/ijc.2910380406 |
| [2] | Grabmaier K, Vissers J, De Weijert M, et al. Molecular cloning and immunogenicity of renal cell carcinoma-associated antigen G250[J]. Int J Cancer, 2000, 85(6): 865–870. DOI:10.1002/(sici)1097-0215(20000315)85:6<865::aid-ijc21>3.0.co;2-q |
| [3] |
阳孟君, 王洛夫, 郭燕丽, 等. 携载G250单克隆抗体的纳米微泡靶向于肾细胞癌的体内外实验研究[J].
第三军医大学学报, 2016, 38(2): 112–118.
Yang M J, Wang L F, Guo Y L, et al. In vivo and in vitro study of nanoscale microbubbles with G250 monoclonal antibodies targeting to renal cell carcinoma[J]. J Third Mil Med Univ, 2016, 38(2): 112–118. DOI:10.16016/j.1000-5404.201508106 |
| [4] |
徐沐琳, 张永学. Nanobody在分子影像诊断和分子靶向治疗研究中的应用进展[J].
华中科技大学学报:医学版, 2014, 43(4): 486–488.
Xu M L, Zhang Y X. Application of Nanobody in molecular imaging diagnosis and molecular targeted therapy[J]. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2014, 43(4): 486–488. DOI:10.3870/j.issn.1672-0741.2014.04.029 |
| [5] | Conrath K E, Lauwereys M, Galleni M, et al. Beta-lactamase inhibitors derived from single-domain antibody fragments elicited in the camelidae[J]. Antimicrob Agents Chemother, 2001, 45(10): 2807–2812. DOI:10.1128/AAC.45.10.2807-2812.2001 |
| [6] | Vincke C, Gutiérrez C, Wernery U, et al. Generation of single domain antibody fragments derived from camelids and generation of manifold constructs[J]. Methods Mol Biol, 2012, 907: 145–176. DOI:10.1007/978-1-61779-974-7_8 |
| [7] | Hamers-Casterman C, Atarhouch T, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains[J]. Nature, 1993, 363(6428): 446–448. DOI:10.1038/363446a0 |
| [8] | Nguyen V K, Hamers R, Wyns L, et al. Loss of splice consensus signal is responsible for the removal of the entire C (H)1 domain of the functional camel IGG2A heavy-chain antibodies[J]. Mol Immunol, 1999, 36(8): 515–524. DOI:10.1016/S0161-5890(99)00067-X |
| [9] | Muyldermans S, Baral T N, Retamozzo V C, et al. Camelid immunoglobulins and nanobody technology[J]. Vet Immunol Immunopathol, 2009, 128(1/3): 178–183. DOI:10.1016/j.vetimm.2008.10.299 |
| [10] |
郭婷, 张宇昊, 马良. 纳米抗体的特性及其应用研究进展[J].
食品科学, 2013, 34(3): 294–297.
Guo T, Zhang Y H, Ma L. Properties and application prospects of nano-antibody in food industry[J]. Food Science, 2013, 34(3): 294–297. |
| [11] | Bos R, Zhong H, Hanrahan C F, et al. Levels of hypoxia-inducible factor-1 alpha during breast carcinogenesis[J]. J Natl Cancer Inst, 2001, 93(4): 309–314. DOI:10.1093/jnci/93.4.309 |
| [12] | Bos R, van der Groep P, Greijer A E, et al. Levels of hypoxia-inducible factor-1alpha independently predict prognosis in patients with lymph node negative breast carcinoma[J]. Cancer, 2003, 97(6): 1573–1581. DOI:10.1002/cncr.11246 |
| [13] | McKiernan J M, Buttyan R, Bander N H, et al. Expression of the tumor-associated gene MN: a potential biomarker for human renal cell carcinoma[J]. Cancer Res, 1997, 57(12): 2362–2365. |
| [14] | Bleumer I, Knuth A, Oosterwijk E, et al. A phase Ⅱ trial of chimeric monoclonal antibody G250 for advanced renal cell carcinoma patients[J]. Br J Cancer, 2004, 90(5): 985–990. DOI:10.1038/sj.bjc.6601617 |
| [15] | Tu Z, Xu Y, He Q, et al. Isolation and characterisation of deoxynivalenol affinity binders from a phage display library based on single-domain camelid heavy chain antibodies (VHHs)[J]. Food and Agricultural Immunology, 2012, 23(2): 123–131. DOI:10.1080/09540105.2011.606560 |



