因各种大型手术以及急性战创伤引起的急性小肠缺血再灌注(ischemia reperfusion,I/R)损伤已成为临床常见的诱发肠黏膜屏障(intestinal epithelial barrier, IEB)损伤、肠衰竭,甚至多器官障碍的重要原因之一[1-2]。如何进一步阐明肠I/R损伤机制,加强小肠损伤保护是当前亟待解决的问题。腺苷酸A2A受体(adenosine 2a receptor, A2AR)是一类G蛋白偶联受体,其与腺苷结合后激活诱导活化腺苷酸环化酶,促进第二信使cAMP的合成并产生相应的生物学效应[3]。前期已有研究发现,活化的A2AR可在心、肺、肝等多个脏器的I/R损伤中发挥重要的保护作用:A2AR可通过调控多个炎症介质作用、抑制炎症反应缓解组织损伤。A2AR在肠I/R过程中发挥何种作用目前仍不清楚,但近年研究提示A2AR在肠道抗炎症反应中发挥重要作用,提示A2AR在肠I/R损伤进程中的潜在保护作用[4-6]。本研究利用A2AR基因敲除小鼠及小鼠肠I/R模型进一步探讨A2AR在肠I/R中的作用机制,以期为发现肠损伤保护新靶点提供依据。
1 材料与方法 1.1 试剂与器材蛋白酶抑制剂(PMSF)、RIPA裂解液购自碧云天公司,聚偏二氟乙烯(PVDF)膜、化学发光液(ECL)购自美国Millipore公司,ZO-1一抗购自Protech公司,二抗FITC标记羊抗兔抗体、GAPDH抗体、HRP标记羊抗兔抗体、十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)购自博士德公司,电泳仪与湿转仪购自Bio-Rad公司,凝胶成像分析系统购自Kodak公司,改良的尤斯灌流系统(Ussing chambers)购自Physiologic Instruments公司。
1.2 实验动物及分组雄性C57BL/6小鼠12只,6~8周龄,体质量20~23 g,购自第三军医大学新桥医院实验动物中心。分为两组(n=6):假手术组及I/R组。12只雄性C57BL/6背景A2AR基因敲除(A2AR-/-)小鼠,6~8周龄,体质量20~23 g,由第三军医大学大坪医院野战外科研究所周元国教授赠予,分为两组(n=6):A2AR-/-+假手术组及A2AR-/-+I/R组。术前12 h自由饮水。以0.2 mL 0.1%的戊巴比妥钠腹腔注射,麻醉完全后经腹正中线切开,探查并游离肠系膜上动脉。其中I/R组及A2AR-/-+I/R组用血管夹夹闭肠系膜上动脉30 min后取出血管夹恢复血流;假手术组、A2AR-/-+假手术组只游离不夹闭动脉。待6 h后将各组小鼠处死,取小肠组织。
1.3 方法 1.3.1 小肠组织免疫荧光染色观察ZO-1的表达将小肠组织行冰冻切片,4%多聚甲醛固定,PBS溶液清洗3次,每次10 min,而后用3%过氧化氢处理10 min,PBS溶液清洗3次,每次10 min,5% BSA室温封闭2 h,加入一抗ZO-1(1:50)4 ℃孵育过夜,PBS清洗3次,每次10 min。FITC荧光标记二抗室温孵育1 h、PBS溶液清洗3次。DAPI染色10 min,PBS清洗3次,每次10 min。封片后于激光共聚焦显微镜下观察荧光变化。注意全程避光。
1.3.2 小肠组织形态学观察距小鼠回盲部10 cm以上留取小肠组织,经4%多聚甲醛固定,脱水,石蜡包埋,切片后行HE染色。光镜下观察肠黏膜组织形态学变化,根据Chiu评分法[7]评估小肠黏膜损伤程度。
1.3.3 提取小鼠小肠上皮细胞取出各组小鼠小肠放入盛满1640培养液的培养皿中,纵行剖开洗净肠腔内容物,用冷D-Hanks液洗涤,重复3次直至清洁,将肠组织置于实验前配好的消化液(5.0 mmol/L EDTA,145 μg/mL DTT的D-Hanks液)中,37 ℃环境摇床90 min,然后3 000 r/min离心15 min,沉淀即为小肠上皮细胞[8]。
1.3.4 Western blot检测ZO-1蛋白表达用混有苯甲基磺酰氟(PMSF)的RIPA提取4组样品上皮细胞蛋白质,利用蛋白质测定试剂盒测定蛋白浓度,加入SDS-PAGE上样缓冲液煮沸10 min。根据蛋白浓度进行上样。上样后80 V电泳40 min,120 V电泳至结束,230 mA恒流湿转2 h至PVDF膜。而后用5% BSA室温封闭2 h,分别加入一抗ZO-1(1:1 000)、GADPH(1:1 000)4 ℃孵育过夜,TBST溶液清洗3次,每次10 min,加入HRP标记的二抗(1:5 000) 室温孵育1 h,TBST溶液清洗3次,每次10 min,加入化学发光试剂进行显影,采用Kodak Molecular Imaging软件进行密度分析,以目的蛋白与GAPDH灰度比值作为目的蛋白的相对表达量。
1.3.5 小肠黏膜跨上皮电阻(trans-epithelium electrical resistant,TER)检测取距回盲部10 cm小肠组织长约3 cm,沿肠系膜方向纵行剖开肠道,并用生理盐水清洗,于显微镜下剥离肠黏膜,将其安装在调试好的尤斯灌流仪上,测量电阻值[9]。
1.4 统计学分析采用SPSS 17.0统计软件,数据以x±s表示,行单因素方差分析。
2 结果 2.1 小肠组织形态学改变小肠HE染色显示,假手术组及A2AR-/-+假手术组小肠黏膜完整、排列整齐、无明显水肿,绒毛无断裂脱落;与这2组相比,I/R组小肠黏膜结构出现破坏,部分绒毛出现水肿、断裂,而A2AR-/-+I/R组可见小肠黏膜结构明显紊乱、水肿,绒毛断裂脱落明显增多。A2AR-/-+I/R组小肠黏膜结构的破坏程度明显重于I/R组,提示A2AR基因敲除可加重I/R刺激对小鼠小肠的结构损伤作用(图 1)。根据小肠Chiu评分标准,A2AR-/-+假手术组、A2AR-/-+I/R组、假手术组、I/R组的评分分别为(0.50±0.54)、(3.00±0.63)、(0.33±0.51)、(2.17±0.41) 分,假手术组和A2AR-/-+假手术组差异无统计学意义(P > 0.05);与假手术组相比,I/R组与A2AR-/-+I/R组Chiu评分明显升高(P < 0.01), A2AR-/-+I/R组升高更显著。
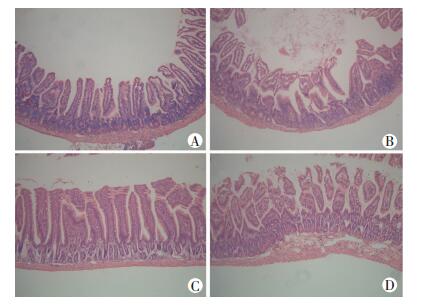
|
| A: A2AR-/-+假手术组;B:A2AR-/-+I/R组;C:假手术组;D:I/R组 图 1 各组小鼠小肠组织病理学观察 (HE ×200) |
2.2 小肠黏膜上皮通透性的改变
通过尤斯灌流仪系统检测小肠上皮通透性发现,假手术组和A2AR-/-+假手术组小肠黏膜上皮通透性差异无统计学意义(P>0.05);与假手术组相比,I/R组与A2AR-/-+I/R组的TER值分别下降了约46%和62%(图 2,P < 0.01);相比I/R组,A2AR-/-+I/R组的TER值也显著下降(P < 0.05)。这表明肠I/R刺激可诱导小肠上皮通透性的明显上升,A2AR基因敲除可加重I/R刺激对肠上皮通透性的损伤;这种损伤加重作用可能与A2AR参与肠上皮屏障调控有关。
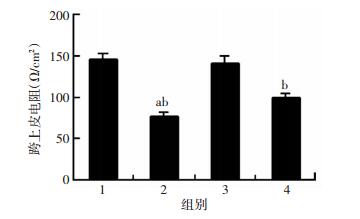
|
| 1: A2AR-/-+假手术组;2:A2AR-/-+I/R组;3:假手术组;4:I/R组 a: P<0.05,与I/R组比较;b: P<0.01, 与假手术组比较 图 2 尤斯灌流仪检测各组小鼠小肠黏膜跨上皮电阻变化(n=6, x±s) |
2.3 紧密连接蛋白ZO-1在小肠黏膜上皮中的变化
免疫荧光观察发现,紧密连接蛋白ZO-1在肠上皮表面呈线性分布表达,荧光呈绿色,细胞质、细胞核内未见表达。假手术组及A2AR-/-+假手术组中ZO-1荧光呈连续性表达,且假手术组荧光强度高于A2AR-/-+假手术组(P < 0.05),提示A2AR基因敲除可下调肠上皮ZO-1表达。与假手术组相比,A2AR-/-+I/R组与I/R组ZO-1荧光强度明显弱化,且A2AR-/-+I/R组的ZO-1荧光强度低于I/R组(P < 0.01, 图 3)。提示A2AR在肠I/R损伤中的保护作用可能与A2AR对肠上皮间紧密连接蛋白ZO-1的调控有关。
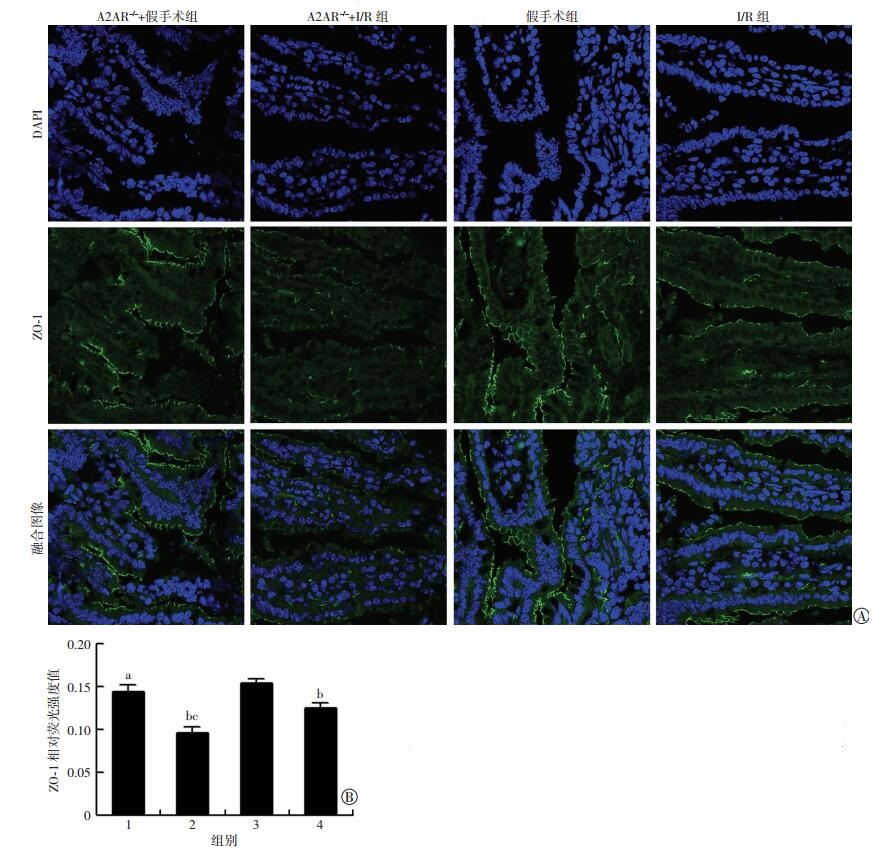
|
| A:免疫荧光检测(×400);B:半定量分析(n=6, x±s) 1:A2AR-/-+假手术组;2: A2AR-/-+I/R组;3:假手术组;4: I/R组;a: P < 0.05, b: P < 0.01, 与假手术组比较;c: P < 0.01, 与I/R组比较 图 3 免疫荧光检测各组小鼠小肠黏膜ZO-1的表达变化 |
2.4 蛋白定量分析ZO-1在小肠上皮细胞的变化
提取各组肠上皮细胞总蛋白,Western blot法检测显示,与假手术组相比,A2AR-/-+假手术组ZO-1的表达明显下调(P < 0.05),进一步印证A2AR对ZO-1的调控作用;而I/R组ZO-1表达下降了约47%,A2AR-/-+I/R组ZO-1表达则下降了60%,并且后2组比较差异有统计学意义(P < 0.05,图 4),提示A2AR基因敲除可促进肠I/R损伤与肠上皮细胞紧密连接蛋白ZO-1表达下调有关。
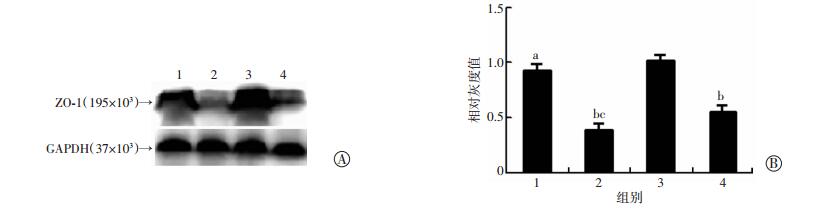
|
| 1: A2AR-/-+假手术组;2:A2AR-/-+I/R组;3:假手术组;4:I/R组 A:Western blot检测;B半定量分析(n=6,x±s) a: P < 0.05,b: P < 0.01,与假手术组比较;c: P < 0.05,与I/R组比较 图 4 Western blot检测各组小鼠小肠上皮细胞ZO-1的表达 |
3 讨论
严重创伤、烧伤及大型手术所诱发的急性小肠I/R损伤是影响临床救治的重要问题之一。特别是近年包括大血管手术、联合器官移植、心肺转流等各种特大型手术的开展日益增多,极易诱发小肠I/R损伤。这已成为影响手术预后和患者生存的重要因素。研究表明,急性小肠I/R损伤已成为临床常见的诱发肠衰竭甚至多器官障碍的重要原因之一[9-11]。如何进一步阐明小肠I/R损伤机制,加强围手术期及战创伤早期小肠损伤保护是当前亟待解决的问题。
近年研究显示,小肠I/R损伤的病理生理发生机制与I/R诱发的IEB功能破坏有着密切的关系:I/R刺激可通过诱导肠道炎症反应造成以机械性屏障为基础的IEB结构与功能损伤。这是I/R损伤诱导肠黏膜稳态失衡及肠黏膜通透性破坏的关键事件[12]。研究表明,由ZO-1蛋白、claudin蛋白、闭锁蛋白等紧密连接蛋白形成相邻肠上皮细胞之间的紧密连接结构是机械性肠屏障的结构基础[13]。机体通过紧密连接结构封闭肠上皮细胞之间的间隙,从而隔离外界损伤因素,维持肠黏膜稳态[14]。而在严重创伤及手术打击刺激下,由于机体内血流重新分布所导致的肠I/R损伤可造成肠上皮间紧密连接结构破坏,使机械性屏障功能受损,肠道菌群移位入血,引起菌血症和脓毒血症,刺激全身炎症因子的释放导致全身炎症反应综合征和多器官功能障碍,最终对患者的预后及生存产生严重不良影响[12]。本研究表明,急性小肠I/R损伤可造成小肠黏膜的结构损伤,肠黏膜通透性显著上升,同时肠上皮细胞紧密连接结构破坏,紧密连接蛋白ZO-1表达显著下降,提示急性小肠I/R损伤与肠上皮机械性屏障结构损伤之间的密切关系。因而如何进一步阐明急性小肠I/R损伤与肠上皮紧密连接蛋白调控之间的关系成为本研究的关注重点。
目前已有研究表明A2AR可在心、肺、肾等多个脏器的I/R损伤中发挥重要的保护作用[15-18]。Maddock等[19]的研究表明,在心肌缺血动物模型中,给予A2AR激动剂后心肌的损伤明显减轻;还有研究表明A2AR的活化能够减轻肾缺血再灌注的损伤[20];近期有研究发现在肺损伤动物模型中,A2AR能够明显抑制肺组织内白细胞的激活,肺部的再灌注损伤也明显缓解[21]。以上研究提示A2AR在抑制组织炎症和脏器保护中的重要作用。需要指出的是,与在心、肺、肾等脏器的保护性作用不同,A2AR在中枢神经系统中发挥着复杂作用:既有研究显示选择性激动A2AR可显著缓解因脊髓损伤诱发的炎症反应及组织损伤,也有研究利用A2AR基因敲除小鼠发现,干预A2AR表达可明显减轻缺血性脑损伤,降低脑梗死面积,改善预后[22]。提示A2AR在不同脏器缺血性损伤中的具体作用机制仍有待进一步阐明。
目前有关A2AR在小肠I/R损伤中的作用仍少见报道。本研究基于A2AR基因敲除小鼠构建肠I/R模型,探讨A2AR在肠I/R损伤中的效应及可能机制。结果表明,A2AR基因敲除可显著加重由小肠I/R刺激造成的肠黏膜结构损伤,加剧IEB屏障结构与功能破坏,提示A2AR在小鼠小肠I/R损伤进程中可能发挥着重要的保护性作用,该保护作用可能是通过调节紧密连接蛋白ZO-1表达进行。目前有关A2AR如何参与调控ZO-1的表达仍少见文献报道。但有研究提示,A2AR对ZO-1表达的调控可能与缺氧诱导因子-1α(hypoxia inducible factor -1α, HIF-1α)有关:A2AR拮抗剂能够抑制HIF-1α通路,而HIF-1α的过表达可通过激活肌球蛋白轻链激酶通路[23]下调ZO-1的表达,加重上皮细胞屏障的损伤[24]。在下一步研究中,我们将验证A2AR是否可通过HIF-1α通路介导调节ZO-1的表达,从而在I/R中发挥保护作用。
综上所述,本研究基于A2AR基因敲除小鼠模型,发现A2AR在小肠I/R损伤中的保护作用,A2AR可通过上调肠上皮细胞ZO-1的表达加强IEB屏障结构与功能。在此基础上如何深入阐明A2AR调控IEB机制,筛选肠道保护新靶点是我们下一步研究的重点。
| [1] | Ceulemans L J, Verbeke L, Decuypere J P, et al. Farnesoid X Receptor Activation Attenuates Intestinal Ischemia Reperfusion Injury in Rats[J]. PLoS ONE, 2017, 12(1): e0169331. DOI:10.1371/journal.pone.0169331 |
| [2] |
游扬, 杨歆, 常杏, 等. 腺苷酸活化蛋白激酶在重症急性胰腺炎大鼠肠黏膜屏障损伤机制中的作用[J].
第三军医大学学报, 2016, 38(9): 975–981.
You Y, Yang X, Chang X, et al. AMP-activated protein kinase deteriorates intestinal tight junction damage in rats with severe acute pancreatitis[J]. J Third Mil Med Univ, 2016, 38(9): 975–981. DOI:10.16016/j.1000-5404.201511084 |
| [3] | Welihinda A A, Kaur M, Greene K, et al. The adenosine metabolite inosine is a functional agonist of the adenosine A2A receptor with a unique signaling bias[J]. Cell Signal, 2016, 28(6): 552–560. DOI:10.1016/j.cellsig.2016.02.010 |
| [4] | Vincent I S, Okusa M D. Adenosine 2A receptors in acute kidney injury[J]. Acta Physiol(Oxf), 2015, 214(3): 303–310. DOI:10.1111/apha.12508 |
| [5] | Mohamed R A, Agha A M, Abdel-Rahman A A, et al. Role of adenosine A2A receptor in cerebral ischemia reperfusion injury: Signaling to phosphorylated extracellular signal-regulated protein kinase (pERK1/2)[J]. Neuroscience, 2016, 314: 145–159. DOI:10.1016/j.neuroscience.2015.11.059 |
| [6] | Michael S, Abdel-Aziz H, Weiser D, et al. Adenosine A2A receptor contributes to the anti-inflammatory effect of the fixed herbal combination STW 5 (Iberogast) in rat small intestinal preparations[J]. Naunyn Schmiedebergs Arch Pharmacol, 2012, 385(4): 411–421. DOI:10.1007/s00210-011-0714-y |
| [7] | Generoso S V, Viana M L, Santos R G, et al. Protection against increased intestinal permeability and bacterial translocation induced by intestinal obstruction in mice treated with viable and heat-killed Saccharomyces boulardii[J]. Eur J Nutr, 2011, 50(4): 261–269. DOI:10.1007/s00210-011-0714-y |
| [8] |
曹艳菊. 益生菌对实验性结肠炎大鼠肠黏膜TLR2、TLR4表达及NF-κB活性的影响[J].
胃肠病学和肝病学杂志, 2012, 21(8): 760–763.
Cao Y J. The effects of probiotics on expression of tlr2, tlr4 and activation of nf-κb in rats with dss-induced colitis[J]. Chinese Journal of Gastroenterology and Hepatology, 2012, 21(8): 760–763. DOI:10.3969/j.issn.1006-5709.2012.08.022 |
| [9] |
韩宾, 盛百伐, 张治草, 等. 小鼠肠急性缺血再灌注模型中芳香烃受体活化对肠黏膜屏障功能的影响[J].
第三军医大学学报, 2016, 38(10): 1090–1095.
Han B, Sheng B F, Zhang Z C, et al. Effect of aryl hydrocarbon receptor activation on intestinal mucosal barrier in mice after acute intestinal ischemia reperfusion injury[J]. J Third Mil Med Univ, 2016, 38(10): 1090–1095. DOI:10.16016/j.1000-5404.201511153 |
| [10] | Lu Y Z, Wu C C, Huang Y C, et al. Neutrophil priming by hypoxic preconditioning protects against epithelial barrier damage and enteric bacterial translocation in intestinal ischemia/reperfusion[J]. Lab Invest, 2012, 92(5): 783–796. DOI:10.1038/labinvest.2012.11 |
| [11] | Vollmar B, Menger M D. Intestinal ischemia/reperfusion: microcirculatory pathology and functional consequences[J]. Langenbecks Arch Surg, 2011, 396(1): 13–29. DOI:10.1007/s00423-010-0727-x |
| [12] | Lu Y, Wu C, Huang Y, et al. Neutrophil priming by hypoxic preconditioning protects against epithelial barrier damage and enteric bacterial translocation in intestinal ischemia/reperfusion[J]. Lab Invest, 2012, 92(5): 783–796. DOI:10.1038/labinvest.2012.11 |
| [13] | Xiao W, Wang W, Chen W, et al. GDNF is involved in the barrier-inducing effect of enteric glial cells on intestinal epithelial cells under acute ischemia reperfusion stimulation[J]. Mol Neurobiol, 2014, 50(2): 274–289. DOI:10.1007/s12035-014-8730-9 |
| [14] | Xiao W, Feng Y, Holst J J, et al. Glutamate prevents intestinal atrophy via luminal nutrient sensing in a mouse model of total parenteral nutrition[J]. FASEB J, 2014, 28(5): 2073–2087. DOI:10.1096/fj.13-238311 |
| [15] | Zhao L, Liu Y W, Yang T, et al. The mutual regulation between miR-214 and A2AR signaling plays an important role in inflammatory response[J]. Cellsig, 2015, 27(10): 2026–2034. DOI:10.1016/j.cellsig.2015.07.007 |
| [16] | Li J, Zhao L, He X, et al. Sinomenine protects against lipopolysaccharide-induced acute lung injury in mice via adenosine A(2A) receptor signaling[J]. PLoS ONE, 2013, 8(3): e59257. DOI:10.1371/journal.pone.0059257 |
| [17] | Voloshyna I, Carsons S, Littlefield M J, et al. Adenosine A(2A) receptor activation supports an atheroprotective cholesterol balance in human macrophages and endothelial cells[J]. Biochim Biophys Acta, 2013, 1831(2): 407–416. DOI:10.1016/j.bbalip.2012.11.005 |
| [18] | Mohamed R A, Agha A M, Nassar N N. SCH58261 the selective adenosine A(2A) receptor blocker modulates ischemia reperfusion injury following bilateral carotid occlusion: role of inflammatory mediators[J]. Neurochem Res, 2012, 37(3): 538–547. DOI:10.1007/s11064-011-0640-x |
| [19] | Maddock H L, Broadley K J, Bril A, et al. Role of endothelium in ischaemia-induced myocardial dysfunction of isolated working hearts: cardioprotection by activation of adenosine A(2A) receptors[J]. J Auton Pharmacol, 2001, 21(5-6): 263–271. DOI:10.1046/j.1365-2680.2001.00238.x |
| [20] | Li K, Gong X, Kuang G, et al. Sesamin protects against renal ischemia reperfusion injury by promoting CD39-adenosine-A2AR signal pathway in mice[J]. Am J Transl Res, 2016, 8(5): 2245–2254. |
| [21] | Dai S S, Wang H, Yang N, et al. Plasma glutamate-modulated interaction of A2AR and mGluR5 on BMDCs aggravates traumatic brain injury-induced acute lung injury[J]. J Exp Med, 2013, 210(4): 839–851. DOI:10.1084/jem.20122196 |
| [22] | Dai S S, Zhou Y G. Adenosine 2A receptor: a crucial neuromodulator with bidirectional effect in neuroinflammation and brain injury[J]. Rev Neurosci, 2011, 22(2): 231–239. DOI:10.1515/RNS.2011.020 |
| [23] | Jin Y, Blikslager A T. Myosin light chain kinase mediates intestinal barrier dysfunction via occludin endocytosis during anoxia/reoxygenation injury[J]. Am J Physiol, Cell Physiol, 2016, 311(6): C996–C1004. DOI:10.1152/ajpcell.00113.2016 |
| [24] | Wang P, Qi H, Sun C, et al. Overexpression of hypoxia-Inducible factor-1a exacerbates endothelial barrier dysfunction induced by hypoxia[J]. Cell Physiol Biochem, 2013, 32(4): 859–870. DOI:10.1159/000354488 |



