肝癌是最常见的恶性肿瘤之一,其死亡率在所有恶性肿瘤中居第2位[1]。肝癌起病隐匿,经各种治疗后转移、复发率高[2],明确肝癌发生、发展的机制迫在眉睫,为指导临床治疗提供有力的帮助。肿瘤干细胞理论认为在肿瘤细胞中存在一小群具有干细胞特征的肿瘤细胞,肿瘤干细胞具有自我更新、分化和耐放化疗的能力, 在肿瘤复发和转移的过程中起着关键作用。同时,Sox2[3]、Sox4[4]、Sox9[5]、Oct4[6]和c-myc[7]等基因在肿瘤干细胞干性的维持过程中起着重要作用。目前最新的研究认为交感神经在肿瘤的发生、发展中起着重要作用。先前的报道证实交感神经可以调控肿瘤的起始和发展[8],而α肾上腺素能受体在此过程中起着至关重要的作用,可以调控多种肿瘤进程[9-11]。去甲肾上腺素是一种α肾上腺素能受体激动剂,对β肾上腺素能受体几乎没有作用。α肾上腺素能受体与肿瘤细胞增殖密切相关[12],然而α肾上腺素能受体影响肝癌细胞增殖的机制还不明确。因此,本研究旨在研究去甲肾上腺素激动α肾上腺素能受体对肝癌细胞增殖能力的影响及其相关机制,为临床肝细胞癌的治疗提供有效的理论依据。
1 材料与方法 1.1 实验材料DMEM/F12培养基、胎牛血清以及胰蛋白酶,B27、bFGF和EGF细胞因子等相关试剂购于Gibco公司。HGF购于Peprotech公司。RNA提取试剂TRIzol、反转录试剂盒、实时荧光定量PCR试剂盒购于TaKaRa公司。细胞裂解液购于Thermo公司。去甲肾上腺素和哌唑嗪购于Sigma公司。CD133、Sox4、p-Akt、Akt、STAT3等抗体购于Cell Signal Tech和Abcam公司。细胞培养孵育箱、高速离心机、倒置显微镜、Western blot显影仪等实验室相关仪器分别购于Thermo、Olympus和Bio-Rad公司。
1.2 实验方法 1.2.1 细胞培养及去甲肾上腺素和哌唑嗪处理实验所用的人肝癌细胞株Huh7和PLC均来源于美国ATCC细胞库。培养基为含10%胎牛血清的DMEM。细胞培养于恒定37 ℃,5%CO2浓度的细胞培养箱。细胞每2天更换1次培养基,对数生长期传代。去甲肾上腺素和哌唑嗪处理浓度分别为10 μmol/L和5 μmol/L,哌唑嗪在去甲肾上腺素激动α受体1 h后加入。
1.2.2 蛋白质提取以及Western blot检测取1×106~5×106个细胞提取总蛋白质,BCA法检测各组中蛋白质浓度。在10%的SDS-PAGE凝胶充分电泳各组蛋白质,转膜,封闭2 h。用小鼠抗人CD133单抗 (1:1 000稀释)、兔抗人Sox4单抗 (1:1 000稀释)、p-Akt兔抗人单抗 (1 :1 000稀释)、Akt兔抗人单抗 (1 :1 000稀释)、STAT3(1:1 000稀释) 和兔抗人GAPDH (1:2 000稀释),4 ℃中孵育过夜。洗涤后用相应的辣根过氧化酶标记的山羊抗兔、山羊抗小鼠二抗 (1:5 000稀释) 室温孵育2 h,然后显影。
1.2.3 细胞总RNA提取、反转录及实时定量荧光PCR检测取1×106~5×106个细胞,用TRIzol提取细胞总RNA,并检测RNA浓度、纯度和完整性,反转录为cDNA。用SYBR Green荧光染料,实时荧光定量PCR分别检测对照组、去甲肾上腺素、去甲肾上腺素+哌唑嗪和哌唑嗪组中Sox-2、Sox-4、Sox-9、Oct-4和c-myc表达水平。10 μL反应体系:5 μL SYBR Green+ 3.4 μL无酶水+0.8 μL cDNA+0.4 μL前引物+0.4 μL后引物。PCR扩增条件:95 ℃解链30 s,60 ℃退火10 s,72 ℃延伸30 s。引物序列:CD133:上游5′-CCAAGACTCCCATAAAGCTGGA-3′, 下游5′-CTCAGG-TTGCACAGGGTGAA-3′;Sox2:上游5′-GCACAACTCGGAGATCAGCA-3′, 下游5′-TTCATGTGCGCGTAACTGTC-3′;Sox4:上游5′-GCACTAGGACGTCTGCCTTT-3′, 下游5′-ACACGGCATATTGCACAGGA-3′;Sox9:上游5′-AGGAGAACCCCAAGATGCAC-3′,下游5′-GAGGCG-TTTTGCTTCGTCAA-3′;Oct4:上游5′-CCTTCGCAAGCCCTCATTTC-3′,下游5′-CCCCCACAGAACTCATACGG-3′;c-myc:上游5′-CGTCCTCGGATTCTCTGCTC-3′,下游5′-GCTGCGTAGTTGTGCTGATG-3′。Bio-Rad CFX Manager软件对各组基因表达水平进行分析。
1.2.4 肿瘤细胞球形成实验将Huh7和PLC细胞通过流式细胞仪以20个/孔接种于低粘附96孔板,每组设置6个副孔,每孔加入100 μL成球培养基 (98 mL F12培养基,2 mL B27, 100 μL EGF (20 μg/mL), 100 μL bFGF (20 μg/mL) 和100 μL EGF (10 μg/mL),混匀,4 ℃保存不超过1个月)。实验设定去甲肾上腺素、去甲肾上腺素加哌唑嗪为实验组,设定药物浓度分别为10、5 μmol/L,用等体积PBS代替去甲肾上腺素和哌唑嗪为对照组。细胞置于37 ℃、5% CO2浓度的培养箱中培养,每3天加1次培养基和药物。第14天在倒置显微镜下观察Huh7和PLC细胞成球情况,记录其成球数量,计算肿瘤细胞成球率 (细胞球>75 μm)。
细胞成球率=(细胞成球数/细胞接种数)×100%
1.2.5 肿瘤细胞克隆形成实验将Huh7和PLC细胞通过流式细胞仪以200个/孔接种于24孔板,每组设置3个副孔,每孔加入500 μL含10%FBS的DMEM培养基,实验设定去甲肾上腺素、去甲肾上腺素加哌唑嗪为实验组,设定药物浓度分别为10、5 μmol/L,用等体积PBS代替去甲肾上腺素和哌唑嗪为对照组。细胞置于37 ℃、5%CO2浓度细胞培养箱中培养14 d,每3天换1次培养基。第14天在倒置显微镜下观察Huh-7和PLC细胞克隆形成情况 (细胞数量>50个记为1个克隆),记录其克隆数量,计算肿瘤细胞克隆形成率。
克隆形成率=(细胞成球数/接种细胞数)×100%
1.3 统计学分析采用SPSS 21.0统计软件。计量数据以x±s表示,两样本的组间比较采用t检验。P < 0.05表示差异有统计学意义。
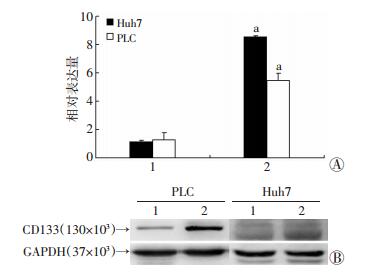
2 结果 2.1 去甲肾上腺素促进肝癌细胞表达CD133RT-PCR检测对照组和去甲肾上腺素处理组中Huh7和PLC肝癌细胞中肝癌干细胞标记物CD133的表达水平,结果发现去甲肾上腺素处理组中各个肝癌干细胞标记物水平明显高于对照组 (P < 0.05,图 1A)。Western blot实验进一步验证RT-PCR的结果,去甲肾上腺素处理组中CD133表达水平均高于对照组 (图 1B)。
|
|
1:对照组;2:去甲肾上腺素组 A:RT-PCR检测结果a: P < 0.05,与对照组比较;B:Western blot检测结果 图 1 RT-PCR和Western blot检测去甲肾上腺素对Huh7和PLC细胞CD133表达水平的影响 |
2.2 去甲肾上腺素促进肝癌细胞成球
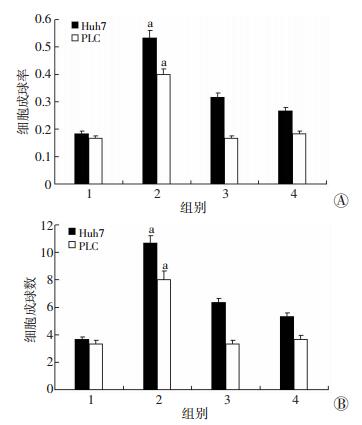
各组在低黏附条件下培养14 d,去甲肾上腺素刺激后Huh7和PLC肝癌细胞的成球能力较对照组明显提高,哌唑嗪阻滞后肝癌细胞成球能力减弱 (P < 0.05,图 2)。
|
|
1:对照组;2:去甲肾上腺素组;3:去甲肾上腺素+哌唑嗪组;4:哌唑嗪组a: P < 0.05,与对照组比较 A:肿瘤细胞球形成率;B:肿瘤细胞球形成数 图 2 肿瘤细胞球形成实验检测去甲肾上腺素对Huh7和PLC细胞球形成的影响 |
2.3 去甲肾上腺素提高肝癌细胞克隆形成能力
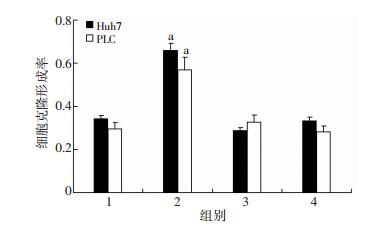
各组细胞培养14 d,去甲肾上腺素刺激后Huh7和PLC肝癌细胞的克隆能力较对照组明显提高,哌唑嗪阻滞后克隆形成能力减弱 (P < 0.05,图 3)。表明去甲肾上腺素激动肝癌细胞的α肾上腺素能受体可以增强肝癌细胞的自我更新能力,促进肝癌细胞增殖。
|
| 1:对照组;2:去甲肾上腺素组;3:去甲肾上腺素+哌唑嗪组;4:哌唑嗪组a: P < 0.05,与对照组比较 图 3 细胞克隆实验检测去甲肾上腺素对Huh7和PLC细胞克隆形成的影响 |
2.4 去甲肾上腺素通过PI3K/Akt信号通路促进肝癌细胞中Sox4的表达
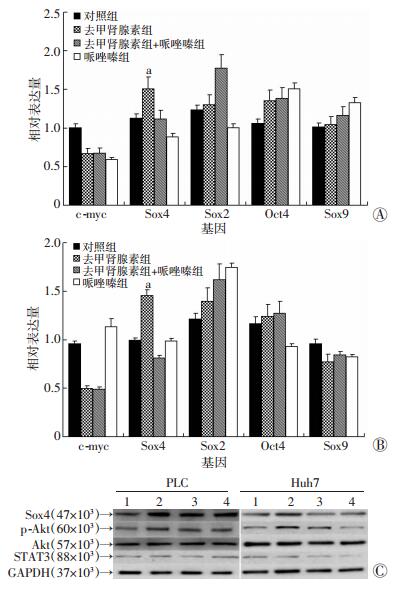
通过文献挑选出与肿瘤细胞干性相关的基因Sox2、Sox4、Sox9、Oct4和c-myc。在去甲肾上腺素和哌唑嗪浓度分别为10 μmol/L和5 μmol/L处理Huh7和PLC细胞,并在24、48 h后分别提取总RNA和总蛋白,用RT-PCR和Western blot检测Huh7和PLC肝癌细胞中干性相关基因的变化。结果显示,Sox4基因在去甲肾上腺素激动α受体后明显上调,哌唑嗪阻滞α受体后表达减少 (P < 0.05, 图 4A、B)。Western blot实验验证了PCR的结果 (图 4C)。然后通过Western blot检测p-Akt和STAT3在各组中的表达水平,发现去甲肾上腺素能促进p-Akt表达上升,对Akt表达水平没有影响,而在哌唑嗪组中p-Akt表达水平降低 (图 4C)。同时,STAT3的表达水平在各组中均没有任何的变化 (图 4C)。根据以上结果推断去甲肾上腺素可能是激动肝癌细胞中α肾上腺素能受体激活PI3K/Akt信号通路上调Sox4的表达调控肝癌细胞自我更新能力,进而促进肝癌细胞增殖。
|
|
a: P < 0.05,与对照组比较 A:Huh7细胞RT-PCR检测结果;B:PLC细胞RT-PCR检测结果;C:Western blot检测结果1:对照组;2:去甲肾上腺素组;3:去甲肾上腺素+哌唑嗪组;4:哌唑嗪组 图 4 RT-PCR和Western blot检测去甲肾上腺素影响Huh7和PLC细胞中干性基因表达以及相关的信号通路 |
3 讨论
α肾上腺素能受体与多种肿瘤的发生、发展密切相关,包括增殖、凋亡、侵袭和转移[12-14]。去甲肾上腺素通过激动肿瘤细胞上的α肾上腺素能受体影响多种肿瘤细胞功能[15]。本研究发现去甲肾上腺素激动肝癌细胞上的α肾上腺素能受体后能够促进群体肝癌细胞中CD133表达升高;进一步研究发现去甲肾上腺素能增强肝癌细胞的自我更新能力。此外,去甲肾上腺素刺激肝癌细胞后p-Akt表达水平升高,同时Sox4表达上调。我们推测去甲肾上腺素促进肝癌细胞增殖可能是通过激动肝癌细胞膜上α肾上腺素能受体,激活PI3K/Akt信号通路上调Sox4基因的表达。
自主神经系统在肿瘤发生、发展中的作用越来越受到关注,神经递质可以通过α和β肾上腺素能受体信号通路影响多种肿瘤的发生和发展[8]。近年的相关报道发现,去甲肾上腺素可能在多种在肿瘤的发生、发展起重要作用[15],但其具体的机制还不明确,在肝癌中的作用更是研究甚少。本课题组前期研究发现,去甲肾上腺素可以激活Kupffer细胞上的α1肾上腺素能受体通过炎症信号通路促进肝癌的发生[16]。本研究发现去甲肾上腺素可以促进肝癌细胞中肝癌干细胞标记物CD133的上升。CD133是一种细胞表面分子,CD133+的肝癌细胞具有干细胞特征,拥有更强的自我更新能力和成瘤能力[17]。因此,本研究结果表明去甲肾上腺素可能促进群体肝癌细胞中肿瘤干细胞增多。同时,去甲肾上腺素能够促进Huh7和PLC细胞CD133的表达,暗示去甲肾上腺素有可能提高肝癌细胞的自我更新能力。进一步研究发现Huh7和PLC肝癌细胞在经过10 μmol/L的去甲肾上腺素刺激后,肝癌细胞的成球能力和克隆形成能力较对照组明显上升,而哌唑嗪阻滞α肾上腺素能受体后肝癌细胞的成球和克隆形成能力明显下降,并且单独使用哌唑嗪处理肝癌细胞后其成球能力和克隆形成较对照组没有明显的变化。说明去甲肾上腺素能够通过激动α肾上腺素能受体调控肝癌细胞的自我更新能力,促进肝癌细胞增殖。
为了进一步探讨去甲肾上腺素促进肝癌细胞自我更新的分子机制,通过查阅文献,发现Sox2、Sox4、Sox9、Oct4和c-myc等基因在肿瘤细胞增殖以及干性的维持过程中承担重要的角色。因此,本研究检测了去甲肾上腺素对这些基因在肝癌细胞中表达水平的影响。去甲肾上腺素刺激Huh7和PLC肝癌细胞后,Sox4基因较其他干性相关基因明显升高,哌唑嗪阻滞后Sox4表达下调。而单独使用哌唑嗪处理肝癌细胞对各个基因表达水平并没有明显的影响,说明去甲肾上腺素激动肝癌细胞中α肾上腺素能受体后能够特异性的促进Sox4基因的表达。研究发现,PI3K/Akt信号通路的激活可以诱导Sox4的表达,促进前列腺癌的发生[18];STAT3信号通路的激活可以诱导Sox4的表达,促进肝癌细胞的自我更新[19]。为了进一步明确去甲肾上腺素激活α肾上腺素能受体后促进肝癌细胞中Sox4表达的机制,本研究检测了去甲肾上腺素对PI3K/Akt和STAT3的影响,发现去甲肾上腺素处理Huh7和PLC后,p-Akt相较于Akt和STAT3表达明显上升,哌唑嗪阻滞后p-Akt表达下降,而单独使用哌唑嗪处理不影响肝癌p-Akt的表达水平。我们推测去甲肾上腺素激动α肾上腺素能受体可能是通过激活PI3K/Akt信号通路促进肝癌细胞中Sox4基因的表达,从而提高肝癌细胞自我更新的能力,促进肝癌细胞增殖。
Sox4是Sox转录因子家族的成员,在胚胎发育和细胞分化中起着关键的作用, 特别是在肝脏、胰腺、中枢神经系统的发育中起着至关重要的作用[20-21]。同时Sox4在恶性肿瘤的发生发展中起着重要的作用,如乳腺癌[22]、宫颈癌[23]、皮肤癌[24]。Sox4与膀胱癌干细胞的干性以及膀胱癌的临床预后密切相关等[25]。
结合本研究的结果可以推断,去甲肾上腺素进入肝癌组织后,激动肝癌细胞膜上的α肾上腺素能受体,可能通过激活PI3K/Akt信号通路上调Sox4基因的表达,从而提高肝癌细胞自我更新的能力,促进肝癌细胞的增殖。
| [1] | Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | Ferlay J, Shin H R, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893–2917. DOI:10.1002/ijc.25516 |
| [3] | Andoniadou C L, Matsushima D, Mousavy Gharavy S N, et al. Sox2(+) stem/progenitor cells in the adult mouse pituitary support organ homeostasis and have tumor-inducing potential[J]. Cell Stem Cell, 2013, 13(4): 433–445. DOI:10.1016/j.stem.2013.07.004 |
| [4] | Ying Z, Li Y, Wu J, et al. Loss of miR-204 expression enhances glioma migration and stem cell-like phenotype[J]. Cancer Res, 2013, 73(2): 990–999. DOI:10.1158/0008-5472.CAN-12-2895 |
| [5] | Roche K C, Gracz A D, Liu X F, et al. SOX9 maintains reserve stem cells and preserves radioresistance in mouse small intestine[J]. Gastroenterology, 2015, 149(6): 1553–1563. DOI:10.1053/j.gastro.2015.07.004 |
| [6] | Chai S, Ng K Y, Tong M, et al. Octamer 4/microRNA-1246 signaling axis drives Wnt/β-catenin activation in liver cancer stem cells[J]. Hepatology, 2016, 64(6): 2062–2076. DOI:10.1002/hep.28821 |
| [7] | Zhou X, Tan M, Nyati M K, et al. Blockage of neddylation modification stimulates tumor sphere formation in vitro and stem cell differentiation and wound healing in vivo[J]. Proc Natl Acad Sci U S A, 2016, 113(21): E2935–E2944. DOI:10.1073/pnas.1522367113 |
| [8] | Ondicova K, Mravec B. Role of nervous system in cancer aetiopathogenesis[J]. Lancet Oncol, 2010, 11(6): 596–601. DOI:10.1016/S1470-2045(09)70337-7 |
| [9] | Batty M, Pugh R, Rathinam I, et al. The Role of α1-Adrenoceptor Antagonists in the Treatment of Prostate and Other Cancers[J]. Int J Mol Sci, 2016, 17(8): 1339. DOI:10.3390/ijms17081339 |
| [10] | Lamkin D M, Sung H Y, Yang G S, et al. α2-Adrenergic blockade mimics the enhancing effect of chronic stress on breast cancer progression[J]. Psychoneuroendocrinology, 2015, 51: 262–270. DOI:10.1016/j.psyneuen.2014.10.004 |
| [11] | Yeo J H, Yoon S Y, Kim S J, et al. Clonidine, an alpha-2 adrenoceptor agonist relieves mechanical allodynia in oxaliplatin-induced neuropathic mice; potentiation by spinal p38 MAPK inhibition without motor dysfunction and hypotension[J]. Int J Cancer, 2016, 138(10): 2466–2476. DOI:10.1002/ijc.29980 |
| [12] | Morelli M B, Amantini C, Nabissi M, et al. Cross-talk between alpha1D-adrenoceptors and transient receptor potential vanilloid type 1 triggers prostate cancer cell proliferation[J]. BMC Cancer, 2014, 14(1). DOI:10.1186/1471-2407-14-921 |
| [13] | Magnon C, Hall S J, Lin J, et al. Autonomic nerve development contributes to prostate cancer progression[J]. Science, 2013, 341(6142): 1236361. DOI:10.1126/science.1236361 |
| [14] | Xia M, Tong J H, Zhou Z Q, et al. Tramadol inhibits proliferation, migration and invasion via α2-adrenoceptor signaling in breast cancer cells[J]. Eur Rev Med Pharmacol Sci, 2016, 20(1): 157–165. |
| [15] | Fitzgerald P J. Is norepinephrine an etiological factor in some types of cancer[J]. Int J Cancer, 2009, 124(2): 257–263. DOI:10.1002/ijc.24063 |
| [16] | Huan H B, Wen X D, Chen X J, et al. Sympathetic nervous system promotes hepatocarcinogenesis by modulating inflammation through activation of alpha1-adrenergic receptors of Kupffer cells[J]. Brain Behav Immun, 2017, 59: 118–134. DOI:10.1016/j.bbi.2016.08.016 |
| [17] | Ma S, Chan K W, Hu L, et al. Identification and characterization of tumorigenic liver cancer stem/progenitor cells[J]. Gastroenterology, 2007, 132(7): 2542–2556. DOI:10.1053/j.gastro.2007.04.025 |
| [18] | Bilir B, Osunkoya A O, Wiles W G 4th, et al. SOX4 Is Essential for Prostate Tumorigenesis Initiated by PTEN Ablation[J]. Cancer Res, 2016, 76(5): 1112–1121. DOI:10.1158/0008-5472.CAN-15-1868 |
| [19] | Chen Z Z, Huang L, Wu Y H, et al. LncSox4 promotes the self-renewal of liver tumour-initiating cells through Stat3-mediated Sox4 expression[J]. Nat Commun, 2016, 7: 12598. DOI:10.1038/ncomms12598 |
| [20] | Yin C. Molecular mechanisms of Sox transcription factors during the development of liver, bile duct, and pancreas[J]. Semin Cell Dev Biol, 2017, 63: 68–78. DOI:10.1016/j.semcdb.2016.08.015 |
| [21] | Cheung M, Abu-Elmagd M, Clevers H, et al. Roles of Sox4 in central nervous system development[J]. Brain Res Mol Brain Res, 2000, 79(1/2): 180–191. DOI:10.1016/s0169-328x(00)00109-1 |
| [22] | Lee H, Goodarzi H, Tavazoie S F, et al. TMEM2 Is a SOX4-Regulated Gene That Mediates Metastatic Migration and Invasion in Breast Cancer[J]. Cancer Res, 2016, 76(17): 4994–5005. DOI:10.1158/0008-5472.CAN-15-2322 |
| [23] | Sun R, Jiang B, Qi H, et al. SOX4 contributes to the progression of cervical cancer and the resistance to the chemotherapeutic drug through ABCG2[J]. Cell Death Dis, 2015, 6: e1990. DOI:10.1038/cddis.2015.290 |
| [24] | Foronda M, Morgado-Palacin L, Gmez-Lpez G, et al. Profiling of Sox4-dependent transcriptome in skin links tumour suppression and adult stem cell activation[J]. Genomics Data, 2015, 6: 21–24. DOI:10.1016/j.gdata.2015.07.030 |
| [25] | Shen H, Blijlevens M, Yang N, et al. Sox4 Expression Confers Bladder Cancer Stem Cell Properties and Predicts for Poor Patient Outcome[J]. Int J Biol Sci, 2015, 11(12): 1363–1375. DOI:10.7150/ijbs.13240 |



