作为一种正在全世界蔓延的慢性复杂性疾病,非酒精性脂肪性肝病 (non-alcoholic fatty liver disease, NAFLD) 发病率在全球范围内的攀升迅速,被称为“下一场即将到来的世界性疾病大流行”[1-2]。NAFLD有发展为肝硬化甚至肝癌的风险,对人类健康造成严重威胁。2015年的最新报道称,在美国需要做肝移植的肝癌患者发病原因统计中,NAFLD所占的比例攀升最为迅猛[3]。随着经济发展和人们生活方式的改变,我国NAFLD的发生率也增长迅速,部分地区甚至高达38%[4]。因此,非酒精性脂肪肝的预防和干预方案研究十分必要。
Sirtuins是一类NAD+依赖的去乙酰化酶。SIRT3是该家族7个成员之一,主要分布在线粒体中[5-7]。已有研究表明SIRT3是目前发现的最重要的线粒体蛋白去乙酰化酶,同时也是调控肝脏细胞中脂肪酸合成和分解代谢的中心分子[5]。它能够通过LKB1-AMPK、LCAD和HMGCS2等分子及相关通路调节肝脏脂肪酸的氧化和能量产生;通过与线粒体SOD2和电子传递链复合体相互作用,并抑制ROS的产生调节氧化应激;同时,SIRT3还是细胞分化中线粒体生物学发生调节的靶标之一[8]。课题组前期研究发现SIRT3在花色苷、白藜芦醇等对糖尿病、脂肪肝和动脉粥样硬化的预防中是不可或缺的[9-10]。但SIRT3究竟是否在人群中切实参与NAFLD发生,以及作为潜在的干预靶标,SIRT3表达上调对NAFLD的影响如何还缺少证据[11]。本研究计划通过人群研究和动物水平的过表达研究,进一步探究SIRT3参与NAFLD发生的证据,为药物和干预方案的制定提供资料。
1 材料与方法 1.1 病例-对照研究群体建立NAFLD病例纳入标准:符合以下所有条件者,可以纳入试验。① 年龄在25~60岁,重庆市常住居民 (在重庆市居住5年以上者);② B超和肝功检查诊断为NAFLD或轻、中度非酒精性脂肪性肝炎 (non-alcoholic steatohepatitis, NASH);由于体检人群进行肝组织学检查的难度较大,没有对NAFLD人群详细的肝纤维化和肝硬化的判断和依据。按照中华医学会肝脏病学分会脂肪肝和酒精性肝病学组2010年《非酒精性脂肪性肝病诊疗指南》中的诊断标准,弥漫性脂肪肝结合谷丙转氨酶 (ALT) 和谷草转氨酶 (AST) 持续严重增高患者共计25例,判断为NASH[12-13]。③ BMI > 20且 < 30,近3个月内体质量稳定;④ 空腹血糖 < 7.8 mmol/L;⑤ 坐位收缩压 < 180 mmHg、舒张压 < 100 mmHg;⑥ 自愿参加;⑦ 无其他重大疾病史和家族病史;⑧ 汉族。
对照组纳入标准:B超和肝功检查鉴定未发生NAFLD;其他标准同病例纳入标准的①、③、④、⑤、⑥、⑧。排除标准:有下列情况之一者,则排除试验:① 凡是有过量饮酒或肝炎病毒感染者或非本地常住居民;② 患有胃肠道疾病、各种严重的慢性疾病或肝肾功能不全、恶性肿瘤的患者;③ 依从性差的患者。
收集2014年3月-2015年3月在第三军医大学西南医院体检中心体检的人群,最终得到NAFLD患者384例,对照组384例。本研究在第三军医大学伦理委员会 (2015年3月) 监督下实施,严格遵循赫尔辛基宣言和《涉及人的生物医学研究国际伦理准则》。
1.2 基因组DNA提取收集入选患者的外周血标本,4 ℃保存。在48 h内提取基因组DNA。提取方法按照天根生化科技公司血液基因组提取试剂盒 (DP318) 说明书进行操作。
1.3 基因分型和统计分析设计合成Mass-array平台相关Oligo,与北京翔燕凯杰科技有限公司合作完成基因分型。基因型结果导出后根据Hapmap基因型数据进行等位型的比对。利用SARS 9.4统计软件。不同基因型在病例-对照组中分布用χ2检验或Fisher精确检验 (当列联表中某一项数值 < 5时),数值型变量的组间比较采用t检验或者秩和检验 (当各组数据不满足正态性和方差齐性要求时),检验水准:α=0.05。
1.4 小鼠分组和高脂膳食模型模建8周龄雄性C57BL/6小鼠20只,体质量 (22.0±0.7) g (北京维通利华实验动物有限公司提供)。小鼠在第三军医大学实验动物中心 (SPF级) 饲养,温度 (23±1) ℃、相对空气湿度50%~60%,昼夜周期12 h循环。自由饮水、正常饲料培养条件下培养1周后打耳标,按照随机数字表法分为2组:pcDNA3.1-SIRT3体内表达组 (HFD+SIRT3组,n=10)、pcDNA3.1空质粒体内表达组 (HFD+BLANK组,n=10)。分组后,采用高脂饲料喂养6周,建立NAFLD模型。平均体质量超过35 g后,准备体内转染实验干预。饲料来自江苏美迪森生物医药有限公司,普通饲料 (MD12031,10%脂肪),高脂饲料 (MD12032,45%脂肪)。
1.5 在NAFLD小鼠模型上进行人源SIRT3的内源表达采用Engreen的体内转染试剂Entransfer-in vivo将携带pcDNA3.1-SIRT3的质粒或pcDNA3.1空质粒进行转染。每只小鼠12.5 μg的质粒对应25 μL的转染试剂,采用尾静脉注射,间隔5 d注射1次,连续注射10次[14]。
1.6 血液和肝脏指标检测采用南京建成相关试剂盒检测小鼠血清游离脂肪酸 (free fatty acid,FFA),小鼠肝脏FFA和甘油三酯以及胆固醇含量。
1.7 RNA提取和荧光定量PCR采用TaKaRa公司的RNAiso plus按照标准程序提取肝脏RNA,使用PrimeScriptTM RT reagent Kit逆转录试剂盒逆转成为cDNA,采用SYBR ® Premix Ex TaqTM Ⅱ荧光定量PCR试剂进行Real-time PCR实验。
1.8 Western blot按照标准组织蛋白提取方案提取肝脏蛋白质,采用BCA法测定蛋白浓度。采用10%的聚丙烯酰胺凝胶进行电泳,每孔上样量40 μg。电泳完成后采用半干转膜法转至PVDF膜上。5%的BSA室温封闭2 h,一抗孵育过夜;洗膜后加入对应的辣根过氧化物酶标记的二抗,室温孵育40 min,洗膜3次后加入发光液,在VILBER FUSION FX7成像系统自动曝光,利用Image J进行灰度值定量分析。
1.9 病理切片的观察参考文献[15]的方法进行油红O染色和HE染色,显微镜下观察HepG2细胞内脂滴形成和空泡化程度。
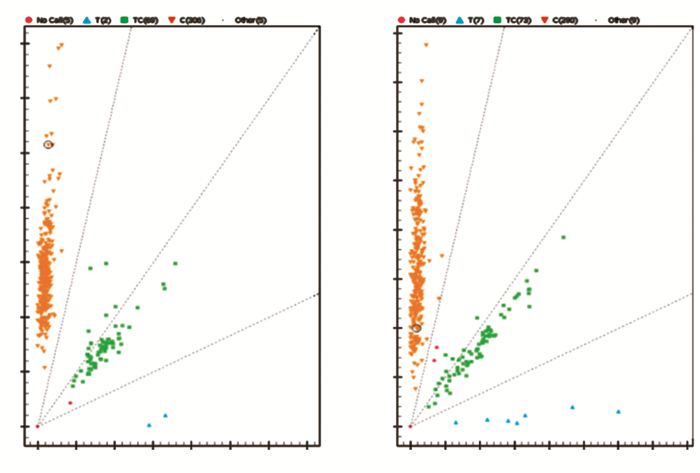
2 结果 2.1 人群SIRT3基因编码区变异rs11246020与NAFLD发生风险相关 2.1.1 SIRT3基因rs11246020位点基因分型采用Massarray的方法对374个NAFLD患者和372个正常对照SIRT3基因编码区变异rs11246020进行基因分型,共有5个标本分型失败,分型成功率99.3% (图 1)。
|
| GG:黄色;GA:绿色;AA:蓝色 图 1 用Massarray对NAFLD组 (A) 和对照组 (B) rs11246020进行基因分型的不同基因型聚类分布 |
2.1.2 rs11246020基因型在NAFLD人群及对照人群中的分布
统计位于SIRT3基因编码区的错意突变rs11246020的GG基因型分布与HAPMAP中的CHB基因分型数据整体分布相符,GG/GA+AA基因型在人群中存在在NAFLD中出现的频率比大致接近 (80%:20%)。但在本次研究的NAFLD人群中,GG基因型所占比例为83.7%,略高于平均水平。由于对照组中A等位基因型的比例11.7%显著高于NAFLD组的8.3%,说明A等位基因对NAFLD有保护效应,相反,G等位型提高了NAFLD的发病风险到约1.5倍 (95%置信区间为1.04~2.06,表 1)。
| 组别 | GG (%) | GA (%) | AA (%) | GA+AA (%) | Pa | G (%) | A (%) | Pb | OR |
| NAFLD组 | 313 (83.7) | 60 (16.0) | 1 (0.3) | 61 (16.3) | 0.0352 | 686 (91.7) | 62 (8.3) | 0.0283 | 1.5 |
| 对照组 | 292 (78.5) | 73 (19.6) | 7 (1.9) | 80 (21.5) | 657 (88.3) | 87 (11.7) | |||
| a:3种基因型在两个人群中分布的Fisher精确检验;b:G/A等位型在NAFLD和对照人群中的χ2检验 | |||||||||
2.2 SIRT3体内表达显著改善肝脏肝细胞脂肪变性 2.2.1 人源SIRT3在模型小鼠肝脏成功表达
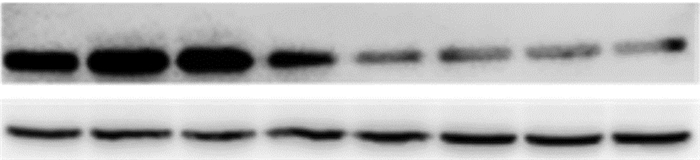
HFD+SIRT3组的肝脏SIRT3表达量显著增加,是HFD+BLANK组的4.5倍左右。显示该体内转染方法成功在肝脏中表达了构建在pcDNA3.1质粒上的人源SIRT3基因 (图 2)。
|
| 图 2 Western blot检测体内表达SIRT3和空质粒的两组NAFLD模型小鼠肝脏中SIRT3的蛋白表达 |
2.2.2 SIRT3体内表达显著改善NAFLD模型小鼠的肝脏脂肪蓄积
高脂喂养8周的C57小鼠成功形成脂肪肝模型,平均体质量超过36 g。经过间断性尾静脉注射包含体内转染试剂和SIRT3质粒混合物后,HFD+SIRT3组的小鼠体质量下降。经解剖发现,该组小鼠肝脏外观呈现红褐色,无肥大现象,质地柔软富有一定弹性。油红O染色未发现大量的脂滴蓄积的现象 (图 3A)。而作为对照的HFD+BLANK组,由于转入的是空质粒,肝脏SIRT3表达水平被高脂膳食抑制,肝脏脂肪积累明显 (图 3B),有较大脂滴聚集;同时大量肝脏细胞出现严重空泡化 (图 3B、D)。HE染色可见肝细胞排列整齐,大小均匀,未出现明显空泡化 (图 3C)。

|
| A、C:HFD+SIRT3组;B、D:HFD+BLANK组;A、B:油红O染色;C、D:HE染色 图 3 人源SIRT3体内表达有效抑制小鼠肝脏脂肪蓄积和空泡化 (×100) |
2.2.3 SIRT3肝脏过表达对小鼠肝脏相关生化指标的影响
相对表达空质粒载体的HFD+BLANK组,HFD+SIRT3组肝脏过表达人源的SIRT3后有效地降低了肝脏甘油三酯、总胆固醇,以及肝脏和血清FFA的水平, 上述指标两组降低程度差异具有统计学意义 (P < 0.05,表 2)。
| 组别 | 肝脏甘油三酯 (mg/g) | 肝脏总胆固醇 (mg/g) | 肝脏游离脂肪酸 (μmol/g) | 血清游离脂肪酸 (μmol/L) |
| HFD+SIRT3组 | 20.90±7.21a | 33.28±11.46a | 1 652±593.66a | 975.90±82.21a |
| HFD+BLANK组 | 116.94±15.81 | 109.6±47.71 | 5 089±822.16 | 1 076.53±36.82 |
| a:P < 0.05,与HFD+BLANK组比较 | ||||
2.2.4 SIRT3肝脏过表达对小鼠体质量的影响
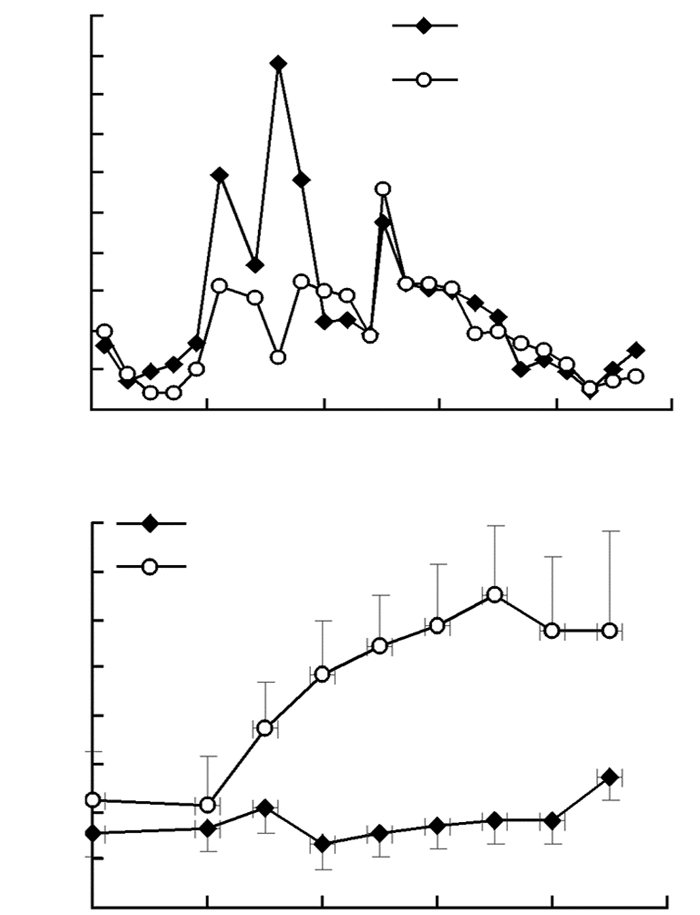
HFD+SIRT3组和HFD+BLANK组的小鼠体质量在体内表达开始的前15 d时差异没有统计学意义。从20 d开始,HFD+SIRT3组的体质量开始出现轻微下降,并基本保持平稳。而HFD+BLANK组的体质量持续保持上升状态,大约在35 d左右达到顶峰 (平均体质量接近45 g)。两组体质量变化曲线差异具有统计学意义 (P < 0.05,图 4)。
|
| 图 4 小鼠进食量统计 (A) 和SIRT3体内表达对小鼠体质量变化 (B) 的影响 |
2.3 SIRT3肝脏过表达对脂肪酸氧化相关基因转录水平的影响
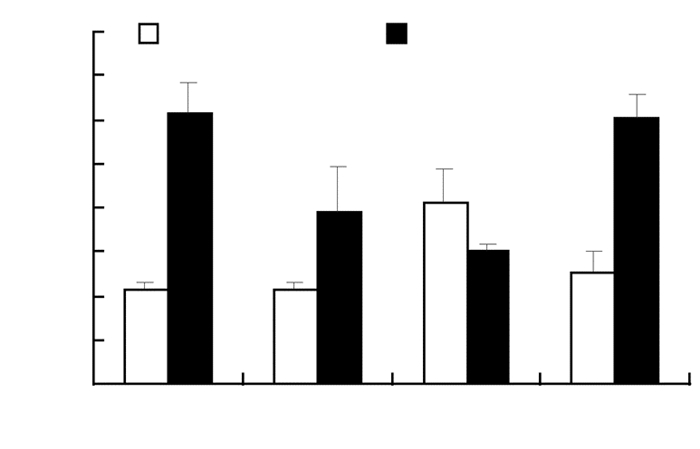
与HFD+BLANK组相比,HFD+SIRT3组小鼠肝脏中参与脂肪酸氧化的相关基因Pparα及其靶基因cpt1a和Acox1基因的表达降低,其中两组间Acox1和Pparα的转录水平差异具有统计学意义 (P < 0.05,图 5)。
|
| a:P < 0.05,与HFD+BLANK组比较 图 5 人源SIRT3体内表达对肝脏脂肪酸氧化相关基因转录的影响 |
3 讨论
SIRT3作为目前研究最多的线粒体去乙酰化酶,由于其与氧化应激的密切关系,很多食物中天然植物化合物对人体健康的效应研究都将SIRT3作为重要的靶标和作用通路中的关键分子。大量的研究证据已经证实,无论是在细胞还是动物水平上,SIRT3敲低或敲除都会造成细胞或动物的能量代谢紊乱,对诱导发生代谢综合征相关表型的外界干预条件更加敏感,但对抑制代谢综合征相关表型发生的干预因素敏感性降低。上述证据显示,SIRT3在细胞和动物代谢调节、氧化应激等重要生理过程中发挥着不可或缺的作用[16-17]。但SIRT3的正向调节功能的研究还存在很多证据缺失。比如,SIRT3功能变异是否与NAFLD相关?肝脏的SIRT3表达量上升对机体整体胰岛素抵抗、能量和代谢平衡调节以及氧化应激的影响有何异同?SIRT3表达水平上升达到什么样的程度是合理的或者说效能最佳的?因此,本研究设计通过小鼠脂肪肝模型肝脏过表达SIRT3来为回答上述问题寻找证据。
肝脏细胞脂肪代谢平衡的4个路径 (脂肪酸摄取、脂肪酸合成、脂肪酸氧化和低密度脂蛋白分泌) 中的任何异常都可能打破肝脏脂肪代谢平衡并进而导致NAFLD的发生。NAFLD发者有发生NASH以及肝硬化和肝癌的风险,而上述疾病严重形式的发生被认为与肝细胞脂毒性、氧化应激的增加、线粒体功能紊乱以及炎症因子的水平变化紧密相关。SIRT3能够通过LKB1-AMPK,LCAD和HMGCS2等分子及相关通路调节肝脏脂肪酸的氧化和能量产生;通过与线粒体SOD2和电子传递链复合体相互作用,并抑制ROS的产生调节氧化应激;同时,SIRT3还是细胞分化中线粒体生物学发生调节的靶标之一[18]。基于此,SIRT3很有可能在NAFLD发生中扮演角色,并且是药物和其他干预措施的潜在靶标。2011年,Hirschey等[19]研究发现,SIRT3的基因变异很可能与代谢综合征的发生风险升高有关,但是否与非酒精性脂肪肝的发生风险相关尚不清楚。
为了进一步寻找SIRT3参与NAFLD发生的人群证据,本研究团队与西南医院健康管理中心合作,建立了NAFLD的病例-对照研究队列。经过对SIRT3编码区潜在功能突变rs11246020的基因分型和统计分析发现,编码区变异rs11246020的A等位型对NAFLD发生具有保护作用。我们发现rs11246020G/A的变异位于SIRT3编码基因的外显子区域,G/A的变异会造成编码一个208V/I变化。有研究表明在原核生物中表达了SIRT3-208r/和SIRT3-2081,发现两者酶活性存在显著差异,SIRT3-208I的酶活性较低[19],但是体内功能研究差异没有报道。为了进一步证实SIRT3的体内作用,本研究采用体内转染的方法在NAFLD模型小鼠的肝脏过表达人源SIRT3-A等位型的基因,研究SIRT3保护性等位型上调对脂肪肝相关指标的调节作用。首先,在干预15 d后,与对照组小鼠相比,SIRT3过表达组小鼠的体质量上升趋势被有效控制。干预50d结束后经过解剖取样,Western blot验证了SIRT3成功在小鼠体内表达。油红O染色观察到干预组小鼠肝脏脂质蓄积显著降低,定量检测发现过表达组的肝脏甘油三酯含量也明显降低。另外,肝脏总胆固醇、FFA以及血清FFA水平的对比上,干预组也明显低于对照组。经过荧光定量PCR检测,结果显示肝脏脂肪酸代谢相关基因Pparα及其靶基因Acox1的转录水平被有效控制。
综上所述,本研究通过人群确证了SIRT3基因参与NAFLD的发生,并通过体内过表达实验探索了SIRT3对NAFLD相关表型影响的生化和分子水平变化,为靶向SIRT3的干预方案制定提供了确切证据。本研究还存在不足和局限性,比如没有对SIRT3-208A和SIRT3-208G两种等位基因型分别进行体内过表达,以观察其对脂肪肝的改善作用强弱以及相关细胞分子水平的变化差异;动物体内SIRT3水平本底表达对实验结果有一定的干扰。下一步准备使用基因SIRT3敲除小鼠分别表达SIRT3-A和208G,期望在细胞和分子水平获得更多的证据。
| [1] | Ray K. NAFLD-the next global epidemic[J]. Nat Rev Gastroenterol Hepatol, 2013, 10(11): 621. DOI:10.1038/nrgastro.2013.197. |
| [2] | Marí M, Morales A, Colell A, et al.Oxidative stress in nonalcoholic fatty liver disease[M]//Studies on Hepatic Disorders.2015:279-308.DOI:10.1007/978-3-319-15539-5_12. |
| [3] | Rinella M E, Sanyal A J. NAFLD in 2014:Genetics, diagnostics and therapeutic advances in NAFLD[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(2): 65–66. DOI:10.1038/nrgastro.2014.232 |
| [4] | Cai W, Song J M, Zhang B, et al. The prevalence of nonalcoholic fatty liver disease and relationship with serum uric acid level in Uyghur population[J]. Scientific World Journal, 2014, 2014: 393628. DOI:10.1155/2014/393628 |
| [5] | Hirschey M D, Shimazu T, Goetzman E, et al. SIRT3 regulates mitochondrial fatty-acid oxidation by reversible enzyme deacetylation[J]. Nature, 2010, 464(7285): 121–125. DOI:10.1038/nature08778 |
| [6] | Lu Z, Chen Y, Aponte A M, et al. Prolonged fasting identifies heat shock protein 10 as a Sirtuin 3 substrate:elucidating a new mechanism linking mitochondrial protein acetylation to fatty acid oxidation enzyme folding and function[J]. J Biol Chem, 2015, 290(4): 2466–2476. DOI:10.1074/jbc.M114.606228 |
| [7] | Dittenhafer-Reed K E, Richards A L, Fan J, et al. SIRT3 mediates multi-tissue coupling for metabolic fuel switching[J]. Cell Metab, 2015, 21(4): 637–646. DOI:10.1016/j.cmet.2015.03.007 |
| [8] | Giralt A, Villarroya F. SIRT3, a pivotal actor in mitochondrial functions:metabolism, cell death and aging[J]. Biochem J, 2012, 444(1): 1–10. DOI:10.1042/BJ20120030 |
| [9] | Chen M L, Yi L, Jin X, et al. Resveratrol attenuates vascular endothelial inflammation by inducing autophagy through the cAMP signaling pathway[J]. Autophagy, 2013, 9(12): 2033–2045. DOI:10.4161/auto.26336 |
| [10] | Zhou X, Chen M, Zeng X, et al. Resveratrol regulates mitochondrial reactive oxygen species homeostasis through Sirt3 signaling pathway in human vascular endothelial cells[J]. Cell Death Dis, 2014, 5: e1576. DOI:10.1038/cddis.2014.530 |
| [11] | Cho E H. SIRT3 as a Regulator of Non-alcoholic Fatty Liver Disease[J]. J Lifestyle Med, 2014, 4(2): 80–85. DOI:10.15280/jlm.2014.4.2.80. |
| [12] | Adams L A, Feldstein A E. Non-invasive diagnosis of nonalcoholic fatty liver and nonalcoholic steatohepatitis[J]. J Dig Dis, 2011, 12(1): 10–16. DOI:10.1111/j.1751-2980.2010.00471.x. |
| [13] |
范建高. 中国非酒精性脂肪性肝病诊疗指南 (2010年修订版)[J].
中国医学前沿杂志 (电子版), 2012, 4(7): 4–10.
Fan J G. Guidelines for management of nonalcoholic fatty liver disease:an updated and revised edition in 2010[J]. Chinese Journal of the Frontiers of Medical Science (Electronic Version), 2012, 4(7): 4–10. |
| [14] | Xirong L, Rui L, Xiaoli Y, et al. Hepatitis B virus can be inhibited by DNA methyltransferase 3a via specific zinc-finger-induced methylation of the X promoter[J]. Biochemistry Mosc, 2014, 79(2): 111–123. DOI:10.1134/S0006297914020047 |
| [15] | Zhang Y, Chen M L, Zhou Y, et al. Resveratrol improves hepatic steatosis by inducing autophagy through the cAMP signaling pathway[J]. Mol Nutr Food Res, 2015, 59(8): 1443–1457. DOI:10.1002/mnfr.201500016 |
| [16] | Sinha R A, Farah B L, Singh B K, et al. Caffeine stimulates hepatic lipid metabolism by the autophagy-lysosomal pathway in mice[J]. Hepatology, 2014, 59(4): 1366–1380. DOI:10.1002/hep.26667 |
| [17] | Molloy J W, Calcagno C J, Williams C D, et al. Association of coffee and caffeine consumption with fatty liver disease, nonalcoholic steatohepatitis, and degree of hepatic fibrosis[J]. Hepatology, 2012, 55(2): 429–436. DOI:10.1002/hep.24731 |
| [18] | Hebert A S, Dittenhafer-Reed K E, Yu W, et al. Calorie restriction and SIRT3 trigger global reprogramming of the mitochondrial protein acetylome[J]. Mol Cell, 2013, 49(1): 186–199. DOI:10.1016/j.molcel.2012.10.024 |
| [19] | Hirschey M D, Shimazu T, Jing E, et al. SIRT3 deficiency and mitochondrial protein hyperacetylation accelerate the development of the metabolic syndrome[J]. Mol Cell, 2011, 44(2): 177–190. DOI:10.1016/j.molcel.2011.07.019 |



