2. 400038 重庆,第三军医大学基础医学部微生物学教研室,重庆市微生物工程实验室
2. Department of Microbiology, Chongqing Laboratory of Microbiological Engineering, College of Basic Medical Sciences, Third Military Medical University, Chongqing, 400038, China
传统结核分枝杆菌的抗酸染色要使用酒精灯加温石炭酸复红染液[1-2],会产生挥发性苯酚气体,污染实验室环境,对人体健康有害。为了克服抗酸染色期间释放出的挥发性苯酚对人体的危害,提高检出率和缩短检测时间,先后出现了许多改良抗酸染色法[3-11]。有人试图将石炭酸复红的浓度从3%~5%降低到0.3%,甚至早期已应用到实际中,但这种改良方法后来受到人们的质疑,认为这将会显著降低对抗酸杆菌的可检出率[4, 7]。印度学者VASANTHAKUMARI等没有对染液做任何改进,直接取消对石炭酸复红染液的加热步骤,把这种方法称为“冷染法”[8],但这种方法的检出敏感性同样受到人们的极大质疑。我国学者CHEN等[5]将脑脊液中的细胞通过离心固化到玻片上,再用Triton X-100在玻片上原位处理细胞,从而提高了对结核分枝杆菌的检出率。我国学者ZHAO等[9]则建立了将石炭酸复红染液与双氧水同时滴加到痰标本涂片上进行初染的改良抗酸染色法。此法对结核分枝杆菌的检出率高于传统法,且明显缩短了染色时间。另有几位中国检验工作者也对抗酸染色的冷染法与热染法的检出效果进行了比较研究,认为冷染法可以获得热染法的同等效果。这些改良方法中多使用丙酮作为助染剂[10-12]。丙酮为脂溶剂,可改变分枝杆菌细胞壁的通透性,促进染料进入菌体。然而,迄今大多数实验室仍然沿用传统萋-尼抗酸染色法(ziehl-neelsen acid-fast staining)。对于实验室内苯系物和总挥发性有机物(total votatile organic compound,TVOC)的污染程度到底达到何种程度,是否超过国家健康标准容许限度尚少见报道。传统抗酸染色产生的挥发性苯酚对人体健康的影响并没有引起人们足够的重视。
在抗酸染色教学过程中面临的另一个重要问题是:结核分枝杆菌是一种呼吸道高传染性的病原菌,一般要求要在P3级实验室条件下才能操作结核分枝杆菌的分离与培养[13],一般学生实验室不具备分离、培养结核分枝杆菌的资质。为避免学生实验室结核分枝杆菌感染的发生,我们使用卡介苗作为学生抗酸染色的标本。但卡介苗菌体含有大量脂质,在水溶液中的分散性很差,制作出来的标本片经染色后在镜下观察,卡介苗菌体容易成堆出现。基于上述,本研究的目的在于弄清学生实验室抗酸染色期间TVOC的污染程度,探讨避免学生实验室内TVOC严重污染的控制方法,同时希望解决抗酸染色中使用卡介苗做标本时,菌体疏水性强、分散性差、容易成堆出现、不能很好模仿临床标本染色片镜下所见的问题。
1 材料与方法 1.1 菌种卡介苗由武汉生物制品研究所生产,重庆市沙坪坝卫生防疫站配发,每支含量0.25 mg, 含卡介苗菌体数量为0.25×106 CFU。大肠埃希菌及白色葡萄球菌为本室保存菌种,作为对照细菌使用。
1.2 染色液配制 1.2.1 3%石炭酸复红初染液称取碱性复红3 g,溶于10 mL 95%乙醇中,然后加入5%石炭酸水溶液,定容至100 mL。此染液专供传统抗酸染色法使用。
1.2.2 1% Triton X-100石炭酸复红染液取1.2.1项3%石炭酸复红初染液50 mL, 加入Triton X-100至终浓度为1%。此染液专供改良染色法之用。
1.2.3 3%盐酸乙醇脱色液取浓盐酸3 mL, 缓慢加入97 mL 95%乙醇中。此脱色液供传统法和改良法共用。
1.2.4 碱性美蓝复染液取美蓝0.3 g,溶于50 mL 95%乙醇中,用蒸馏水定容至100 mL。使用时用蒸馏水做10倍稀释。此脱色液供传统法和改良法共用。
1.3 染色方法 1.3.1 制备标本片① 卡介苗涂片。取0.75 mg卡介苗溶于50 μL水溶液中,此时细菌浓度为1.5×107 CFU/mL。用生理盐水做1 :5倍连续稀释,获得5个稀释度,菌体浓度分别为1.5×107、3.0×106、6.0×105、1.2×105、2.4×104 CFU/mL。该卡介苗系列稀释液专供传统抗酸染色用。在改良法染色法中,同样如上做卡介苗的5个稀释度,但所用稀释液为1% Triton X-100生理盐水。制备标本片时,分别取上述两种不同稀释系列的卡介苗溶液1 μL,分别涂于玻片上1 cm大小范围内,待干,火焰固定备用。② 大肠埃希菌及白色葡萄球菌涂片。取大肠埃希菌或白色葡萄球菌隔夜培养液各1 μL,分别涂于玻片上1 cm大小范围内,待干,火焰固定备用。这两种涂片作为对照使用。③ 混合涂片。取不同稀释度的卡介苗悬液10 μL分别与葡萄球菌培养液10 μL,置于同一试管内混匀。涂片时,各取1 μL涂抹在玻片上1 cm大小范围内,待干,火焰固定备用。
1.3.2 染色(1) 萋-尼抗酸染色法[3-4],本研究中称为热染法。用萋-尼抗酸染色法分别染上述制备的卡介苗涂片、大肠埃希菌涂片、白色葡萄球菌涂片以及混合涂片,具体方法如下:① 初染。滴加石炭酸复红初染液,覆盖涂片部位,置于酒精灯上微微间断加热(至有蒸汽冒出)3 min,自来水冲洗干净。② 脱色。滴加3%盐酸乙醇脱色液,覆盖涂标本处,摇匀,5 s左右,至肉眼可见红色本底基本脱掉,流水冲洗,洗去脱色液。③ 复染。滴加碱性美蓝染液,复染60 s。流水冲洗, 待干,油镜下镜检。(2) 冷染新方法,本研究中称为冷染法。冷染法在初染时使用的是含1% Triton X-100的石炭酸染复红染液,后面的脱色与复染步骤与传统萋-尼抗酸染色法相同。
1.4 TVOC的检测实验分别在两个实验室进行,每个实验室能容纳20名学生同时进行操作。让空调工作30 min后再开始实验操作。20名学生先在一个实验室内操作热染法抗酸染色,染色期间,由专业人员采用美国RAE公司生产的便携式传感检测仪检测实验室内空气中的TVOC。分为0、2、4、6、8、10、12 min 7个检测时间点,其中0点为实验开始染色前的检测值,作为实验室的TVOC本底。热染法完成后,同样的20名学生转移到另一个实验室内进行冷染法抗酸染色操作。染色期间,TVOC的测定方法和时间点同热染法。RAE公司的便携式检测仪检测的是“苯系物和总挥发性有机物”,但在本实验条件下,检测到的主要是挥发性苯酚、盐酸和酒精的挥发性气体。该检测由我校环境卫生教研室派专业人员操作。
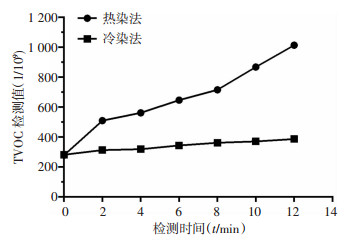
2 结果 2.1 实验室内TVOC检测结果本研究首先使用美国RAE公司生产的便携式TVOC检测仪实际测定学生实验室在两种染色法操作期间产生的TVOC。检测结果如图 1,热染法期间TVOC量迅速上升,到12 min时间点时,达到1 014 ppb(约1 mg/m3),已超过国家规定的室内TVOC容许量(500 ppb,即0.5 mg/m3)[14]。而冷染法染色期间,实验室内TVOC变化不大,曲线微微上升,到12 min时间点时,TVOC量仅为387 ppb, 始终处于国家规定的卫生容许标准之内。
|
| 图 1 不同染色方法期间的TVOC动态曲线变化 |
2.2 冷染新法的抗酸染色性验证
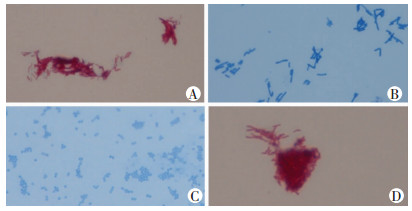
使用我们建立的冷染新方法对卡介苗进行染色,以观察该方法是否具有抗酸染色特性,并分别以革兰阴性的大肠埃希菌以及革兰阳性的白色葡萄球菌作为对照,染色结果见图 2。改良冷染法可将卡介苗染色成红色(图 2A), 但不具有抗酸染色性的大肠埃希菌(图 2B)以及白色葡萄球菌(图 2C)分别被染成蓝色;传统抗酸染色法染色的卡介苗被染成红色(图 2D)。说明新建立的冷染法具有抗酸染色特性,可将抗酸杆菌与革兰阳性菌或阴性菌区分开。
|
| A~C:分别为改良冷染色新方法染色的卡介苗菌体、大肠埃希菌、葡萄球菌; D:传统抗酸染色法染色的卡介苗菌体 图 2 改良冷染新方法染色效果验证(×1 000) |
2.3 新建抗酸冷染法对抗酸杆菌具有更好的分散性
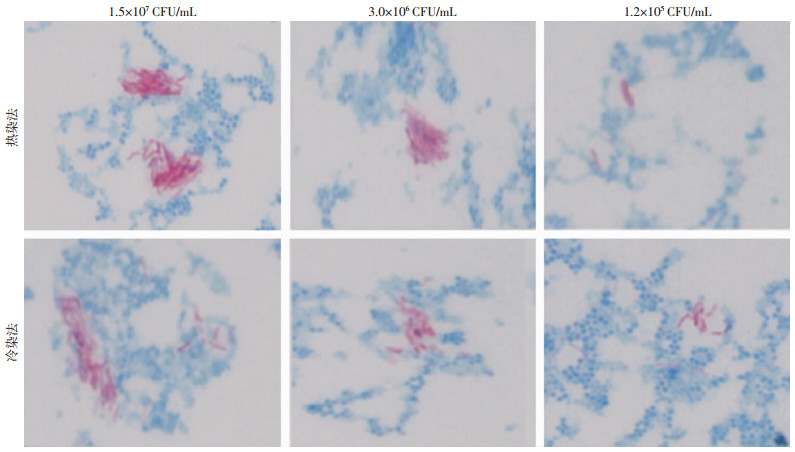
在新建方法的卡介苗稀释液以及初染液中分别加入1% Triton X-100,试图解决抗酸杆菌在水溶液中分散性差的问题。并以稀释液及初染液均不含Triton X-100的传统染色法作为对照。从图 3中可以看出一种趋势,即在没有使用Triton X-100的传统热染法中,卡介苗菌体更容易成堆出现。相反,在使用Triton X-100的冷染法中,菌体更容易呈分散分布。
|
| 图 3 传统抗酸热染法和改良冷染法染色的卡介苗和葡萄球菌混合后菌体分布镜下观察(×1 000) |
2.4 两种染色法可检测性比较
在油镜下观察两种染色法的可检测性。我们检测了不同稀释度的标本制作的染色片,随机检测10个视野,至少能在1个视野中发现有抗酸杆菌,则该稀释度被定义为“可检测的终点”;如果在随机检测的10个视野中都没有发现抗酸杆菌,则被定义为“不可检测”。两种检测方法的可检测性如表 1:在含菌量为6×105 CFU/mL时,热染法检测的10个视野都没有发现抗酸染色菌体,而新建改良冷染法检测的10个视野中至少有1个视野可检测到抗酸杆菌。可见改良冷染法较传统热染法的可检测度更敏感。
| 抗酸染色法 | 1.5×107 CFU/mL |
3.0×106 CFU/mL |
6.0×105 CFU/mL |
1.2×105 CFU/mL |
2.4×104 CFU/mL |
| 热染法 | + | + | - | - | - |
| 冷染法 | + | + | + | - | - |
3 讨论
标本涂片抗酸染色后直接镜检是临床辅助结核病诊断的常用方法。但由于结核分枝杆菌细胞壁结构具有特殊性,表现在脂质含量很高,且结构致密,使得分枝杆菌细胞壁对于染料的通透性很低。一般染色方法难以使分枝杆菌染上颜色。传统抗酸染色法为萋-尼抗酸染色法,沿用已久。该方法采用石炭酸复红初染,在初染过程中采用加温助染,故也可被称为“热染法”。直至目前,传统抗酸染色热染法仍然是临床广泛使用的方法[6, 8]。但该法面临一个问题, 即石炭酸复红染液中的石炭酸(苯酚)是易挥发性物质,加温助染更加促进了苯酚向环境中的释放。实验者在操作过程中都可以明显感觉到挥发性石炭酸对人体眼睛和鼻腔的刺激。而且,苯系物是众所周知基因诱变剂,潜在致癌风险。在微生物学抗酸染色教学中,往往有多达二三十名学生于同一实验室内同时操作抗酸染色。在此种情况下,TVOC的污染可能会异常严重,但到底达到何种程度,尚少见报道。
为了弄清楚微生物学抗酸染色时,学生实验室的TVOC污染情况,我们采用便携式检测仪对TVOC进行了定量测定。从图 1结果可以清楚地看到,传统热染法期间,TVOC量迅速上升,在一次性传统抗酸染色操作的终点12 min时,达到1 014 ppb(相当于1 mg/m3)之多。这明显超过了国家标准(GB50325-2010,2013版)规定的民用建筑内TVOC量应当在500 ppb (0.5 mg/m3)以内的标准。从图 1动态曲线可见,染色期间TVOC的量是持续累积上升的。在学生实验课中,许多学生往往反复练习染色,以求掌握。这时实验操作时间常常超过1 h。TVOC的累积量将会远远高于12 min检测点的量。TVOC是“苯系物和总挥发性有机物”的总称,理论上包括了苯系物、有机氯化物、氟利昂系列、有机酮、胺、醇、醚、酯、酸和石油泾化合物等物质。但在本研究中的抗酸染色实验条件下,所检测到的TVOC物质主要是苯酚、盐酸和酒精的挥发性物质。其中挥发性苯酚是最主要的对人体健康造成危害的物质。
本研究建立改良抗酸染色法的出发点基于两个目的:一是为了取消传统抗酸染色中对石炭酸复红染液的加热步骤,避免加热过程导致大量挥发性苯酚类物质产生,减少挥发性苯酚对人体健康的影响;二是为了克服卡介苗菌体因含脂量高在水溶液中疏水性强、分散性差的缺陷,更利于卡介苗作为学生抗酸染色标本使用。基于此,我们在初染液及标本稀释液中加入1% Triton X-100。Triton X-100是一种表面活性剂(亦称分散剂),能改变细菌细胞壁通透性,促进染料进入分枝杆菌菌体,因此它在初染过程中起助染作用。同时,Triton X-100作为一种分散剂,可促进卡介苗在水溶液中的分散性,避免在镜下观察到分枝杆菌成堆出现的缺点。从图 2可以看到,使用本研究建立的改良抗酸染色法,在可使卡介苗菌体被染成红色的前提下,革兰阴性的大肠埃希菌及革兰染色阳性葡萄球菌被染成了碱性美蓝的浅蓝色,表明本研究建立的方法具有抗酸染色特性。从图 3可以看出,热染法中卡介苗菌体有成堆出现的趋势,而在改良冷染法中菌体分散分布较好。
我们对传统抗酸染色法与本研究建立的改良冷染法的可检测性进行了评估。本研究定义的“可检测的终点”为随机10个视野中至少有1个视野能检测到抗酸杆菌时的菌液稀释度。表 1显示热染法的可检测性为含3.0×106 CFU/mL菌体的菌液,而冷染法在6.0×105 CFU/mL菌体浓度时仍可检测到菌体,表明改良冷染法可检测性更敏感。这可能是因为热染法中,菌体容易成堆成团出现,影响了菌体在其他部位出现的概率。在改良冷染法中,分散剂Triton X-100的加入,改善了菌体的分散性,提高了菌体在多个视野出现的概率。根据两种方法可检测性的评估,我们建议在学生抗酸染色实验中,卡介苗的稀释度以6×105~3×106 CFU/mL为宜。
由于本研究没有采用临床标本对改良冷染法的敏感性、假阳性及假阴性进行考察,故不建议用于临床标本的检测。本研究建立的方法主要适用于医科院校学生抗酸染色教学之用。一是解决了卡介苗菌体在水溶液中分散性不好的问题;二是去除了传统抗酸染色中的加热步骤,实现了冷染, 减少了TVOC的释放。
志谢: 本研究TVOC的检测由第三军医大学预防医学院环境卫生学教研室的罗教华副教授携带检测仪器到实验室现场并完成检测,在此表示衷心感谢| [1] |
徐志凯. 分枝杆菌属[M]//李凡, 徐志凯. 医学微生物学. 8版. 北京: 人民卫生出版社, 2013: 141-149.
XU Z K. Mycobacterium[M]//Li F, Xu Z K. Medical microbiology. The 8 edition.Bei Jing:People's Medical Publishing House, 2013: 141-149. |
| [2] | LAMANNA C. The nature of the acid-fast stain[J]. J Bacteriol, 1946, 52: 99–103. |
| [3] | VARUGHESE P, HELBECQUE D M, MCRAE K B, et al. Comparison of strip and Ziehl-Neelsen methods for staining acid-fast bacteria[J]. Bull World Health Organ, 1974, 51(1): 83–91. |
| [4] | ANGRA P, RIDDERHOF J, SMITHWICK R. Comparison of two different strengths of carbol fuchsin in Ziehl-Neelsen staining for detecting acid-fast bacilli[J]. J Clin Microbiol, 2003, 41(7): 3459. DOI:10.1128/jcm.41.7.3459.2003 |
| [5] | CHEN P, SHI M, FENG G D, et al. A highly efficient Ziehl-Neelsen stain: identifying de novo intracellular Mycobacterium tuberculosis and improving detection of extracellular M. tuberculosis in cerebrospinal fluid[J]. J Clin Microbiol, 2012, 50(4): 1166–1170. DOI:10.1128/JCM.05756-11 |
| [6] | KURUP R, CHESTER K. Comparative evaluation of ziehl neelsen staining and knowledge, attitudes and practices of laboratory personnel in relation to ziehl nielsen[J]. West Indian Med J, 2014, 63(1): 34–39. DOI:10.7727/wimj.2012.247 |
| [7] | SELVAKUMAR N, RAHMAN F, RAJASEKARAN S, et al. Inefficiency of 0.3% carbol fuchsin in ziehl-neelsen staining for detecting acid-fast bacilli[J]. J Clin Microbiol, 2002, 40(8): 3041–3043. DOI:10.1128/jcm.40.8.3041-3043.2002 |
| [8] | VASANTHAKUMARI R, JAGANNATH K, RAJASEKARAN S. A cold staining method for acid-fast bacilli[J]. Bull World Health Organ, 1986, 64(5): 741–743. |
| [9] | ZHAO D, YANG X M, CHEN Q Y, et al. A modified acid-fast staining method for rapid detection of Mycobacterium tuberculosis[J]. J Microbiol Methods, 2012, 91(1): 128–132. DOI:10.1016/j.mimet.2012.07.024 |
| [10] |
岳小琴. 抗酸染色冷染法和加温染色法的应用分析[J].
检验医学与临床, 2010, 7(23): 2651, 2658.
YUE X Q. Acid fast stain cold staining and staining heating application analysis[J]. Laboratory Medicine and Clinic, 2010, 7(23): 2651, 2658. DOI:10.3969/j.issn.1672-9455.2010.23.054 |
| [11] |
张小芬, 刘平. 抗酸染色冷染法和热染法查找痰中结核杆菌效果比较[J].
实用预防医学, 2010, 17(10): 2101–2102.
ZHANG X F, LIU P. Comparative study of cold staining and heat staining for detection of acid-fast bacilli in sputum smears[J]. Practical Preventive Medicine, 2010, 17(10): 2101–2102. DOI:10.3969/j.issn.1006-3110.2010.10.066 |
| [12] |
邹毅实, 孙承阜, 方承德, 等. 结核杆菌快速冷染法初步研究[J].
中国防痨杂志, 1991, 13(4): 169–170.
ZOU Y S, SUN C G, FANG C D, et al. A preliminary study on rapid cold staining of Mycobacterium tuberculosis[J]. Chinese Journal of Antituberculosis, 1991, 13(4): 169–170. |
| [13] |
饶贤才. 细菌分类与实验室安全[M]//汪正清. 医学微生物学. 北京: 人民卫生出版社, 2013: 84-100.
RAO X C. Bacterial classification and laboratory safety[M]//Wang Z Q.Medical microbiology. Bei Jing: People's Medical Publishing House, 2013: 84-100. |



