2. 610083 成都,成都军区总医院全军普通外科中心
2. General Surgery Center of PLA, General Hospital of Chengdu Military Command, Chengdu, Sichuan Province, 610083, China
急性胰腺炎 (acute pancreatitis,AP) 是临床常见急腹症之一,其中约15%可发展成重症急性胰腺炎 (severe acute pancreatitis,SAP)[1]。SAP病因多样,发病机制错综复杂,治疗困难,疗程长,病死率高。目前国内外相对公认的是分阶段、多学科、升阶梯治疗策略,即以内科保守治疗为基础,病程进阶达到相关指征时,依次开始经皮穿刺置管引流 (percutaneous catheter drainage,PCD)、腹腔镜清创 (video-assisted retroperitoneal debridement,VARD) 等微创清创,乃至开放式清创术等。而针对腹膜后胰周穿刺引流的PCD,在时间的选择上公认的是应尽量延迟至发病后4周左右,这时胰周积液或坏死物可形成包裹,以防止感染扩散[2-3]。而在发病4周内,很多患者即出现了胰腺炎相关性腹水 (pancreatitis associated ascetic fluid,PAAF),而此时除了内科基础治疗外,并无其他特异性治疗。团队前期工作中,大量临床病例资料的回顾性研究表明,在指征明确无明显禁忌的情况下,早期行腹腔穿刺引流 (abdominal paracentesis drainage,APD) 治疗能有效缓解或控制AP病情,停止或延缓向PCD等后续治疗的进阶及病情的重症化,缩短病程,且未增加腹腔感染的概率[4-5]。类似结果也在团队前期的动物实验中得到佐证[6-7]。
但是,目前国内外关于APD的研究更偏向于治疗效果的观察,关于APD治疗SAP有效性的机制研究却十分缺乏。在SAP病理生理过程中,除了由胰蛋白酶激活引起的胰腺组织的自身消化,细菌移位及炎性介质释放同样是SAP的必要因素[8-9]。本研究拟探讨早期APD可能通过减少SAP时肠道细菌移位及全身炎性因子水平对治疗SAP发挥作用。
1 材料与方法 1.1 实验动物及试剂36只SPF级健康雄性SD大鼠,6~8周龄,体质量200~250 g,购自成都达硕实验动物有限公司。大肠杆菌DH5α感受态细胞 (E.coli DH5α comhpetent cells) 购自宝生物工程 (大连) 有限公司,质粒pBluescript Ⅱ KS (+)-EGFP (eGFP) 购自上海吉然生物科技有限公司。牛磺胆酸钠、戊巴比妥钠购自美国Sigma公司;HE染色试剂盒、C反应蛋白 (CRP)、肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β) 测定试剂盒均购自武汉伊莱瑞特生物科技有限公司。
1.2 可视化大鼠肠道细菌移位模型的建立将购买的氨苄西林抗性eGFP质粒,以热休克法成功转化至DH5α大肠杆菌感受态细胞后,LB平板进行单克隆筛选,LB液体培养基扩增培养待用[10]。
以雄性SD大鼠为模型基础,以氨苄西林抗性LB平板培养基培养其粪便,剔除可培养出氨苄西林耐药细菌的大鼠。
以300 mg/L氨苄西林的抗生素溶液作为日常饮水喂养大鼠行肠道准备3 d。第4天开始,每天1次细菌灌胃 (10 mL/kg,1次/d),灌菌前1 min灌饲1.5%碳酸氢钠溶液1 mL,持续3 d。第7天开始,继续饮用氨苄西林溶液3 d。第10天开始,连续3 d以含100 mg/L氨苄西林的LB琼脂培养基培养其粪便,持续有氨苄西林耐药菌生长,表明肠道中已有示踪菌定植, 即为可视化大鼠肠道细菌移位模型[11]。
1.3 动物分组及模型制备示踪菌定植于肠道内后,36只大鼠分为3组:假手术组 (Sham组)、SAP组和APD组,每组12只。大鼠术前12 h及术后禁食,自由饮用100 mg/L氨苄西林的抗生素溶液。对照组:开腹后仅翻动胰腺数次后关腹;SAP组:在Aho等[12]的经典方法基础上,配合使用微量输液泵[6-7]以12 mL/h速度逆行向胰胆管注入5%牛磺胆酸钠溶液 (1 μL/g),维持10 min后关腹;APD组:参照文献[6-7]的方法,在SAP造模操作后,术中立即于大鼠右下腹留置“十”字腹腔引流管,外接负压引流球后关腹,完成APD操作。3组大鼠均于术后背部皮下注射37 ℃生理盐水 (40 μL/g) 补液。所有重症急性胰腺炎大鼠逐渐产生腹水,且APD组大鼠的腹腔引流管能持续、通畅引流出淡红色清亮腹水,术后24 h共引流出腹水8 mL左右。
1.4 腹水引流量对细菌移位的影响示踪菌定植于肠道内后, 24只大鼠分为2组:完全引流组 (APD) 和半量引流组 (half-APD), 每组12只。对2组大鼠的腹水分别进行完全引流 (即常规APD引流) 和半量引流 (即引流出约4 mL腹水后夹闭引流管)。
1.5 检测指标及方法 1.5.1 无菌取材大鼠均于造模后24 h麻醉,并在无菌条件下进行后续操作:开腹后腹主动脉采血备用,再分别取肠系膜淋巴结和胰腺组织各200 mg。每200 mg标本加入1 mL无菌生理盐水,冰上研磨成匀浆,4 ℃冷藏备用。
1.5.2 组织学检查及病理评分继续切取剩余胰腺组织置于4%多聚甲醛溶液固定24 h。将固定后的标本常规脱水、石蜡包埋、切片、HE染色、封固,最后于光镜下观察。由同一病理医师在不知实验分组情况下观察切片,并依据Hofbauer等[13]报道标准进行评分,10个视野的平均分作为每张切片的最后评分。
1.5.3 细菌培养及鉴定取0.2 mL匀浆均匀涂布到含100 mg/L氨苄西林的LB琼脂培养皿上,37 ℃培养16 h,计数平板菌落数及细菌移位率。无菌牙签挑取培养皿上的单菌落,接种到含100 mg/L氨苄西林的3 mL LB培养液中,37 ℃下180 r/min振荡培养,12 h后进行细菌鉴定。吸取5 μL细菌培养液滴于载玻片上,盖片,在倒置相差荧光显微镜 (Olympus IX81) 下观察细菌的荧光图像,并使用Image-Pro Plus 5.1软件获取荧光图像。
1.5.4 血清相关指标检测血清内毒素、CRP、TNF-α及IL-1β测定采用ELISA法按试剂盒说明书步骤操作。采用全自动酶标仪 (美国Thermo公司) 检测。
1.6 统计学分析采用SPSS 13.0统计软件。计量资料用x±s表示,数据呈正态分布时采用t检验,数据呈非正态分布采用秩和检验和U检验。P < 0.05为差异有统计学意义。
2 结果 2.1 胰腺炎疾病程度 2.1.1 建模24 h后胰腺组织病理改变Sham组胰腺腺泡结构规则;SAP组胰腺实质呈片状出血、坏死,胰腺腺泡细胞结构及间质细胞大量破坏,可见大量红细胞溢出及炎症细胞浸润。APD组可观察到部分胰腺组织水肿,少量胰腺腺泡细胞溶解坏死,少量红细胞溢出及炎症细胞浸润 (图 1)。
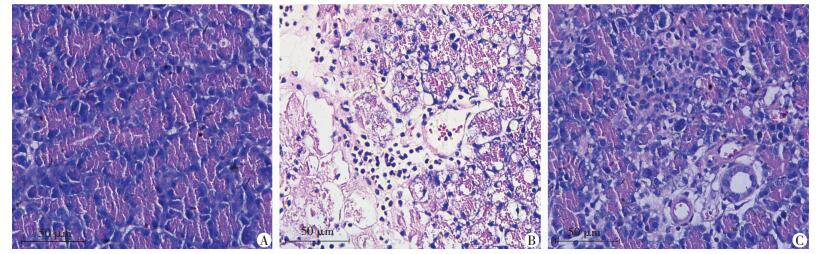
|
| A:Sham组;B:SAP组;C:APD组 图 1 HE染色观察建模24 h后各组胰腺组织病理学变化 |
2.1.2 术后24 h 3组大鼠胰腺组织病理学评分
与Sham组比较,SAP组和APD组胰腺组织病理学评分明显增高,差异有统计学意义 (P < 0.05),而与SAP组比较,APD组评分又明显降低,差异有统计学意义 (P < 0.05,表 1)。
| 组别 | n | 病理评分 |
| Sham组 | 12 | 0.58±0.12 |
| SAP组 | 12 | 10.46±0.87a |
| APD组 | 12 | 5.34±0.43ab |
| a: P < 0.05, 与Sham组比较;b: P < 0.05, 与SAP组比较 | ||
2.2 细菌移位 2.2.1 大鼠单位质量血液、肠系膜淋巴结 (mesenteric lymph nodes,MLN) 和胰腺组织培养出的细菌菌落数情况
术后24 h,3组血液中均无菌落出现,而在MLN和胰腺组织中,Sham组无菌落,SAP组和APD组均有菌落出现,与SAP组相比,APD组菌落数量明显减少,且差异有统计学意义 (P < 0.05,表 2)。
| 组别 | 血液 | MLN | 胰腺组织 |
| Sham组 | 0 | 0 | 0 |
| SAP组 | 0 | (4.55±0.32)×105a | (5.39±0.63)×105a |
| APD组 | 0 | (0.85±0.13)×105ab | (0.91±0.16)×105ab |
| a: P < 0.05,与Sham组比较;b: P < 0.05,与SAP组比较 | |||
2.2.2 血液、MLN和胰腺组织细菌培养的荧光鉴定
Sham组肠系膜淋巴结和胰腺组织以及3组大鼠的血液标本均未培养出发出绿色荧光的GFP-E.coli;而SAP组的肠系膜淋巴结和胰腺组织则培养出大量GFP-E.coli,APD组的肠系膜淋巴结和胰腺组织则培养出少量GFP-E.coli(图 2)。

|
| 图 2 荧光检测建模24 h后各组细菌培养结果 |
2.2.3 ELISA法测定术后24 h各组大鼠血清内毒素水平
与Sham组比较,SAP组及APD组血清内毒素水平显著升高 (P < 0.05);与SAP组比较,APD组血清内毒素水平显著降低 (P < 0.05,表 3)。
| 组别 | n | 内毒素 |
| Sham组 | 12 | 0.25±0.08 |
| SAP组 | 12 | 2.45±0.12a |
| APD组 | 12 | 1.12±0.09ab |
| a: P < 0.05,与Sham组比较;b: P < 0.05,与SAP组比较 | ||
2.3 腹水引流量对肠道细菌移位的影响
通过对大鼠的腹水分别进行完全引流 (APD) 和半量引流 (half-APD),结果见图 3。完全引流和半量引流对肠道细菌的影响存在差异,且差异有统计学意义 (P < 0.05)。
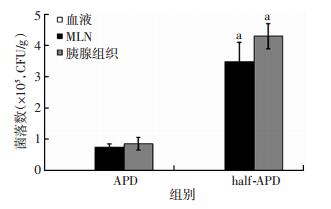
|
| a:P < 0.05,与APD组比较 图 3 腹水引流量对肠道细菌移位的影响 |
2.4 血清炎性因子水平
与Sham组比较,SAP组及APD组血清CRP、TNF-α、IL-1β水平明显升高,差异有统计学意义 (P < 0.05);与SAP组比较,APD组血清CRP、TNF-α、IL-1β水平明显降低,差异有统计学意义 (P < 0.05,表 4)。
| 组别 | CRP (μg/L) | TNF-α(pg/mL) | IL-1β(pg/mL) |
| Sham组 | 745±145 | 57.92±10.12 | 60.38±3.12 |
| SAP组 | 7 648±345a | 351.50±12.15a | 304.78±20.58a |
| APD组 | 3 013±298ab | 227.85±11.14ab | 187.84±15.94ab |
| a: P < 0.05,与Sham组比较;b: P < 0.05,与SAP组比较 | |||
3 讨论
急性胰腺炎是临床常见急腹症,其治疗困难,疗程长,病死率高。目前国内外相对公认的治疗是采取“循序渐进,创伤递增”的分阶段、多学科、升阶梯策略。PCD在时间的选择上国内外公认的是应尽量延迟至发病后4周左右[2, 14-15]。而在发病4周内,很多患者即出现了胰腺炎相关性腹水。课题组前期临床病例回顾性研究表明,在指征明确无明显禁忌的情况下,早期行APD能有效缓解或控制急性胰腺炎病情,停止或延缓向PCD等后续治疗的进阶及病情的重症化,缩短病程,且未增加腹腔感染的概率[4-5]。类似的结果也在动物实验中得到佐证[6-7]。但是,目前国内外关于APD的研究更偏向于治疗效果的观察,关于APD治疗SAP有效性的机制研究却十分缺乏。
在SAP发病机制及病理生理过程中,除了由胰蛋白酶激活引起的胰腺组织的自身消化,细菌移位及炎性介质释放同样是SAP的必要因素[8-9]。我们观察到,SAP大鼠经早期APD治疗后,胰腺组织病理学情况明显改善,组织病理学评分明显降低。这提示早期APD能改善SAP疾病严重程度,与我们团队前期临床回顾性研究结果以及类似动物研究结果相一致[4-7]。我们猜测,早期APD是否可能通过减轻细菌移位及炎性因子来改善SAP。
Samel等[16]通过活体荧光显微镜技术直观观察SAP大鼠,可见绿色荧光标记的大肠细菌从屏障功能受损的小肠腔内经黏膜层、肌层、浆膜层等,逐步移位至胰腺组织。Sun等[17]通过大鼠实验表明,褪黑素能改善肠屏障功能障碍,减少细菌移位,从而减少胰腺炎相关性感染和早期疾病死亡率。Guo等[18]指出,早期肠内营养对肠上皮细胞的修复、增殖和分化的是必要的。清除多余的肠道细菌和补充益生菌可能有助于防止肠道细菌移位和继发感染。Peng等[19]通过实验性大鼠SAP模型明确,早期肠内营养可以改善肠道免疫屏障,从而减轻肠道细菌和内毒素移位,进而改善SAP大鼠生存率。大量实验表明,胰腺炎的治疗与细菌移位密不可分。在本实验中,SAP时出现明显而直观的肠道细菌移位,而经过APD治疗后,细菌移位情况明显得到改善。同时,我们进一步对比完全APD引流和半量APD引流,结果再次验证了APD对细菌移位的改善作用。这提示,早期APD改善了肠道细菌移位情况,并可能是其有效治疗SAP的原因之一。肠道炎症性损伤常常带来急性胰腺炎时SIRS及MODS的出现,因此与肠道炎症反应相关的急性胰腺炎的病理生理机制一直是研究热点[20]。肠道炎性损伤是与随之而来的肠道细菌移位是相关的,而这正与急性胰腺炎相关性感染和全身败血症密切相关[21-22]。本研究中,观察SAP组及APD组大鼠血清炎性因子CRP、TNF-α及IL-1β水平,发现SAP时上述炎性因子明显升高,而与SAP组相比,APD组上述细胞因子水平明显降低。这表明早期APD能改善SAP时的全身炎性反应,可能因其在疾病早期有效去除了腹水及腹水中的炎性因子,从而改善了肠道局部微环境及肠道功能,减轻肠道细菌移位,进而改善SAP,以及后期SIRS及MODS的出现。这与前期团队关于APD改善SAP患者菌血症及内毒素血症、降低机体炎症水平及死亡率的临床研究结果相一致[4]。
本研究观察了早期APD对SAP大鼠胰腺炎疾病程度、肠道细菌移位以及全身炎症水平的影响。结果显示,SAP时大鼠MLN及胰腺组织细菌移位、血清内毒素水平, 血清炎性因子CRP、TNF-α及IL-1β水平均明显升高,而早期APD则能明显改善上述指标。表明在SAP时存在肠道细菌移位及全身炎性反应,而早期APD能减少肠道细菌移位及全身炎性反应,并可能因此改善SAP。但APD如何改善肠道细菌移位及全身炎性反应的机制,则有待进一步研究。
| [1] | Zerem E. Treatment of severe acute pancreatitis and its complications[J]. World J Gastroenterol, 2014, 20(38): 13879–13892. DOI:10.3748/wjg.v20.i38.13879 |
| [2] | da Costa D W, Boerma D, van Santvoort xH C, et al. Staged multidisciplinary step-up management for necrotizing pancreatitis[J]. Br J Surg, 2014, 101(1). DOI:10.1002/bjs.9346 |
| [3] | van Santvoort H C, Besselink M G, Bakker O J, et al. A step-up approach or open necrosectomy for necrotizing pancreatitis[J]. N Engl J Med, 2010, 362(16): 1491–1502. DOI:10.1056/NEJMoa0908821 |
| [4] | Liu W H, Ren L N, Chen T, et al. Abdominal paracentesis drainage ahead of percutaneous catheter drainage benefits patients attacked by acute pancreatitis with fluid collections: a retrospective clinical cohort study[J]. Crit Care Med, 2015, 43(1): 109–119. DOI:10.1097/CCM.0000000000000606 |
| [5] | Liu W H, Wang T, Yan H T, et al. Predictors of percutaneous catheter drainage (PCD) after abdominal paracentesis drainage (APD) in patients with moderately severe or severe acute pancreatitis along with fluid collections[J]. PLoS One, 2015, 10(2): e0115348. DOI:10.1371/journal.pone.0115348 |
| [6] | Chen G Y, Dai R W, Luo H, et al. Effect of percutaneous catheter drainage on pancreatic injury in rats with severe acute pancreatitis induced by sodium taurocholate[J]. Pancreatology, 2015, 15(1): 71–77. DOI:10.1016/j.pan.2014.10.005 |
| [7] | Zhou J, Huang Z, Lin N, et al. Abdominal paracentesis drainage protects rats against severe acute pancreatitis-associated lung injury by reducing the mobilization of intestinal XDH/XOD[J]. Free Radical Biology and Medicine, 2016, 99: 374–384. DOI:10.1016/j.freeradbiomed.2016.08.029 |
| [8] | Dawra R, Sah R P, Dudeja V, et al. Intra-acinar trypsinogen activation mediates early stages of pancreatic injury but not inflammation in mice with acute pancreatitis[J]. Gastroenterology, 2011, 141(6): 2210–2217. DOI:10.1053/j.gastro.2011.08.033 |
| [9] | Tsuji Y, Watanabe T, Kudo M, et al. Sensing of commensal organisms by the intracellular sensor NOD1 mediates experimental pancreatitis[J]. Immunity, 2012, 37(2): 326–338. DOI:10.1016/j.immuni.2012.05.024 |
| [10] |
杜红旗, 李晨阳, 田璐. 一种改进大肠杆菌DH5α转化效率的方法[J].
安徽农业科学, 2009, 37(22): 10420–10423.
Du H Q, Li C Y, Tian L. A Method to Improve the Transformation Efficiency of E.coli DH5α[J]. Journal of Anhui Agri Sci, 2009, 37(22): 10420–10423. DOI:10.13989/j.cnki.0517-6611.2009.22.030 |
| [11] |
宋德胜, 李幼生, 于宝军, 等. 应用绿色荧光蛋白标记技术示踪细菌移位的实验研究[J].
肠外与肠内营养, 2006, 13(2): 65–67.
Song D S, Li Y S, Yu B J, et al. GFP labeling Escherichia coli TG1 tracks bacterial translocation[J]. Parenteral & Enteral Nutrition, 2006, 13(2): 65–67. DOI:10.16151/j.1007-810x.2006.02.001 |
| [12] | Aho H J, Nevalainen T J, Aho A J. Experimental pancreatitis in the rat. Development of pancreatic necrosis, ischemia and edema after intraductal sodium taurocholate injection[J]. Eur Surg Res, 1983, 15(1): 28–36. DOI:10.1159/000128330 |
| [13] | Hofbauer B, Saluja A K, Bhatia M, et al. Effect of recombinant platelet-activating factor acetylhydrolase on two models of experimental acute pancreatitis[J]. Gastroenterology, 1998, 115(5): 1238–1247. DOI:10.1016/s0016-5085(98)70096-4 |
| [14] | Alsfasser G, Hermeneit S, Rau B M, et al. Minimally Invasive Surgery for Pancreatic Disease-Current Status[J]. Dig Surg, 2016, 33(4): 276–283. DOI:10.1159/000445007 |
| [15] | Windsor J A. Minimally invasive pancreatic necrosectomy[J]. Br J Surg, 2007, 94(2): 132–133. DOI:10.1002/bjs.5723 |
| [16] | Samel S, Lanig S, Lux A, et al. The gut origin of bacterial pancreatic infection during acute experimental pancreatitis in rats[J]. Pancreatology, 2002, 2(5): 449–455. DOI:10.1159/000064714 |
| [17] | Sun X, Shao Y, Jin Y, et al. Melatonin reduces bacterial translocation by preventing damage to the intestinal mucosa in an experimental severe acute pancreatitis rat model[J]. Exp Ther Med, 2013, 6(6): 1343–1349. DOI:10.3892/etm.2013.1338 |
| [18] | Guo Z Z, Wang P, Yi Z H, et al. The crosstalk between gut inflammation and gastrointestinal disorders during acute pancreatitis[J]. Curr Pharm Des, 2014, 20(7): 1051–1062. DOI:10.2174/13816128113199990414 |
| [19] | Peng L, Wu L G, Li B, et al. Early enteral nutrition improves intestinal immune barrier in a rat model of severe acute pancreatitis[J]. J Hepatobiliary Pancreat Sci, 2016, 23(11): 681–687. DOI:10.1002/jhbp.358 |
| [20] | Nakajima T, Ueda T, Takeyama Y, et al. Protective effects of vascular endothelial growth factor on intestinal epithelial apoptosis and bacterial translocation in experimental severe acute pancreatitis[J]. Pancreas, 2007, 34(4): 410–416. DOI:10.1097/mpa.0b013e3180335c64 |
| [21] | Flint R S, Windsor J A. The role of the intestine in the pathophysiology and management of severe acute pancreatitis[J]. HPB (Oxford), 2003, 5(2): 69–85. DOI:10.1080/13651820310001108 |
| [22] | Capurso G, Zerboni G, Signoretti M, et al. Role of the gut barrier in acute pancreatitis[J]. J Clin Gastroenterol, 2012, 46(Suppl): S46–S51. DOI:10.1097/MCG.0b013e3182652096 |



