肝部分切除术 (partial hepatectomy,PH) 是目前治疗肝脏疾病的有效办法,但PH后所导致的肝功能衰竭仍是非常棘手的问题。如何加速术后残肝再生,预防术后肝功能衰竭和改善手术效果是PH术后面临的主要问题。Tmub1(transmembrane and ubiquitin-like domain containing 1) 在肝再生过程中会异常表达[1],可能与肝细胞生长、增殖的调控有关[2-4]。Tmub1沉默后肝细胞增殖能力明显增强[5],Tmubl过表达可以明显抑制大鼠肝细胞的增殖,提示Tmub1的表达量与肝细胞增殖情况呈负相关。
Akt是一种丝氨酸/苏氨酸蛋白激酶,Akt磷酸化是其活性形式,Akt活化与细胞生长、增殖及肝再生关系密切。生长因子、激素、细胞因子、PTEN的失活和Ras的激活等均可使Akt活化。本研究通过Tmub1基因沉默观察其对Akt活性及相关增殖蛋白的影响,以及其对肝细胞增殖能力和细胞周期的影响。
1 材料与方法 1.1 RNAi抑制Tmub1表达BRL-3A细胞 (中国科学研究院上海生物院) 用含10% FBS (Excell公司)、100 U/mL青霉素、100 U/mL链霉素 (北京索来宝生物公司) 的高糖DMEM (HyClone公司) 培养液培养于12孔板中,置于37 ℃、5% CO2细胞培养箱中。细胞贴壁后,使用LipoFiterTM脂质体转染试剂盒 (HB-TRLF-2000,汉恒生物有限公司) 将Tmub1干扰siRNA (上海吉玛制药有限公司合成) 转入细胞中 (siRNA组),以空载脂质体 (空载体组) 和不做任何处理的BRL-3A细胞 (空白组) 作为对照,培养6 h后换液后继续培养24 h,然后提取蛋白通过Western blot检测Tmub1表达量。
1.2 qRT-PCR检测6孔板培养BRL-3A细胞,对数生长期对细胞进行不同的处理:对照组 (Ctrl组);siRNA干扰Tmub1表达 (siRNA组);siRNA干扰Tmub1表达并用0.5 μmol/L MK2206(Selleck公司) 处理细胞24 h,对Akt磷酸化进行抑制 (siRNA+MK2206组)。
TRIzol法 (Invitrogen公司) 提取细胞总RNA。使用核酸蛋白分析仪在260/280 nm处测定RNA的纯度和浓度。RNA纯度D(260)/D(280) 比值在1.8~2.0之间,浓度>50 ng/μL时,说明提取的RNA质量较好,符合表达测定要求。使用TIANScriptⅡRT Kit (天根生物有限公司) 进行逆转录得到cDNA。
引物设计与合成均由上海生工完成,各个基因引物序列见表 1。利用Quanti Nova SYBR Green PCR mix (Qiagen公司) 行实时荧光定量PCR检测,按照试剂操作步骤配置20 μL反应体系,然后用Applied Biosystems7300行RT-PCR检测。以GAPDH作为内参,采用2-ΔΔCt法[6]进行数据处理分析。
| 名称 | 序列 |
| Cyclin D1 | 上游:5′-CGCAAACATGCACAGACCTT-3 ′ 下游:5′-AGAGGAAGTTGTTGGGGCTG-3′ |
| c-myc | 上游:5′-TGAAAAGAGCTCCTCGCGTTA-3′ 下游:5′-CTGTTAGCGAAGCTCACGTT-3′ |
| Tmub1 | 上游:5′-CTTAGGAGTCAGGGCGTCAG-3′ 下游:5′-CAGTCACCTCATCCCCTACG-3′ |
| Akt | 上游:5′-TCGTGTGGCAGGATGTGTAT-3′ 下游:5′-TAGGAGAACTTGATCAGGCGG-3′ |
| GAPDH | 上游:5′-GTTACCAGGGCTGCCTTCTC-3′ 下游:5′-ACCAGCTTCCCATTCTCAGC-3′ |
1.3 Western blot检测
按1.2分组及步骤处理细胞,按比例加入含蛋白酶抑制剂 (MCE公司) 及磷酸酶抑制剂 (MCE公司) 的RIPA细胞裂解液作用后,高速离心收集上清,常规提取各组细胞的总蛋白。BCA蛋白检测试剂盒 (康为世纪有限公司) 测定总蛋白浓度。30 μg蛋白经10% SDS-聚丙烯酰胺凝胶电泳分离,电转移至NC膜上。滤膜经室温封闭2 h后,与Tmub1一抗 (美国Abcam公司)、GAPDH一抗 (北京中杉金桥生物技术有限公司)、Akt一抗、Cyclin D1一抗、c-myc一抗 (沈阳万类生物科技有限公司)、p-Akt一抗 (美国Abcam公司)4 ℃孵育过夜,TBST洗涤3次,再与辣根过氧化物酶标记的二抗37 ℃温育1 h,TBST洗涤3次后,应用化学发光底物检测试剂盒 (Millipore公司) 进行检测。结果应用Image J软件分析,p-Akt、Cyclin D1、c-myc以GAPDH为内参照,以靶蛋白/GAPDH灰度的比值作为蛋白的相对表达含量,进行半定量检测。
1.4 平板克隆形成实验6孔板以每孔500个细胞进行接种,按1.2分组及步骤处理细胞,培养10 d后细胞出现肉眼可见克隆,经过甲醇固定、姬姆萨染色后,40倍显微镜下计数大于100个细胞的克隆数,克隆形成率=克隆数/接种细胞数×100%。
1.5 CCK-8检测细胞增殖96孔板以每孔2 000个细胞进行接种,按1.2分组及步骤处理细胞,换液后继续培养0、24、48、72 h;向每孔加入10 μL CCK溶液 (东仁化学科技有限公司),孵育2 h;用酶标仪测定各孔在波长为450 nm处的光密度值[D(450)]。
1.6 流式细胞术分析细胞周期按1.2分组及步骤处理细胞,取各组细胞1×106个,按细胞周期试剂盒 (碧云天生物技术有限公司) 说明书处理染色后,轻轻混匀后过400目筛网制成单细胞悬液,用流式细胞仪检测,每次检测2×104个细胞。结果用ModFit 5.0软件进行分析。
1.7 统计学分析采用SPSS 22.0统计软件,计量资料以x±s表示,组间分析使用单因素方差分析,当总体有统计学意义的时候使用Bonferroni’s多组间比较。以P < 0.05为差异具有统计学意义。
2 结果 2.1 Tmub1基因的siRNA效率验证上海吉玛制药有限公司共合成3条干扰RNA,分别为TMUB1-siRNA166、TMUB1-siRNA496和TMUB1-siRNA711(表 2),按说明书通过脂质体分别将以上3条干扰RNA转入BRL-3A细胞中,并设置空载体组和空白组,提取蛋白后采用Western blot检测干扰效率。结果显示,siRNA496干扰序列对Tmub1的干扰效果最好,Tmub1蛋白表达量明显下降,有效地抑制Tmub1基因的表达 (图 1)。
| 名称 | 序列 (5′→3′) |
| TMUB1-siRNA166 | 正义链:GGUCUCAACACAUACGACUTT 反义链:AGUCGUAUGUGUUGAGACCTT |
| TMUB1-siRNA496 | 正义链:GGUUCGACUCAUCUACCAATT 反义链:UUGGUAGAUGAGUCGAACCTT |
| TMUB1-siRNA711 | 正义链:GGUACUGCCAGAUCCAGUATT 反义链:UACUGGAUCUGGCAGUACCTT |

|
|
1:siRNA166组; 2:siRNA496组; 3:siRNA711组; 4:空载体组; 5:空白组 A:Western blot检测结果;B:半定量分析结果 图 1 不同的RNAi干扰序列对Tmub1沉默的效果 |
2.2 Tmub1沉默对BRL-3A细胞周期相关基因及蛋白表达的影响
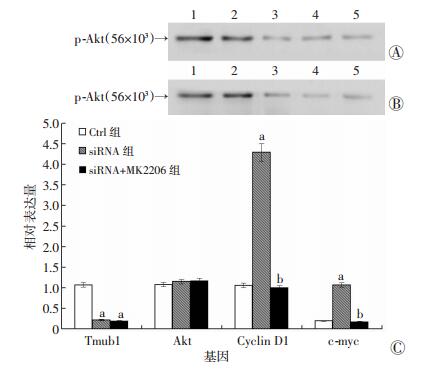
通过设置MK2206浓度梯度及作用时间研究,发现0.5 μmol/L MK2206处理细胞24 h就可以达到对Akt磷酸化的有效抑制 (图 2A、B)。
|
| A:不同浓度MK2206作用24 h对Akt磷酸化的影响1~5:分别为0、0.25、0.5、1、2 μmol/L MK2206;B:0.5 μmol/L MK2206作用不同时间对Akt磷酸化的影响1~5:分别为0、12、24、48、96 h;C:各组Tmub1、Akt、cyclin D1和c-myc基因mRNA表达量比较a: P < 0.05,与Ctrl组比较;b:P < 0.05,与siRNA组比较 图 2 MK2206剂量及作用时间对Akt磷酸化的影响和Tmub1沉默对BRL-3A细胞周期相关基因mRNA表达量的影响 |
qRT-PCR检测Tmub1、Akt、Cyclin D1和c-myc基因mRNA的表达水平,通过Tmub1沉默,Tmub1 mRNA的表达量在siRNA组和siRNA+MK2206组明显下降 (P < 0.05,图 2C);Akt mRNA的表达量3组间无明显变化 (P>0.05,图 2C);siRNA组的Cyclin D1和c-myc基因的mRNA表达水平明显增高 (P < 0.05),MK2206抑制Akt磷酸化后,Cyclin D1和c-myc基因的mRNA表达水平又明显下降,与siRNA组比较,差异有统计学意义 (P < 0.05,图 2C)。
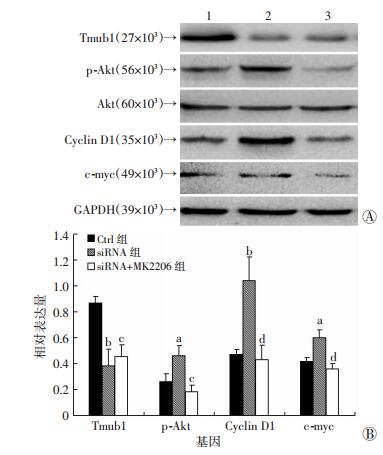
Western blot检测结果与qRT-PCR相似,Tmub1蛋白表达在基因沉默后与Ctrl组比较明显下降;Akt在3组间无差异;p-Akt、Cyclin D1和c-myc蛋白的水平在siRNA组的表达明显增强,MK2206抑制Akt磷酸化后,这3个蛋白的表达水平受到明显抑制,与siRNA组比较有明显差异 (图 3)。
|
|
1:Ctrl组;2:siRNA组;3:siRNA+MK2206组 A:Western blot检测结果;B:半定量分析结果a:P < 0.05, b:P < 0.01, 与Ctrl组比较;c:P < 0.05, d:P < 0.01,与siRNA组比较 图 3 Tmub1沉默对BRL-3A细胞周期相关蛋白表达量的影响 |
2.3 Tmub1沉默对BRL-3A细胞增殖能力的影响
体外平板克隆形成实验的结果显示,与Ctrl组 (图 4A) 相比,Tmub1沉默后的siRNA组 (图 4B) 细胞的集落形成数明显增多,但加入Akt磷酸化抑制剂MK2206后 (图 4C) 细胞增殖能力明显下降。统计学分析显示,siRNA组集落形成率与Ctrl组和siRNA+MK2206组之间有明显的差异 (P < 0.05)。

|
| A~C: Ctrl组 (A)、siRNA组 (B)、siRNA+MK2206组 (C) 平板克隆形成实验对细胞集落形成的比较;D:各组间细胞增殖能力的比较a: P < 0.05,b: P < 0.01,与Ctrl组和siRNA+MK2206组比较 图 4 Tmub1沉默对BRL-3A细胞增殖能力的影响 |
CCK-8检测细胞的增殖能力也显示,与正常表达Tmub1的Ctrl组和siRNA+MK2206组相比,siRNA组细胞增殖能力在培养的第1、2、3天均增高 (图 4D)。
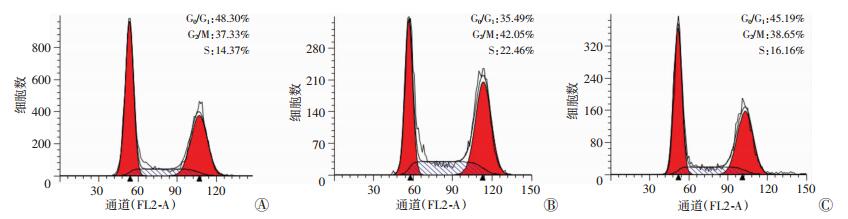
2.4 Tmub1沉默对BRL-3A细胞周期的影响流式细胞术分析细胞周期的结果显示,与Ctrl组相比,siRNA组BRL-3A细胞的G0/G1期细胞比例减少,而S期和G2/M期比例增加,Akt磷酸化被MK2206抑制后,siRNA+MK2206组细胞增殖受到抑制 (图 5)。
|
| A:Ctrl组; B:siRNA组; C:siRNA+MK2206组 图 5 Tmub1沉默对BRL-3A细胞周期的影响 |
3 讨论
肝部分切除术后,体内各种信号因子使肝细胞的增殖明显加快,多种细胞因子可能参与其调控过程[7]。Tmub蛋白在部分肝切除后肝细胞增殖时有明显低表达,表明其在部分肝切除后细胞增殖的过程中发挥了重要作用[8]。Tmub1沉默后肝细胞增殖能力明显增强[5],Tmub1过表达明显抑制BRL-3A细胞的增殖[9],提示Tmub1表达量与肝细胞增殖情况呈负相关。我们采用RNAi技术降低Tmub1基因表达,同样观察到细胞增殖情况和集落形成率比正常对照组高。
Akt是一种丝氨酸/苏氨酸蛋白激酶,与细胞生长、增殖有关。研究表明Akt在细胞增殖及肝再生中有非常重要的作用,在rhALR和EGF诱导的肝细胞增殖中ERK和Akt磷酸化明显增强[10];增加miR-21的表达可以激活Akt1/mTOR复合物信号产生Cyclin D1,从而促进肝部分切除术后早期肝再生[11]。Akt的活化可以促进直肠癌细胞增殖[13]。与此相反,肝脏Akt基因敲除后的小鼠在肝大部切除术后死亡率明显增加,Akt缺陷的残肝细胞在细胞增殖,细胞糖原、脂滴的形成方面均有明显减弱[12]。本研究结果表明,抑制Tmub1表达后,BRL-3A细胞Akt磷酸化明显增强。通过qRT-PCR及Western blot检测其下游分子,发现Cyclin D1和c-myc增殖相关基因的mRNA和蛋白表达水平均增高。这表明Tmub1可以抑制Akt磷酸化,从而起到调节细胞增殖的作用,抑制Tmub1可以解除对Akt磷酸化的影响,从而促进肝细胞增殖。在抑制Tmub1表达的基础上,加入Akt磷酸化抑制剂后,发现Cyclin D1和c-myc的mRNA和蛋白表达水平均下降,说明Tmub1是通过调节Akt磷酸化水平,从而调节其下游分子的表达水平来调节细胞增殖的。
姐妹染色单体在分离前由黏着蛋白复合体相连,其活性受控于分离酶,而分离酶的活性又受控于securin[14]。Tmub1是含有1个泛素样结构域 (ubiquitin-like domain,UBL) 的核-胞质穿梭蛋白[15]。肝部分切除术后,Tmub1进入细胞核与securin结合,占据泛素蛋白结合位点,竞争性抑制泛素与securin的结合,阻断泛素化降解进程,使分离酶不能活化,使姐妹染色单体也不能分离,从而参与调控肝细胞有丝分裂进程[8]。细胞周期分析结果显示,抑制Tmub1表达后,G0/G1期的细胞比例下降,而S+G2/M期细胞比例增高,表明Tmub1可调节细胞周期。
综上所述,Tmub1在肝细胞增殖及肝再生方面具有重要作用,其通过影响Akt磷酸化活性从而调节肝细胞增殖,抑制其表达可以提高Akt磷酸化活性促进细胞进入S期和G2/M期进行有丝分裂增殖。本研究为Tmub1及其相关蛋白分子为靶点的肝再生机制的研究提供了一定的理论依据,但是在体实验Tmub1是否也能够促进部分肝切除后残肝再生还需进一步研究。
| [1] |
付航玮, 陈健, 许建华, 等. Tmub1对再生肝细胞有丝分裂的影响及其机制[J].
第三军医大学学报, 2017, 39(7): 603–607.
Fu H W, Chen J, Xu J H, et al. Effect of Tmub1 on mitosis of regenerating hepatocytes in rats[J]. J Third Mil Med Univ, 2017, 39(7): 603–607. DOI:10.16016/j.1000-5404.201610134 |
| [2] | Jung Y, Oh S H, Witek R P, et al. Somatostatin stimulates the migration of hepatic oval cells in the injured rat liver[J]. Liver Int, 2012, 32(2): 312–320. DOI:10.1111/j.1478-3231.2011.02642.x |
| [3] | Tordjmann T. Hippo signalling: liver size regulation and beyond[J]. Clin Res Hepatol Gastroenterol, 2011, 35(5): 344–346. DOI:10.1016/j.clinre.2011.01.012 |
| [4] | Yin S, Wang H, Park O, et al. Enhanced liver regeneration in IL-10-deficient mice after partial hepatectomy via stimulating inflammatory response and activating hepatocyte STAT3[J]. Am J Pathol, 2011, 178(4): 1614–1621. DOI:10.1016/j.ajpath.2011.01.001 |
| [5] |
马德宾, 沈雁兵, 王保林, 等. Tmub1沉默对大鼠肝部分切除术后肝细胞增殖的影响[J].
第三军医大学学报, 2013, 35(9): 850–853.
Ma D B, Shen Y B, Wang B L, et al. Influence of Tmub1 silencing on proliferation of rat hepatocytes after partial hepatectomy[J]. J Third Mil Med Univ, 2013, 35(9): 850–853. DOI:10.16016/j.1000-5404.2013.09.019 |
| [6] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T)) Method[J]. Methods, 2001, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| [7] | Fujiyoshi M, Ozaki M. Molecular mechanisms of liver regeneration and protection for treatment of liver dysfunction and diseases[J]. J Hepatobiliary Pancreat Sci, 2011, 18(1): 13–22. DOI:10.1007/s00534-010-0304-2 |
| [8] |
赵晓彪, 李光耀, 刘孟刚, 等. 肝部分切除术后Tmub1蛋白与securin蛋白的相互作用研究[J].
解放军医学杂志, 2014, 39(11): 864–867.
Zhao X B, Li G Y, Liu M G, et al. Research on the interaction of protein Tmub1 and securin after partial hepatectomy[J]. Med J Chin PLA, 2014, 39(11): 864–867. DOI:10.11855/j.issn.0577-7402.2014.11.04 |
| [9] |
赵晓彪, 李光耀, 刘孟刚, 等. Tmub1过表达及沉默慢病毒载体转染对大鼠BRL-3A肝细胞增殖的影响[J].
解放军医学杂志, 2016, 41(1): 12–16.
Zhao X B, Li G Y, Liu M G, et al. Effects of over-expression and silenced lentivirus Tmub1 vectors transfection on the proliferation of rat liver cell line BRL-3A[J]. Med J Chin PLA, 2016, 41(1): 12–16. DOI:10.11855/j.issn.0577-7402.2016.01.03 |
| [10] | Ilowski M, Putz C, Weiss T S, et al. Augmenter of liver regeneration causes different kinetics of ERK1/2 and Akt/PKB phosphorylation than EGF and induces hepatocyte proliferation in an EGF receptor independent and liver specific manner[J]. Biochem Biophys Res Commun, 2010, 394(4): 915–920. DOI:10.1016/j.bbrc.2010.03.074 |
| [11] | Ng R, Song G H, Roll G R, et al. A microRNA-21 surge facilitates rapid cyclin D1 translation and cell cycle progression in mouse liver regeneration[J]. J Clin Invest, 2012, 122(3): 1097–1108. DOI:10.1172/jci46039 |
| [12] | Pauta M, Rotllan N, Fern ndez-Hernando A, et al. Akt-mediated foxo1 inhibition is required for liver regeneration[J]. Hepatology, 2016, 63(5): 1660–1674. DOI:10.1002/hep.28286 |
| [13] | Wen X, Zhu J, Dong L, et al. The role of c2orf68 and PI3K/Akt/mTOR pathway in human colorectal cancer[J]. Med Oncol, 2014, 31(8): 92. DOI:10.1007/s12032-014-0092-7 |
| [14] | Stemmann O, Gorr I H, Boos D. Anaphase topsy-turvy: Cdk1 a securin, separase a CKI[J]. Cell Cycle, 2006, 5(1): 11–13. DOI:10.4161/cc.5.1.2296 |
| [15] | Liu M, Liu H, Wang X, et al. IL-6 induction of hepatocyte proliferation through the Tmub1-regulated gene pathway[J]. Int J Mol Med, 2012, 29(6): 1106–1112. DOI:10.3892/ijmm.2012.939 |



