原发性肝癌是我国最常见的肿瘤之一,居所有肿瘤发病率的第4位,死亡率居第3位[1]。肝癌按细胞分型可分为肝细胞癌、胆管细胞癌及混合型肝癌,其中肝细胞癌最常见。肝细胞癌 (hepatocellular carcinoma, HCC) 是预后较差的肿瘤之一,约90%的患者有慢性乙型肝炎病史。由于只有10%~20%的患者可以获得外科完整切除,因此HCC总体预后不佳,其5年生存率约为15%。HCC根治切除后5年复发率高达60%以上 (小肝癌为40%~50%)[2],复发中位期为15个月[3]。因此,探索HCC预后及有效的靶向治疗相关分子标志物至关重要。
B细胞异位基因2(B-cell translocation gene 2, BTG2) 是BTG/TOB家族中的一个成员,近年来研究表明,TOB/BTG家族成员均为抑癌基因,且该家族与其他抑癌基因如p53等具有密切联系[4]。BTG2于1996年被Rouault等[5]发现,位于1号染色体长臂的3区2带上,编码158个氨基酸的蛋白质。BTG2是一个瞬时早期反应基因,当细胞受到基因毒性药物、氧化应激、电离辐射等因素刺激时,可经p53依赖或非依赖途径上调BTG2表达,从而作用于下游一系列靶分子使细胞捕获在G1/S期,是BTG2基因的主要功能途径[4]。已有大量研究证实,BTG2在许多肿瘤中的表达下调,作为一种抑癌基因在多种肿瘤细胞的分化、增殖、DNA损伤修复以及凋亡中起重要作用[4, 6-7]。但是BTG2作为重要的调控细胞周期的抑癌基因,其与肝癌发生、发展的关系及能否作为预后指标还不清楚。因此,本研究采用免疫组化方法分析BTG2蛋白在肝癌组织中的表达情况以及与肝癌的临床病理特征和预后的相关性。
1 资料与方法 1.1 一般资料回顾性收集我院2012年1月至2014年12月经病理诊断证实为HCC患者共125例。病理分化等级依据WHO肿瘤组织学分型标准,高分化16例,中分化83例,低分化26例。肝功能分级采用Child-Pugh分级标准,以手术前最近1次的临床数据进行分级,其中A级106例,B或C级共19例。纳入标准:原发性肝癌;首次治疗可根治切除;术后均接受肝动脉化疗栓塞标准治疗。排除标准:术前进行放疗或化疗;术前诊断为远处转移不可根治切除;手术切缘阳性;未进行正规治疗。
1.2 免疫组化方法及评分原则125例HCC癌组织石蜡标本及其中77例癌旁组织被连续切片,厚3 μm,用人类BTG2单克隆抗体 (1 :1 000,Abcam公司) 进行免疫组化检测。免疫组化方法采用辣根过氧化物酶法,具体步骤参照文献[8]。用已知阳性切片做阳性对照,以PBS代替一抗做阴性对照。所有病理切片由2名经验丰富的病理科医师在没有临床病理资料的情况下进行评分。若结果存在差异则被再次评估,直到达成共识。免疫组化着色强度被分为4级:在5个高倍镜视野下评估被特异性着色的细胞百分比 (0%~100%),根据着色强度和细胞阳性率综合判断BTG2的表达高低,由低到高分为4个等级:-(无表达)、+(低表达)、+ +(中表达)、+ + +(强表达)[9]。根据免疫组化染色结果将患者分为3组,BTG2高表达组:BTG2蛋白中表达 (+ +) 或强表达 (+ + +);BTG2低表达组:BTG2蛋白低表达 (+);BTG2阴性组:BTG2蛋白无表达 (-)。
1.3 荧光实时定量PCR (RT-PCR)选取12对癌与癌旁配对的石蜡组织,采用Tiangen公司的试剂盒 (RNAprep pure FFPE Kit) 提取石蜡组织中总RNA,并逆转录成cDNA。Primer Premier 5软件设计BTG2引物,上游为5′-AGGGTAACGCTGTCTTGTGG-3′,下游为5′-TTGTAGTGCTCTGTGAGTGCC-3′,扩增片段大小为122 bp;以GAPDH基因为内参,上游引物为5′-GCAGGGGGGAGCCGGGT-3′,下游引物为5′-TGGGTGGCAGTGATGGCATGG-3′,扩增片段大小为119 bp。根据实验所获Ct值对BTG2进行相对定量,用比较Ct值法 (2-ΔΔCt) 进行分析。
1.4 随访及统计学分析随访101例患者的生存信息。中位随访时间25(2~52) 个月。Fisher确切概率法比较BTG2蛋白不同表达强度在癌与癌旁组织间比例的差异以及癌组织BTG2阳性率与肝癌患者临床病理特征的关系。Kaplan-Meier作图联合Log-Rank检验比较不同BTG2表达强度组间总生存期差异。Cox等比例风险回归分析临床病理因素、BTG2蛋白表达与肝癌术后总生存期相关性,以P < 0.05作为入选变量标准,P>0.15作为排除变量标准,逐步Cox回归分析总生存期独立预后因素。应用SPSS 13.0统计软件进行统计分析,采用Graphpad Prism 5作图。检验水准:α=0.05。
2 结果 2.1 BTG2蛋白在HCC癌组织与癌旁组织中的表达BTG2蛋白在HCC癌旁及癌组织中均为弥漫性胞浆表达 (图 1)。125例癌组织中,癌与癌旁组织BTG2蛋白表达差异有统计学意义 (χ2=28.102,P < 0.01,表 1)。选取了12对癌与癌旁配对组织,用RT-PCR检测组织中BTG2基因的mRNA水平,发现其中癌组织BTG2表达水平低于癌旁的有8例。
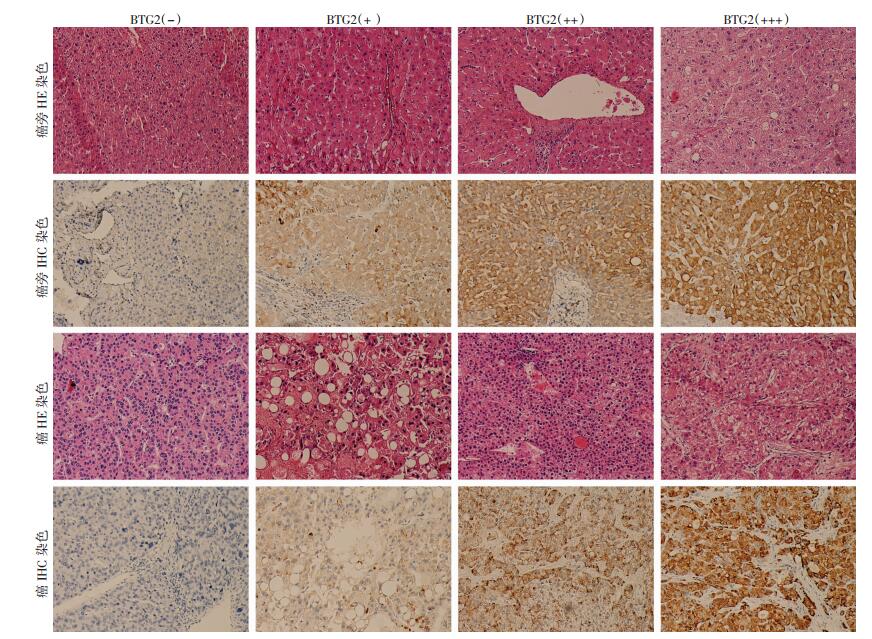
|
| 图 1 HE染色及IHC染色观察BTG2蛋白在HCC癌旁与癌组织中的表达 (×100) |
| 组织 | BTG2(-) | BTG2(+) | BTG2(++/+++) |
| 癌 | 106 (84.8) | 13 (10.4) | 6 (4.8) |
| 癌旁 | 41 (53.2) | 14 (18.2) | 22 (28.6) |
2.2 HCC癌组织中BTG2蛋白的表达与其临床病理特征的关系
临床基线特征中,癌栓发生与BTG2表达有关 (χ2=8.305,P=0.013),而分化程度、肿瘤直径、肝硬化、甲胎蛋白 (AFP) 水平和肝功能Child-Pugh分级等均与BTG2表达无关 (P>0.05,表 2)。
| 组别 | n | 性别 | 年龄 (岁) | 分化程度 | 肿瘤直径 (cm) | 肝硬化 | 乙肝 | AFP (ng/mL) | 肝功能Child-Pugh分级 | 肿瘤卫星 | 癌栓 | 转移情况 | ||||||||||||||||||||||
| 男 | 女 | ≤52 | >52 | 低分化 | 中分化 | 高分化 | ≤5 | >5 | 有 | 无 | 有 | 无 | ≤20 | >20 | A | B或C | 有 | 无 | 有 | 无 | 有 | 无 | ||||||||||||
| BTG2阴性组 | 106 | 93 | 13 | 56 | 50 | 24 | 67 | 15 | 63 | 43 | 85 | 21 | 88 | 18 | 38 | 68 | 89 | 17 | 3 | 103 | 13 | 93 | 26 | 80 | ||||||||||
| BTG2低表达组 | 13 | 13 | 0 | 6 | 7 | 1 | 12 | 0 | 7 | 6 | 11 | 2 | 12 | 1 | 5 | 8 | 11 | 2 | 0 | 13 | 6 | 7 | 1 | 12 | ||||||||||
| BTG2高表达组 | 6 | 6 | 0 | 1 | 5 | 1 | 4 | 1 | 2 | 4 | 5 | 1 | 6 | 0 | 2 | 4 | 6 | 0 | 0 | 6 | 1 | 5 | 0 | 6 | ||||||||||
| χ2值 | 1.407 | 2.930 | 4.186 | 1.700 | 0.171 | 0.982 | 0.181 | 0.072 | 0.638 | 8.305 | 2.825 | |||||||||||||||||||||||
| P值 | 0.535 | 0.231 | 0.313 | 0.437 | 1.000 | 0.653 | 1.000 | 0.788 | 1.000 | 0.013 | 0.242 | |||||||||||||||||||||||
2.3 HCC癌组织中BTG2表达的高低与HCC患者手术后预后的关系
BTG2低表达组中位总生存期为36个月 (95%CI:8.436~63.564),而高表达和阴性组未达到中位总生存期 (Log-Rank χ2=4.512,P=0.105,图 2)。亚组分析结果表明,BTG2高表达组患者总生存期显著长于低表达组 (χ2=4.266,P=0.039),BTG2高表达与阴性组 (χ2=2.729,P=0.099) 以及BTG2低表达与阴性组 (χ2=1.400,P=0.237) 之间差异没有统计学意义。单因素Cox回归分析结果表明,分化程度、肝硬化、癌栓和转移情况与HCC患者术后的总生存期有显著相关性 (表 3)。以所有单因素变量为候选变量,逐步回归分析结果显示,分化程度、肝硬化、癌栓和转移情况是总生存期的独立预后因素。肝硬化患者死亡风险显著高于无肝硬化者 (HR=10.852,95%CI: 1.435~ 85.025),有癌栓形成或有远处转移患者的死亡风险也分别显著高于没有癌栓形成或无远处转移者 (表 3),但是BTG2表达未能进入回归方程。

|
| 图 2 Kaplan-Meier分析癌组织BTG2表达与患者术后生存之间的关系 |
| 临床因素 | 单因素 | 多因素 | |||
| P值 | HR(95%CI) | P值 | HR(95%CI) | ||
| BTG2表达 | 0.032a | ||||
| + vs- | 0.246 | 1.632 (0.713~3.736) | |||
| ++/+++ vs- | 0.975 | 0.000 | |||
| 性别 (女vs男) | 0.816 | 0.884(0.314~2.493) | |||
| 年龄 (>52岁vs ≤52岁) | 0.399 | 0.76(0.402~1.437) | |||
| 分化程度 | 0.026 | 0.024 | |||
| 高vs低 | 0.137 | 0.456(0.162~1.284) | 0.340 | 0.561(0.171~1.838) | |
| 中vs低 | 0.008 | 0.385(0.191~0.776) | 0.007 | 0.350(0.164~0.747) | |
| 肿瘤直径 (>5 cm vs ≤5 cm) | 0.874 | 1.054(0.552~2.010) | |||
| 肝功能 (Child-Pugh分级,B或C vs A) | 0.130 | 1.784(0.843~3.755) | |||
| 肝硬化 (有vs无) | 0.014 | 12.014(1.648~87.602) | 0.021 | 10.852(1.435~82.095) | |
| 乙肝 (有vs无) | 0.442 | 1.504(0.531~4.260) | |||
| 癌栓 (有vs无) | < 0.001 | 4.970(2.458~10.048) | < 0.001 | 5.080(2.331~11.074) | |
| AFP (>20 ng/mL vs ≤20 ng/mL) | 0.272 | 1.481(0.734~2.988) | |||
| 肿瘤卫星 (有vs无) | 0.500 | 1.990(0.270~14.692) | |||
| 转移情况 (有vs无) | 0.005 | 2.734(1.351~5.532) | 0.001 | 3.779(1.715~8.326) | |
| a:似然比检验 | |||||
3 讨论
影响肝癌预后的因素主要包括患者自身因素、肿瘤因素及治疗方法3个方面。患者自身因素里肝脏背景,即肝炎病毒的感染和肝硬化的程度,被视为最重要的预后因素之一[10]。70%的肝癌患者都存在乙肝病毒的感染[11],绝大部分有肝硬化。由于乙肝疫苗的推广,肝癌在我国的发病率已由原来在所有肿瘤中排第2位降至第4位[1]。肿瘤因素中有无静脉癌栓、肝内转移、肿瘤多发是影响肝癌预后的最重要因素[12]。手术治疗是肝癌的首选治疗方法,肝癌术后的1、3、5年总体生存率分别为85.9%、64.6%、53.2%[13]。本研究结果显示肝硬化、癌栓、肝内转移是肝癌患者的独立预后因素,和既往报道一致[12]。此外本研究结果还显示BTG2蛋白在癌组织中的表达和癌栓的发生显著相关 (χ2=8.305,P=0.013),提示其和肝癌患者的预后相关。
BTG2是一个瞬时早期反应基因,当细胞受到基因毒性药物、氧化应激、电离辐射等因素刺激时,可以经p53依赖或非依赖途径上调BTG2的表达,上调的BTG2蛋白能够抑制细胞周期蛋白cyclin D1的表达,从而经视网膜母细胞瘤基因 (Rb) 途径下调cyclin A,使细胞捕获在G1/S期;或者经不依赖于Rb的途径直接下调cyclin E,使细胞捕获在G1/S期[14-15]。已经有大量研究报道,BTG2在许多肿瘤里表达下调[16-18],其在肿瘤的增殖、分化、凋亡等多个方面发挥重要作用[19-20]。本研究发现BTG2在肝癌组织中表达明显低于癌旁组织,提示BTG2基因的表达缺失可能在肝癌的形成过程中起着重要的作用。
本研究结果还显示BTG2的表达和肝癌癌栓的形成有关,从结果上看BTG2低表达组 (+) 的癌栓发生率明显高于其他两组。这说明BTG2弱阳性表达反而是一种有害标志,与Kaplan-Meier分析结果相一致。因为BTG2基因是一个早期瞬时反应基因,作为抑癌基因,对促增殖因子进行应答从而限制肿瘤细胞过度增殖,所以其低水平表达可能只是作为肿瘤细胞迅速增殖的负反馈信号,而并不意味着BTG2是肝癌细胞恶性表型 (癌栓形成) 的起因。有研究曾报道BTG2促进了膀胱癌细胞的迁移并且BTG2的过表达还和膀胱癌患者的不良预后相关[9]。所以关于BTG2在肝癌形成过程中起作用的机制还有待深入研究。
有研究报道BTG2高表达与乳腺癌患者长期生存相关,HER2、Ki67联合BTG2能更好地预测乳腺癌患者的生存预后[21]。本研究结果显示BTG2高表达组总生存期长于BTG2低表达组或阴性组,在随访期间内均无死亡。但因为BTG2蛋白高表达组样本很少 (6例),所以Kaplan-Meier曲线法和Cox风险回归分析均没有得出BTG2表达水平与HCC患者总生存期相关的确切结论。抑癌基因的缺失表达是重要致瘤机制之一,二倍体细胞一个等位基因发生截短突变,另一个等位基因所在染色体臂发生杂合性缺失是抑癌基因完全失活的一般机制[22]。我们推测本研究中,BTG2低表达组可能是只有一个等位基因表达的结果,但因单倍性不足而导致肿瘤发生。
综上所述,BTG2基因在HCC患者的癌旁组织表达明显高于癌组织,其在肝癌组织中的表达情况和肝癌患者癌栓形成有关,BTG2的高表达提示HCC患者有更好的预后。因此检测BTG2在HCC组织中的表达情况,可有效评估肝癌患者术后的生存情况,为恰当的个体化治疗提供依据。本研究例数较少,降低了统计学效能,另外主要使用了免疫组化一种方法来检测BTG2蛋白,没有用新鲜肝癌组织进行PCR和Western blot实验,没有对组织样本进行BTG2基因突变或拷贝数变异分析或者表观遗传分析,因此难以揭示BTG2的分子病理机制。
| [1] | Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | Park S K, Jung Y K, Chung D H, et al. Factors influencing hepatocellular carcinoma prognosis after hepatectomy: a single-center experience[J]. Korean J Intern Med, 2013, 28(4): 428–438. DOI:10.3904/kjim.2013.28.4.428 |
| [3] | Han J H, Kim D G, Na G H, et al. Evaluation of prognostic factors on recurrence after curative resections for hepatocellular carcinoma[J]. World J Gastroenterol, 2014, 20(45): 17132–17140. DOI:10.3748/wjg.v20.i45.17132 |
| [4] | Mao B, Zhang Z, Wang G. BTG2: a rising star of tumor suppressors (review)[J]. Int J Oncol, 2015, 46(2): 459–464. DOI:10.3892/ijo.2014.2765 |
| [5] | Rouault J P, Falette N, Guéhenneux F, et al. Identification of BTG2, an antiproliferative p53-dependent component of the DNA damage cellular response pathway[J]. Nat Genet, 1996, 14(4): 482–486. DOI:10.1038/ng1296-482 |
| [6] | Gao S S, Yang X H, Wang M. Inhibitory effects of B-cell translocation gene 2 on skin cancer cells via the Wnt/β-catenin signaling pathway[J]. Mol Med Rep, 2016, 14(4): 3464–3468. DOI:10.3892/mmr.2016.5596 |
| [7] | Choi O R, Ryu M S, Lim I K. Shifting p53-induced senescence to cell death by TIS21(/BTG2/Pc3) gene through posttranslational modification of p53 protein[J]. Cell Signal, 2016, 28(9): 1172–1185. DOI:10.1016/j.cellsig.2016.05.014 |
| [8] | Dotsikas Y, Loukas Y L. Improved performance of antigen-HRP conjugate-based immunoassays after the addition of anti-HRP antibody and application of a liposomal chemiluminescence marker[J]. Anal Sci, 2012, 28(8): 753–757. DOI:10.2116/analsci.28.753 |
| [9] | Wagener N, Bulkescher J, Macher-Goeppinger S, et al. Endogenous BTG2 expression stimulates migration of bladder cancer cells and correlates with poor clinical prognosis for bladder cancer patients[J]. Br J Cancer, 2013, 108(4): 973–982. DOI:10.1038/bjc.2012.573 |
| [10] | Zhu W J, Huang C Y, Li C, et al. Risk factors for early recurrence of HBV-related hepatocellular carcinoma meeting milan criteria after curative resection[J]. Asian Pac J Cancer Prev, 2013, 14(12): 7101–7106. DOI:10.7314/apjcp.2013.14.12.7101 |
| [11] | Yu S J, Kim Y J. Hepatitis B viral load affects prognosis of hepatocellular carcinoma[J]. World J Gastroenterol, 2014, 20(34): 12039–12044. DOI:10.3748/wjg.v20.i34.12039 |
| [12] | Zhang T T, Zhao X Q, Liu Z, et al. Factors affecting the recurrence and survival of hepatocellular carcinoma after hepatectomy: a retrospective study of 601 Chinese patients[J]. Clin Transl Oncol, 2016, 18(8): 831–840. DOI:10.1007/s12094-015-1446-0 |
| [13] |
程树群, 吴孟超. 原发性肝癌综合治疗进展[J].
中华肝胆外科杂志, 2009, 15(4): 241–243.
Cheng S Q, Wu M C. Advancement in comprehensive treatment of primary hepatocellular carcinoma[J]. Chinese Journal of Hepatobiliary Surgery, 2009, 15(4): 241–243. DOI:10.3760/cma.j.issn.1007-8118.2009.04.001 |
| [14] | Chiang K C, Tsui K H, Chung L C, et al. Cisplatin modulates B-cell translocation gene 2 to attenuate cell proliferation of prostate carcinoma cells in both p53-dependent and p53-independent pathways[J]. Sci Rep, 2014, 4: 5511. DOI:10.1038/srep05511 |
| [15] | Lim I K. TIS21 (/BTG2/PC3) as a link between ageing and cancer: cell cycle regulator and endogenous cell death molecule[J]. J Cancer Res Clin Oncol, 2006, 132(7): 417–426. DOI:10.1007/s00432-006-0080-1 |
| [16] | Sun Q, Hang M, Guo X, et al. Expression and significance of miRNA-21 and BTG2 in lung cancer[J]. Tumour Biol, 2013, 34(6): 4017–4026. DOI:10.1007/s13277-013-0992-8 |
| [17] | Li Y J, Dong B K, Fan M, et al. BTG2 inhibits the proliferation and metastasis of osteosarcoma cells by suppressing the PI3K/AKT pathway[J]. Int J Clin Exp Pathol, 2015, 8(10): 12410–12418. DOI:10.1007/s13277-014-2631-4 |
| [18] | Ficazzola M A, Fraiman M, Gitlin J, et al. Antiproliferative B cell translocation gene 2 protein is down-regulated post-transcriptionally as an early event in prostate carcinogenesis[J]. Carcinogenesis, 2001, 22(8): 1271–1279. DOI:10.1093/carcin/22.8.1271 |
| [19] | Lee J C, Chung L C, Chen Y J, et al. Upregulation of B-cell translocation gene 2 by epigallocatechin-3-gallate via p38 and ERK signaling blocks cell proliferation in human oral squamous cell carcinoma cells[J]. Cancer Lett, 2015, 360(2): 310–318. DOI:10.1016/j.canlet.2015.02.034 |
| [20] | Micheli L, Ceccarelli M, Farioli-Vecchioli S, et al. Control of the Normal and Pathological Development of Neural Stem and Progenitor Cells by the PC3/Tis21/Btg2 and Btg1 Genes[J]. J Cell Physiol, 2015, 230(12): 2881–2890. DOI:10.1002/jcp.25038 |
| [21] | Möllerström E, Kovács A, Lövgren K, et al. Up-regulation of cell cycle arrest protein BTG2 correlates with increased overall survival in breast cancer, as detected by immunohistochemistry using tissue microarray[J]. BMC Cancer, 2010, 10: 296. DOI:10.1186/1471-2407-10-296 |
| [22] | Juric D, Castel P, Griffith M, et al. Convergent loss of PTEN leads to clinical resistance to a PI (3) Kα inhibitor[J]. Nature, 2015, 518(7538): 240–244. DOI:10.1038/nature13948 |



