类鼻疽伯克霍尔德菌(Burkholderia pseudomallei, 简称类鼻疽杆菌)是一种革兰阴性短杆菌,属于伯克霍尔德氏菌属[1]。类鼻疽杆菌也称土壤菌,是一种具有微生态稳定性的细菌,主要分布于土壤和水中,可经破损的皮肤或黏膜感染人体,表现出多脏器脓肿及其他炎症等体征,所致疾病称类鼻疽[2-5]。类鼻疽的流行区域主要分布在南纬20°~北纬20°范围,覆盖了东南亚、澳洲北部以及我国海南、广东、广西、福建、香港、台湾等地区[6]。近年来全球类鼻疽流行形势日趋严峻,但目前尚无有效疫苗。2006年美国疾病预防控制中心将其列为B类生物恐怖剂,2012年已提升为Ⅰ类病原体(Tier 1 select agent)[7],美国、澳大利亚等政府和军队已把它列为公共卫生健康和生物国防安全的重要内容[8]。因此,类鼻疽杆菌作为一种威胁公共卫生的病原体,加强其致病机制研究具有重要的社会效益和军事价值[9]。细菌分泌系统在细菌致病过程中起着关键作用,而目前国内关于类鼻疽杆菌分泌系统的研究鲜有报道。和其他革兰阴性菌一样,类鼻疽杆菌拥有注射器状的Ⅲ型分泌系统(Type Ⅲ secretion system,T3SS),它是致病菌中存在的复杂分子装置和重要的毒力因子。类鼻疽杆菌的Ⅲ型分泌系统基因位置分区概括为T3SS1(BPSS1390-1408)、T3SS2(BPSS1613-1629) 和T3SS3(BPSS1520-1554)[10]。BPSS1395蛋白(来源于T3SS1) 的功能未知,生物信息学对比发现与之同源性较高的蛋白是青枯杆菌重要转录调节因子和分泌蛋白HrpF(hypersentive response and pathogenicity F,属于T3SS效应蛋白)[11]。由此,推定BPSS1395很有可能是Ⅲ型分泌系统的转运和定向元件,在类鼻疽杆菌致病过程中发挥重要作用。因此本课题重组表达制备具有免疫活性的BPSS1395蛋白,用于免疫动物及亚细胞定位实验,以期为进一步研究类鼻疽杆菌的致病机制奠定基础。
1 材料与方法 1.1 材料 1.1.1 质粒和菌株pET-22b质粒为TaKaRa公司产品,BPC006菌株、大肠埃希菌BL21(DE3)、人肺癌上皮细胞A549由本实验室保存。
1.1.2 主要试剂细菌DNA基因组提取试剂盒、DNA胶回收试剂盒、质粒提取试剂盒购自美国OMEGA公司;尿素、高保真DNA聚合酶、BamHⅠ和XhoⅠ限制性内切酶、DNA连接酶、DNA Marker、蛋白Marker购自大连TaKaRa公司;HRP标记山羊抗兔IgG抗体,购自北京中杉金桥公司;缓冲液A由50 mmol/L Tris-HCl(pH=8.0)、2 mmol/L EDTA、100 mmol/L NaCl配制;缓冲液B由50 mmol/L Tris-HCl(pH=8.0),1 mmol/L EDTA、100 mmol/L NaCl、1%Triton X-100配制;缓冲液Ⅰ由50 mmol/L Tris-HCl(pH=8.0), 2 mmol/L EDTA、100 mmol/L NaCl、0.5%Triton X-100(体积比)、2 mol/L尿素配制;缓冲液Ⅱ由50 mmol/L Tris-HCl(pH=8.0)、2 mmol/L EDTA、100 mmol/L NaCl、3%Triton X-100配制;缓冲液Ⅲ由50 mmol/L Tris-HCl(pH=8.0)、2 mmol/L EDTA、100 mmol/L NaCl、0.5% Triton X-100、2 mol/L盐酸胍配制。
1.1.3 实验动物新西兰大白鼠2只,雌性,3~4周龄,体质量0.6~1.0 kg,购自第三军医大学实验动物中心。
1.2 方法 1.2.1 BPSS1395基因编码蛋白质的生物信息学分析用BLAST和Primer对GenBank公布BPC006菌株全基因组中BPSS1395基因序列进行核酸序列分析;用TMHMM网站(http://www.cbs.dtu.dk/services/TMHMM-2.0/)对BPSS1395蛋白质结构特征进行在线分析,预测其亚细胞定位。
1.2.2 PCR引物的设计和合成根据BPSS1395基因序列及质粒pET-22b克隆位点序列设计PCR引物。BPSS1395基因上游引物P1:5′-CGCggatccATGGC-TATTTGGTTGAGACG-3′(BamHⅠ);下游引物P2:5′-CCGctcgagTCATGCCCGCCCCCCCGCGCT-3′(XhoⅠ)。上游引物和下游引物5′端分别引入BamHⅠ和XhoⅠ酶切位点(小写部分为酶切位点)及保护碱基。上述引物由Invitrogen公司合成。
1.2.3 pET-22b-BPSS1395表达载体的构建以BPC006株的全基因组DNA为模板,PCR扩增目的基因BPSS1395(870 bp),将BPSS1395片段和pET-22b质粒同时进行BamHⅠ/XhoⅠ双酶切,酶切产物用DNA ligation mix于16 ℃连接4 h,连接产物转化到E.coli BL21(DE3) 感受态细胞,在含氨苄的LB平板上37 ℃过夜培养,挑取阳性单克隆转接于氨苄抗性的LB液体培养基中过夜培养,提取质粒,进行BamHⅠ/XhoⅠ双酶切验证,将双酶切验证正确的质粒进行DNA测序。
1.2.4 重组BPSS1395蛋白的表达阳性重组工程菌于37 ℃培养至D(600) 值为0.6~0.8,加入0.1 mmol/L IPTG于37、25、16 ℃分别诱导3、5、16 h后收集菌体,加入PBS缓冲液重悬菌体,200 W超声裂解15 min,于4 ℃、12 000 r/min离心20 min,分离上清和沉淀,SDS-PAGE检测融合蛋白的表达情况。
1.2.5 包涵体蛋白BPSS1395的复性收集菌体诱导表达后的培养物,6 000 r/min离心5 min。其沉淀用适量的缓冲液A重悬。将漂洗过的菌体悬浮于缓冲液B中,超声破碎,3 000 r/min离心30 min,收集包涵体沉淀。将包涵体沉淀用缓冲液Ⅰ、缓冲液Ⅱ、缓冲液Ⅲ分别超声洗涤1次,1 500 r/min离心30 min收集包涵体沉淀。用含8 mol/L高浓度尿素的缓冲液室温放置30 min,并振荡2 h,然后6 000 r/min离心30 min,留上清。将溶解后的蛋白质适当稀释装进透析袋依次放入到6、4、2 mol/L不同浓度尿素以及PBS溶液中各自透析2 h。最后将透析袋里的溶液12 000 r/min离心2 min,取上清。
1.2.6 多克隆抗体的制备及鉴定400 μg纯化pET-22b-BPSS1395蛋白制品,以等体积弗氏完全佐剂充分乳化后,皮下多点接种于新西兰大白兔,每间隔7 d接种一次,共接种3次,第3次加强免疫14 d后进行心脏取血,分离血清于-80 ℃保存备用。
pET-22b-BPSS1395蛋白作为抗原包被酶标板(0.4 μg/孔),5%的脱脂奶粉封闭,间接ELISA检测抗体效价,倍比稀释抗血清(1:10 000~1:1 280 000),HRP标记的山羊抗兔IgG为二抗,未免疫家兔血清作为阴性对照,检测抗体滴度,结果判断标准:A样品≥2.1A阴性。
将目的蛋白条带转移至聚偏二氟乙烯(PVDF)薄膜上,加入抗血清孵育后,以HRP标记的山羊抗兔IgG抗体检测BPSS1395蛋白与类鼻疽全菌的特异性条带,牛血清白蛋白(BSA)和大肠杆菌分别作为对照。
1.2.7 免疫荧光将爬片放置12孔板中,培养人肺癌上皮细胞A549至密度为70%~80%时,加入5 μL类鼻疽杆菌菌液,共孵4 h。将爬片用2.5%多聚甲醛固定30 min,0.1% Triton X-100透膜5 min,1:200稀释的BPSS1395多克隆抗体孵育1 h,1:500稀释的山羊抗兔FITC二抗避光孵育1 h,1:1 000稀释的DAPI避光孵育10 min。最后用抗荧光淬灭剂封片后,4 ℃湿盒内避光保存,待激光共聚焦镜观察。
1.2.8 蛋白质亚细胞定位37 ℃培养类鼻疽菌4 h,至D(600) 值为0.8~1.0。收集菌液,4 ℃ 12 000 r/min离心15 min,沉淀细菌。分离所得沉淀1置于冰上超声。4 ℃、14 000 r/min离心45 min,收集菌体裂解液。菌体裂解液经4 ℃、20 000 r/min离心1 h,沉淀2为细胞壁组分,收集上清2;上清2再经4 ℃、100 000 r/min离心4 h,沉淀3为细胞膜组分,所得上清3为细胞质组分。Western blot检测其定位。
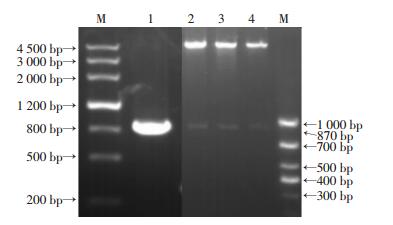
2 结果 2.1 BPSS1395基因的扩增及原核表达载体pET-22b-BPSS1395的构建以BPC006株全基因组DNA为模板,经PCR扩增得到目的基因BPSS1395(870 bp),重组质粒pET-22b-BPSS1395经BamHⅠ/XhoⅠ双酶切鉴定目的片段与理论大小一致(图 1),DNA测序结果与GenBank公布的BPSS1395基因序列一致。
|
| M:标准;1:BPSS1395基因扩增产物;2~4:质粒pET-22b-BPSS1395经BamHⅠ/XhoⅠ双酶切产物 图 1 pET-22b-BPSS1395重组质粒的构建 |
2.2 BPSS1395蛋白的诱导表达
阳性重组子分别在37、25、16 ℃经IPTG诱导3、5、16 h。与未诱导菌相比在相对分子质量为32×103位置均增加了一条蛋白条带,与BPSS1395预期蛋白相对分子质量一致。在37、25、16 ℃条件下目的蛋白表达量分别为41.2%、50.1%和64.2%,且主要为包涵体表达(图 2)。

|
| M:标准;1~4:37 ℃,1:未诱导全菌,2:诱导3 h全菌,3:诱导3 h上清,4:诱导3 h沉淀;5~8:25 ℃,5:未诱导全菌,6:诱导5 h全菌,7:诱导5 h上清,8:诱导5 h沉淀;9~12:16 ℃,9:未诱导全菌, 10:诱导16 h全菌,11:诱导16 h上清,12:诱导16 h沉淀 图 2 SDS-PAGE鉴定重组蛋白的表达及表达形式 |
2.3 重组蛋白的复性
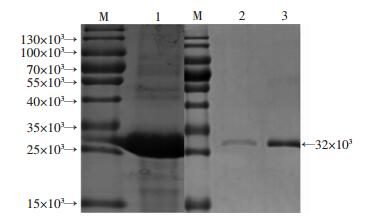
1 L阳性工程菌16 ℃,IPTG诱导16 h,离心获得菌体湿质量为3.1 g,通过超声破菌、离心纯化包涵体BPSS1395,经变性复性,获得了纯度为91.5%的可溶性BPSS1395蛋白(图 3)。
|
| M:标准;1:重组蛋白包涵体;2:变性重组蛋白沉淀;3:复性的可溶重组蛋白 图 3 SDS-PAGE检测包涵体复性 |
2.4 多克隆抗体的制备
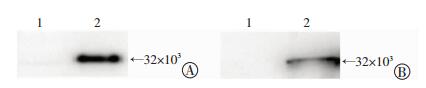
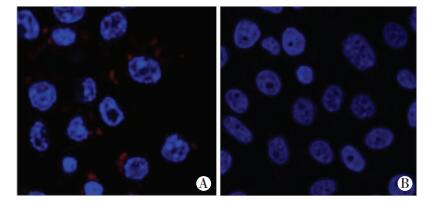
重组蛋白免疫家兔35 d后获得抗血清,ELISA检测该抗体效价达1:1 280 000。以BPSS1395蛋白为抗原制备的抗血清作为一抗,以山羊抗兔IgG作为二抗,对BPSS1395蛋白及类鼻疽全菌进行Western blot分析,在32×103出现特异性印迹条带(图 4)。类鼻疽杆菌结合BPSS1395多克隆抗体后菌体呈现红色荧光,而大肠杆菌结合其多抗没有产生相应的荧光(图 5),由此说明BPSS1395多克隆抗体是针对类鼻疽杆菌的特异性多抗。
|
| 1:BSA,2:BPSS1395 A:BPSS1395蛋白;B:类鼻疽全菌 图 4 多克隆抗体对BPSS1395蛋白和类鼻疽全菌的免疫印迹检测 |
|
| A:BPSS1395 多克隆抗体结合类鼻疽杆菌;B:BPSS1395 多克隆抗体结合大肠杆菌 图 5 BPSS1395多克隆抗体结合不同菌株的免疫荧光检测 (荧光显微镜×400) |
2.5 蛋白质亚细胞定位
分离类鼻疽杆菌亚细胞组分,以兔重组BPSS1395多抗血清进行Western blot分析BPSS13395蛋白在类鼻疽杆菌中的亚细胞分布,结果如图 6。从图中可以看出BPSS1395主要定位于胞质,与生物信息学预测BPSS1395蛋白的亚细胞定位结果一致。
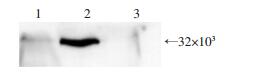
|
| 1:细胞壁;2:细胞质;3:细胞膜 图 6 Western blot检测蛋白质亚细胞定位 |
3 讨论
类鼻疽杆菌由于抵抗力强,致死性强,传播快,可大量培养,是将来可被使用的生物战剂之一。目前类鼻疽杆菌的一些毒力因子已得到确认,包括荚膜多糖、菌毛、脂多糖和Ⅲ型分泌系统、Ⅵ型分泌系统等[12]。大量研究表明类鼻疽杆菌独特致病特点与其编码毒力的分泌转运系统即Ⅲ型分泌系统密切相关。类鼻疽杆菌通过这种多组分蛋白复合体所形成的跨膜通道分泌大量效应蛋白或把这些毒力蛋白直接注入宿主细胞,刺激和干扰宿主细胞的代谢过程,进而引起宿主细胞相应的病理改变[13]。迄今类鼻疽杆菌K96243基因组中已经鉴定出3种T3SS操纵子:T3SS1、T3SS2和T3SS3[10]。有研究报道,T3SS3与沙门菌(Salmonella)和志贺菌(Shigella)Inv/Mxi-Spa分泌系统的致病性类似,有助于细菌在细胞内复制与存活以及引起巨噬细胞死亡[14]。T3SS3相关基因编码蛋白的功能研究目前已比较多,然而对于T3SS1和T3SS2编码的蛋白在整个Ⅲ型分泌系统里发挥的功能以及其是否协同其他分泌系统和毒力因子共同作用于宿主的认识还非常的少[10]。同时,有研究也表明T3SS1和T3SS2能够感染番茄植株,与植物致病菌青枯杆菌(R.solanacearum)的T3SS致病性具有相似性,这表明了类鼻疽杆菌是一个潜在的植物病原[15]。
我们采用生物信息学方法对类鼻疽杆菌基因型研究分析发现特定的BPSS1395具有分泌系统功能。本研究采用pET-22b载体,表达了BPSS1395包涵体蛋白(属于T3SS1),相对分子质量约为32×103,运用变性与复性的方法获得了纯度较高的BPSS1395蛋白,然后通过蛋白质亚细胞定位的识别对其蛋白的功能进行注释。有文献报道类鼻菌杆菌T3SS3中BsaZ和BsaY等定位于细胞内膜,这些蛋白对于分泌系统的构成和效应蛋白的分泌起着重要作用[10]。因此蛋白质必须处于合适的亚细胞位置才能发挥其功能,明确蛋白质亚细胞定位对于了解其功能具有重要意义。BPSS1395蛋白主要存在于胞质中,少量存在于细胞壁上。游离在细胞胞质中的蛋白往往是稳定的,这将影响蛋白质的折叠、聚合及翻译后修饰[16]。BPSS1395合成后通过内膜分泌到细胞质中并没有分泌到细胞外,这符合其为转运和定向元件的推测。总之,本研究利用基因工程技术,在大肠杆菌中高效表达了BPSS1395蛋白,并得到具有生物活性重组蛋白,明确了其在该菌中的定位,为蛋白晶体结构解析、免疫学以及功能研究奠定了扎实的基础。
| [1] | Wiersinga W J, Currie B J, Peacock S J. Melioidosis[J]. N Engl J Med, 2012, 367(11): 1035–1044. DOI:10.1056/NEJMra1204699 |
| [2] |
毛旭虎. 加强类鼻疽的研究[J].
第三军医大学学报, 2011, 33(13): 1315–1317.
Mao X H. Progress on melioidosis[J]. J Third Mil Med Univ, 2011, 33(13): 1315–1317. |
| [3] |
Yunn-HwenGan. 类鼻疽研究进展[J].
第三军医大学学报, 2016, 38(11): 1195–1199.
Yunn-Hwen Gan. Current state of melioidosis research[J]. J Third Mil Med Univ, 2016, 38(11): 1195–1199. DOI:10.16016/j.1000-5404.201603029 |
| [4] |
毛旭虎, 胡治强. 类鼻疽的实验室诊断方法及评价[J].
第三军医大学学报, 2016, 38(11): 1200–1204.
Mao X H, Hu Z Q. Progress of research on laboratory diagnosis of melioidosis[J]. J Third Mil Med Univ, 2016, 38(11): 1200–1204. DOI:10.16016/j.1000-5404.201602028 |
| [5] |
陈杨久齐, 胡春雨, 方瑶, 等. 中国类鼻疽菌的耐药谱调查及耐药机制分析[J].
第三军医大学学报, 2016, 38(11): 1220–1223.
Chen Y J Q, Hu C Y, Fang Y, et al. Drug resistance spectrum of clinical Burkholderia pseudomalleistrains in China and related mechanism[J]. J Third Mil Med Univ, 2016, 38(11): 1220–1223. DOI:10.16016/j.1000-5404.201602030 |
| [6] | Raja N S, Scarsbrook C. Burkholderia Pseudomallei Causing Bone and Joint Infections: A Clinical Update[J]. Infect Dis Ther, 2016, 5(1): 17–29. DOI:10.1007/s40121-015-0098-2 |
| [7] | Fisher D A, Harris P N. Melioidosis: refining management of a tropical time bomb[J]. Lancet, 2014, 383(9919): 762–764. DOI:10.1016/S0140-6736(13)62143-1. |
| [8] | Currie B J. Melioidosis: evolving concepts in epidemiology, pathogenesis, and treatment[J]. Semin Respir Crit Care Med, 2015, 36(1): 111–125. DOI:10.1055/s-0034-1398389. |
| [9] | Currie B J, Kaestli M. Epidemiology: A global picture of melioidosis[J]. Nature, 2016, 529(7586): 290–291. DOI:10.1038/529290a |
| [10] | Sun G W, Gan Y H. Unraveling type Ⅲ secretion systems in the highly versatile Burkholderia pseudomallei[J]. Trends Microbiol, 2010, 18(12): 561–568. DOI:10.1016/j.tim.2010.09.002 |
| [11] | Lipscomb L, Schell M A. Elucidation of the regulon and cis-acting regulatory element of HrpB, the AraC-type regulatorof a plant pathogen-like type Ⅲ secretion system in Burkholderia pseudomallei[J]. J Bacteriol, 2011, 193(8): 1991–2001. DOI:10.1128/JB.01379-10 |
| [12] | Adler N R L, Stevens J M, Stevens M P, et al. Autotransporters and Their Role in the Virulence of Burkholderia pseudomallei and Burkholderia mallei[J]. Front Microbiol, 2011, 2: 151. DOI:10.3389/fmicb.2011.00151 |
| [13] | Kang W T, Vellasamy K M, Vadivelu J. Eukaryotic pathways targeted by the type Ⅲ secretion system effector protein, BipC, involved in the intracellular lifecycle of Burkholderia pseudomallei[J]. Sci Rep, 2016, 6: 33528. DOI:10.1038/srep33528 |
| [14] | Stevens M P, Wood M W, Taylor L A, et al. An Inv/Mxi-Spa-like type Ⅲ protein secretion system in Burkholderia pseudomallei modulates intracellular behaviour of the pathogen[J]. Mol Microbiol, 2002, 46(3): 649–659. DOI:10.1046/j.1365-2958.2002.03190.x |
| [15] | Lee Y H, Chen Y, Ouyang X, et al. Identification of tomato plant as a novel host model for Burkholderia pseudomallei[J]. BMC Microbiol, 2010, 10: 28. DOI:10.1186/1471-2180-10-28 |
| [16] |
贾浩, 张小白, 宋晓峰. 人类胞内蛋白半衰期与其亚细胞定位的相关性研究[J].
计算机与应用化学, 2011, 28(4): 411–414.
Jia H, Zhang X B, Song X F. Relationship between intracelluar protein half-life and subcellular localization in human cells[J]. Computers and Applied Chemistry, 2011, 28(4): 411–414. DOI:10.3969/j.issn.1001-4160.2011.04.007 |



