2. 400016 重庆,重庆医科大学:附属第一医院口腔颌面外科;
3. 400016 重庆,重庆医科大学:药学院药物化学与生物材料研究室
2. Department of Oral and Maxillofacial Surgery, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016;
3. Department of Pharmaceutical Chemistry and Biological Materials, College of Pharmacy, Chongqing Medical University, Chongqing, 400016, China
多西他赛(docetaxel,DTX)通过与游离的微管蛋白结合,促进微管蛋白装配并抑制微管解聚,干扰细胞有丝分裂和分裂间期的微管网络而起到抗肿瘤作用,临床上广泛用于非小细胞肺癌等多种实体瘤的单药或联合化疗[1-3]。目前,市售的DTX为普通注射剂(docetaxel injection,DTX-IN),其辅料中含有较大量的吐温-80,使得该制剂在临床应用时出现严重的过敏反应和水钠潴留。与此同时,由于DTX对各组织器官的选择性差,从而导致全身毒副反应明显,尤其是骨髓抑制已经成为限制DTX剂量提高及疗效发挥的主要因素。为克服DTX-IN的上述不足,本课题组使用固体分散与泡腾组合技术制备了多西他赛脂质体(docetaxel liposome,DTX-LP)[4],并对其组织分布进行研究,发现其能将给药总剂量92%的DTX传递至肺部,呈现出高度的肺靶向性[5-6]。由此,我们设想DTX-LP对于肺原发恶性肿瘤可能呈现独特优势。本研究基于兔VX2原位移植肺癌模型开展DTX-LP的药效学分析,以期阐明DTX-LP对荷瘤兔远期生存的影响,并评价其安全性。
1 材料与方法 1.1 药品及实验器材DTX(重庆美联制药有限公司,批号20121003,注射级),氢化大豆卵磷脂(德国科隆,批号00450,注射级),胆固醇(南京新百药业有限公司,批号20120907,药用级),吐温-80(北京市海淀会友化工公司,批号20110707,注射级),枸橼酸(北京市海淀会友化工公司,批号20100712,注射级),碳酸氢钠(湖南华日制药有限公司,批号20120508,注射级)。
Aeian-200万分之一电子分析天平(瑞士梅特勒-托利多仪器有限公司),KQ5200DA型数控超声清洗器(昆山市超声仪器有限公司),SHB-3循环水多用真空泵(郑州杜甫仪器厂),ZEN3600纳米粒度仪(英国马尔文公司),JEM2010透射电镜(日本日立公司),SW-CJ-2FD型洁净工作台(苏州苏净安泰公司),18G硬膜外穿刺针(上海普益医疗器械有限公司),LightSpeedVCTct99型64层螺旋CT机(美国通用电器公司),XS-800i型血细胞分析仪(日本SYSMEX公司)。
1.2 实验动物普通级新西兰大白兔40只,4~5月龄,体质量2~ 3 kg,雌雄不限,由重庆医科大学实验动物中心提供。动物生产许可证号:SCXY(渝)2007-0001,动物使用许可证号SYXK(渝)2007-0001。VX2荷瘤种兔由重庆医科大学医学超声工程研究所提供。所有实验动物操作程序符合《实验动物管理和使用指南》规定。本研究获得重庆医科大学实验动物伦理委员会的审查批准,批准号:2013年伦审(16) 号。
1.3 DTX-LP及空白脂质体制备采用固体分散及泡腾组合技术制备DTX-LP[4]。简述如下:按照物质的量比0.5:9:32:32:250:143,分别称取DTX、吐温-80、氢化大豆卵磷脂、胆固醇、枸橼酸和碳酸氢钠细粉适量。将碳酸氢钠以外的其他物料投入一圆底反应烧瓶中,加适量无水乙醇,超声水浴下分散为无色澄明液体,然后将反应烧瓶置于60 ℃油浴中,在400 r/min搅拌条件下加入碳酸氢钠细粉,继续搅拌,减压除去乙醇,得到固体粉末。称取固体粉末适量,按照1 g:10 mL比例加入5%碳酸氢钠注射液,振摇溶解即得DTX-LP。同法制备不含DTX的空白脂质体(blank liposome,BLA-LP)。
1.4 DTX-LP的外观、粒径和Zeta电位测定将1.3制备所得的BLA-LP及DTX-LP混悬液用注射用水稀释至10倍,取少量滴于专用铜网上,静置3 min,稍干燥后滴加2%磷钨酸液染色3 min,用滤纸吸取多余染液,自然晾干后置于透射电镜下观察并摄片。另将BLA-LP及DTX-LP混悬液用注射用水稀释至100倍,使用纳米粒度仪测定其粒径和Zeta电位。
1.5 DTX-LP的包封率测定使用透析法测定DTX-LP的包封率[4]。简述如下:精密量取DTX-LP混悬液5.0 mL,置于截留相对分子质量8 000~10 000的透析袋中,于室温下在250 mL生理盐水配制的PBS溶液(pH 7.4) 中透析8 h。透析结束后,将透析袋内溶液转至10 mL容量瓶,精密量取3 mL,置于15 mL离心试管中,加3 mL乙腈,涡旋20 min破乳,用0.22 μm有机滤膜过滤,取滤液20 μL注入高效液相色谱仪,以DTX标准品为对照,按外标法以峰面积计算DTX-LP中DTX的含量W1。同法测定未经透析的DTX-LP原液中DTX的含量W2。按照W1/W2×100%计算包封率。色谱条件:Agilent1100系列高效液相色谱仪及同系列可调波长紫外检测器;色谱柱Phenomenex C18(150 mm×4.6 mm,5 μm);流动相:乙腈-0.03 mol/L酸铵缓冲液(pH 5)=47:53(体积比);流速1.0 mL/min;柱温为室温;紫外检测波长230 nm。
1.6 兔VX2原位移植肺癌模型的建立按照课题组前期研究[7]建立兔VX2原位移植肺癌模型。简述如下:用3%戊巴比妥溶液经耳缘静脉注射麻醉荷VX2种兔,无菌操作摘取肿瘤,将肿瘤切割成体积约1 mm3瘤块,用生理盐水漂洗除去瘤块表面游离的组织细胞,将瘤块前后各用长约0.5 cm的胶原蛋白海绵条夹成“三明治”状填塞入穿刺针管中部,备用。待移植兔用3%戊巴比妥溶液经耳缘静脉注射麻醉后,右胸部脱毛,仰卧固定于手术台上,取备用穿刺针,以兔右胸第4~5肋间肩胛骨前缘为穿刺点作胸腔穿刺,待针尖刺入肺组织后固定穿刺针鞘,以平头针芯推入瘤块后拔针,用无菌纱布压迫穿刺点约30 s后结束手术。
1.7 DTX-LP的药效学研究取1.3项制备的DTX-LP或BLA-LP各适量,用5%碳酸氢钠注射剂水化制成含DTX浓度为0.4 mg/mL的混悬液或空白脂质体混悬液。另取市售DTX-IN(泰索帝),使用其专用溶媒进行溶解,再用0.9%生理盐水稀释制成含DTX浓度为0.4 mg/mL的终溶液作为阳性对照。于VX2肿瘤接种后第10天,所有兔接受胸部CT平扫,选取经CT证实有肺部肿瘤结节生长的荷瘤兔30只,采用分层随机化方法(分层因素为兔肺部肿瘤结节长径,共分3层)将荷瘤兔分为1~5组,每组6只,分别经耳缘静脉给予BLA-LP(作为阴性对照)、DTX-IN(2.7 mg/kg)、DTX-LP高剂量(0.9 mg/kg)、DTX-LP中剂量(0.3 mg/kg)以及DTX-LP低剂量(0.1 mg/kg),每周给药1次,连续给药4周。
在治疗期间,所有实验兔每天定量给予100 g标准饲料,自由饮水。逐日观察,记录实验兔进食、大便情况,并取大便作隐血实验;于第1次给药当天称取动物体质量作为基础体质量,并在动物死亡当天再次称取体质量,按式1计算每组动物的平均体质量变化率。
在每一治疗周期的给药前1 d及给药后第4天,分别经耳缘静脉采血0.5 mL,置一次性真空静脉血样采集容器中,作血细胞计数检查,4个治疗周期结束后,按式2计算白细胞计数累积变化率。
实验兔一旦死亡,记录生存时间,并立即作大体解剖,观察肺部肿瘤及主要脏器生长转移情况,取心、肝、脾、肺、肾,用1%福尔马林液固定,石蜡包埋,HE染色,作组织病理学检查以评估各组治疗对主要脏器的影响。
1.8 统计学分析使用SPSS 17.0统计软件,定量数据以x±s或百分率表示,实验兔生存时间以中位数表示。使用乘积限法(Kaplan-Meier)进行各时间点实验兔生存率估计,并绘制生存曲线,生存曲线比较采用Log-Rank检验。实验兔体质量变化率及白细胞计数累积变化率的组间比较采用秩和检验(Kruskal-Wallis)。检验水准α=0.05。
2 结果 2.1 DTX-LP、BLA-LP的外观、粒径和Zeta电位BLA-LP和DTX-LP在透射电镜下外观圆整,粒径均匀(图 1)。使用纳米粒度仪经激光衍射法测得DTX-LP和BLA-LP的粒径分别为(759±24) nm和(747±19) nm(n=5);Zeta电荷分别为(-33.20±2.79) mV及(-34.40±2.50) mV(n=5)。

|
| 图 1 脂质体透射电镜观察 Fig.1 A:BLA-LP; B:DTX-LP |
2.2 DTX-LP的包封率
DTX-LP的包封率为(90.76±1.36)%(n=5)。
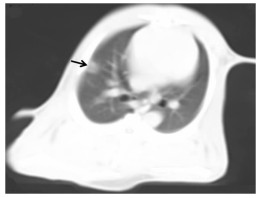
2.3 荷瘤兔肺部CT影像VX2肿瘤移植后第10天,兔接受胸部CT平扫,结果显示荷瘤兔的右肺出现局部肿瘤结节影,结节与正常组织边界清楚,密度均匀,提示建模成功(图 2)。
|
| 箭头示兔右肺肿瘤结节 图 2 荷瘤兔肺部CT影像观察(肺窗) |
2.4 实验兔生存时间
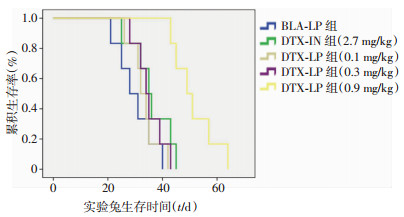
实验兔死亡前1~2 d出现呼吸困难,最终因呼吸衰竭死亡。采集各组兔的生存时间数据,采用Kaplan-Meier法进行生存分析,结果显示BLA-LP组、DTX-IN组及DTX-LP高、中、低剂量组兔的中位生存时间分别为28、35、49、34、32 d(表 1),生存曲线见图 3。各治疗组的生存曲线采用Log-Rank检验进行比较,结果显示DTX-IN组与BLA-LP组的生存率差异不具有统计学意义(P=0.127),DTX-LP高剂量组与BLA-LP组的生存率差异具有统计学意义(P=0.001),且DTX-LP高剂量组与DTX-IN组的生存率差异具有统计学意义(P=0.005)。而DTX-LP中剂量组及低剂量组分别与BLA-LP组比较,生存率差异不具有统计学意义(P=0.298、0.435)。
| 组别 | 中位生存时间(d) | 标准误 | 95%置信区间 |
| BLA-LP组 | 28 | 3.674 | 20.799~35.201 |
| DTX-IN组 | 35 | 2.449 | 30.199~39.801 |
| DTX-LP高剂量组 | 49 | 3.674 | 41.799~56.201 |
| DTX-LP中剂量组 | 34 | 1.837 | 30.399~37.601 |
| DTX-LP低剂量组 | 32 | 1.837 | 28.399~35.601 |
|
| 图 3 各组实验兔生存曲线 |
2.5 各组实验兔的大体解剖情况
实验兔死亡后大体解剖发现各治疗组兔肺与胸壁及邻近组织粘连,以右肺为甚。钝性分离双肺与粘连组织,可见各肺叶遍布米粒至黄豆大小的灰白色、鱼肉样、质地较硬的肿瘤结节。肿瘤结节部分融合成片状,与正常肺组织分界不清,兔肺失去正常形态。肿瘤组织同时侵犯纵隔、心包、胸膜、胸壁及膈肌,伴有胸腔及心包积液,部分实验兔出现肝、肾转移。在中位生存期死亡的实验兔肺标本见图 4。

|
| A: BLA-LP组;B: DTX-IN组;C:DTX-LP高剂量组;D:DTX-LP中剂量组;E:DTX-LP低剂量组;箭头示兔肺上散在的肿瘤结节 图 4 中位生存期死亡的实验兔肺新鲜标本(正面观) |
2.6 实验兔体质量及白细胞计数变化率
截至动物死亡,各组实验兔的体质量较基线均有不同程度的下降,其中BLA-LP组平均体质量下降程度最明显,DTX-LP高剂量组平均体质量下降程度最轻微。4个治疗周期结束后,各组兔的白细胞计数较治疗前均有不同程度的下降,其中DTX-IN组白细胞计数累积下降最明显,BLA-LP组白细胞计数累积下降最轻微,见表 2。Kruskal-Wallis检验结果表明,DTX-LP高剂量组和DTX-IN组的平均体质量变化率与BLA-LP相比,差异具有统计学意义(P=0.004,P=0.037);DTX-LP高剂量组与DTX-IN组相比,差异不具有统计学意义(P=0.063)。DTX-LP高剂量组的动物白细胞计数累积变化率与BLA-LP组相比,差异不具有统计学意义(P=0.200),与DTX-IN组相比,差异具有统计学意义(P=0.004)。
| 组别 | 体质量变化率 | 白细胞计数变化率 |
| BLA-LP组 | -23.03±7.99 | -3.53±18.17 |
| DTX-IN组 | -11.25±9.67b | -52.78±12.50 |
| DTX-LP高剂量组 | -1.48±6.36a | -16.56±10.21c |
| DTX-LP中剂量组 | -2.08±14.39 | -22.19±10.70 |
| DTX-LP低剂量组 | -17.27±18.41 | -15.37±14.14 |
| a: P=0.004,b:P=0.037,与BLA-LP组比较;c:P=0.004,与DTX-IN组比较 | ||
2.7 各治疗组普通不良反应发生率
以动物进食减少至正常量一半以下,且持续2 d以上判定为食欲减退。DTX-IN组和DTX-LP高剂量组食欲减退的发生率分别为83.3%和50.0%,其他各治疗组未观察到食欲减退。以稀便或水样便判定为腹泻,BLA-LP组,DTX-IN组,DTX-LP高、中、低剂量组均观察到腹泻,发生率分别为16.7%、66.7%、33.3%、16.7%、16.7%。以大便隐血阳性判定为肠道出血。DTX-IN组肠道出血发生率为83.3%,其他各治疗组未观察到肠道出血。
2.8 实验兔主要脏器的组织病理检查结果实验兔死亡后,取心、肝、脾、肺、肾作组织病理检查。结果显示DTX-LP高剂量组的心、肝以及脾细胞与BLA-LP组相比无明显异常,仅观察到肺组织的轻微充血、炎症反应以及肾小管的轻微水肿。而DTX-IN组的心、肝、脾、肺、肾均有较明显的损害,包括心肌细胞横纹消失,胞质呈颗粒状,细胞水肿;个别肝细胞脂肪变性,汇管区炎细胞浸润;脾细胞瘀血;肺组织充血、出血以及炎症反应;肾颗粒样变性以及肾小管水肿。见图 5。

|
| 图 5 BLA-LP组、DTX-IN组和DTX-LP 0.9 mg/kg组实验兔各脏器的组织病理观察(×400) |
3 讨论
由于兔拥有自身VX2肿瘤细胞株,其形态学和生物学特佂与人类肿瘤相似,因此被用于多种抗癌药物或治疗方案的药效学以及治疗学研究[8-9]。本研究基于兔VX2原位移植肺癌模型进行DTX-LP的药效学分析,不仅能够为肿瘤组织的局部生长和侵袭转移提供最适宜的体内环境,而且利于更加全面地评价DTX-LP的疗效及其安全性[10],从而可对DTX-LP肺靶向与药效学之间的关系进行深入探讨。
在本研究中,BLA-LP组、DTX-IN组、DTX-LP高剂量组兔的中位生存时间分别为28、35、49 d。生存曲线检验结果显示DTX-LP高剂量组与BLA-LP组的生存率差异具有统计学意义,说明DTX-LP高剂量能延长兔中位生存时间,提高兔生存率。同时,DTX-LP高剂量组与DTX-IN组相比,生存率差异亦具有统计学意义,说明DTX-LP高剂量在使动物生存获益方面优于DTX-IN。DTX-LP中剂量组、DTX-LP低剂量组、DTX-IN组与BLA-LP组相比,尽管表现出延长兔生存时间的趋势,但生存率检验未获得统计学差异,究其原因,DTX-LP中、低剂量组可能是由于DTX剂量设置过低,不足以控制肿瘤生长,而DTX-IN组则可能与其全身毒副反应较重有关。
DTX的主要毒副作用包括骨髓抑制、恶心、呕吐、胃肠道出血、脱发等,且具有剂量依赖性特点[11]。本研究结果显示,在DTX相关的白细胞计数减少、食欲减退、腹泻、肠道出血以及心、肝、脾、肺、肾组织的病理损害方面,DTX-LP高剂量组较DTX-IN组毒副反应发生率低,且毒副反应程度较轻。在维持荷瘤兔体质量方面,DTX-IN组和DTX-LP高、中、低剂量组均能不同程度地减少实验兔体质量下降,而DTX-LP高剂量组的体质量下降程度最轻微。统计分析结果显示,DTX-LP高剂量组与BLA-LP组相比,实验兔体质量下降方面差异具有统计学意义。基于目前共识,维持荷瘤动物的体质量有利于延长其生存,由此我们认为DTX-LP减少实验兔体质量下降也对兔的远期生存做出了贡献。
在本研究中,尽管DTX-LP高剂量组的动物获得了最长的生存时间,但没有动物痊愈,所有动物最终死于呼吸衰竭。大体解剖发现实验兔均出现了双肺、纵隔、心包等邻近组织转移,部分兔还发现了肝、肾转移。究其原因,主要是由于VX2的高侵袭、高转移性的生物学特性[12],加之仅给予荷瘤兔4周期的抗肿瘤治疗,一旦停止治疗,VX2肿瘤即发生在肺部的增殖和远处转移。尽管如此,DTX-LP高剂量组出现肺部肿瘤广泛占位的时间较其他各组推迟,从而使得兔中位生存时间较其他各组延长,生存率得以改善,说明DTX-LP高剂量达到了较好的肺部肿瘤控制效果,这与DTX-LP高度肺靶向性的特点吻合。
本研究表明,在剂量设置为DTX-IN组三分之一的前提下,DTX-LP明显减少动物体质量下降,减轻DTX相关的不良反应,使得VX2肺癌兔中位生存期延长近70%。DTX能诱导肿瘤细胞阻滞于G2~M期,干扰细胞有丝分裂和分裂间期的微管网络,其细胞毒作用依赖于药物对肿瘤细胞的持续抑制。根据目前共识,药物经脂质体包封后可达到缓释长效的作用,加之DTX-LP的肺靶向特性,可保证肺组织局部的DTX浓度较高,而肿瘤暴露于较高的药物浓度,有利于克服肿瘤细胞的多药耐药[13-14]。这些研究结果部分解释了DTX-LP良好的局部抗肿瘤疗效。
文献[15-16]发现,由于细胞膜及线粒体等细胞器表面带有负电荷,致使表面带负电荷的脂质体不易穿透肿瘤生物膜,脂质体所运载的抗肿瘤药物在细胞内分布较少,从而导致其抗肿瘤作用较差。另有研究[17]报道,包封于脂质体疏水夹层或中心水相的抗肿瘤药物对白细胞、有核细胞、骨髓造血干细胞及肠道细胞等表现出不同的毒性,当药物包封于脂质体中心水相时,对上述细胞或组织的毒性更低。在本研究中,DTX-LP的Zeta电荷大约为-30 mV。这与ZHOU等[15-16]的研究结论有所不同,提示DTX-LP的组织或细胞靶向性可能存在其他机制;与此同时,进一步研究DTX-LP中DTX的包封方式,或许有助于深入阐明DTX-LP高效低毒的抗肿瘤作用特点。
总之,本研究结果提示,采用固体分散与泡腾组合技术制备的肺靶向DTX-LP通过将DTX定向传递至荷瘤兔肺部,减少DTX在全身各非靶器官和组织的分布,从而达到提高DTX对肺部肿瘤的治疗作用且减轻其全身毒副作用的目的。这为构建DTX肺靶向脂质体技术平台,推进以脂质体为载体的DTX肺靶向给药系统的研究提供了科学的依据。
| [1] | FULTON B, SPENCER C M. Docetaxel. A review of its pharmacodynamic and pharmacokinetic properties and therapeutic efficacy in the management of metastatic breast cancer[J]. Drugs, 1996, 51(6): 1075–1092. DOI:10.2165/00003495-199651060-00011 |
| [2] | CHU Q, VINCENT M, LOGAN D, et al. Taxanes as first-line therapy for advanced non-small cell lung cancer: a systematic review and practice guideline[J]. Lung Cancer, 2005, 50(3): 355–374. DOI:10.1016/j.lungcan.2005.06.010 |
| [3] | MONTERO A, FOSSELLA F, HORTOBAGYI G, et al. Docetaxel for treatment of solid tumours: a systematic review of clinical data[J]. Lancet Oncol, 2005, 6(4): 229–239. DOI:10.1016/S1470-2045(05)70094-2 |
| [4] | ZHAO L, WEI Y, LI W, et al. Solid dispersion and effervescent techniques used to prepare docetaxel liposomes for lung-targeted deliver system: in vitro and vivo evaluation[J]. J Drug Target, 2011, 19(3): 171–178. DOI:10.3109/10611861003801859 |
| [5] | ZHAO L, WEI Y M, ZHONG X D, et al. PK and tissue distribution of docetaxel in rabbits after i.v administration of liposomal and injectable formulation[J]. J Pharm Biomed Anal, 2009, 49(4): 989–996. DOI:10.1016/j.jpba.2009.01.016 |
| [6] |
刘宇, 邱峰, 吕志祥, 等. 99m锝标记多西他赛脂质体的制备及其在兔体内的组织分布研究[J].
第三军医大学学报, 2016, 38(21): 2303–2308.
LIU Y, QIU F, LYU Z X, et al. Preparation of technetium labeled docetaxel liposome and its distribution in rabbits[J]. J Third Mil Med Univ, 2016, 38(21): 2303–2308. DOI:10.16016/j.1000-5404.201605002 |
| [7] |
刘宇, 兰作平, 张福军, 等. 快速微创建立弥漫型兔VX2肺癌模型及其生物学行为研究[J].
重庆医科大学学报, 2011, 36(9): 1025–1028.
LIU Y, LAN Z P, ZHANG F J, et al. Study on establishment of rabbit vx2 diffuse lung cancer model with minimally invasive surgery and biological behavior of the tumor[J]. J Chongqing Med Univ, 2011, 36(9): 1025–1028. |
| [8] | KIM G M, KIM M D, KIM DO Y, et al. Transarterial chemoembolization using sorafenib in a rabbit vx2 liver tumor model: pharmacokinetics and antitumor effect[J]. J Vasc Interv Radiol, 2016, 27(7): 1086–1092. DOI:10.1016/j.jvir.2016.02.032 |
| [9] | MENG M, GAO J, WU C, et al. Doxorubicin nanobubble for combining ultrasonography and targeted chemotherapy of rabbit with VX2 liver tumor[J]. Tumour Biol, 2016, 37(7): 8673–8680. DOI:10.1007/s13277-015-4525-5 |
| [10] | KONDO K, FUJINO H, MIYOSHI T, et al. Orthotopically implanted SCID mouse model of human lung cancer suitable for investigating metastatic potential and anticancer drug effects[J]. Oncol Rep, 2004, 12(5): 991–999. |
| [11] | BISSERY M C, NOHYNEK G, SANDERINK G J, et al. Docetaxel (Taxotere): a review of preclinical and clinical experience. Part Ⅰ: preclinical experience[J]. AntiCancer Drugs, 1995, 6(3): 339–368, 339-355, 363-368. DOI:10.1097/00001813-199506000-00001 |
| [12] | KIDD J G, ROUS P. Cancer deriving from the virus papillomas of wild rabbits under natural conditions[J]. J Exp Med, 1940, 71(4): 469–494. DOI:10.1084/jem.71.4.469 |
| [13] | BAGULEY B C. Multidrug Resistance in Cancer[J]. Methods Mol Biol, 2010, 596: 1–14. DOI:10.1007/978-1-60761-416-6_1 |
| [14] | SZAKáCS G, PATERSON J K, LUDWIG J A, et al. Targeting multidrug resistance in cancer[J]. Nat Rev Drug Discov, 2006, 5(3): 219–234. DOI:10.1038/nrd1984 |
| [15] | ZHOU J, ZHAO W Y, MA X, et al. The anticancer efficacy of paclitaxel liposomes modified with mitochondrial targeting conjugate in resistant lung cancer[J]. Biomaterials, 2013, 34(14): 3626–3638. DOI:10.1016/j.biomaterials.2013.01.078 |
| [16] | LI X T, ZHOU Z Y, JIANG Y, et al. PEGylated VRB plus quinacrine cationic liposomes for treating non-small cell lung cancer[J]. J Drug Target, 2015, 23(3): 232–243. DOI:10.3109/1061186x.2014.979829 |
| [17] | RAHMAN Y E, HANSON W R, BHARUCHA J, et al. Mechanisms of reduction of antitumor drug toxicity by liposome encapsulation[J]. Ann N Y Acad Sci, 1978, 308: 325–342. DOI:10.1111/j.1749-6632.1978.tb22033.x |




