创伤性脑损伤(traumatic brain injury,TBI)是一类具有高致残率、致死率的疾病,给家庭和社会带来极大的经济负担,但其目前尚无特效的治疗方法[1]。近年来随着研究的不断深入,相关研究报道表明TBI后内皮细胞结构和功能的改变,能够刺激血管和神经再生,促进神经功能修复[2]。LEI等[3]研究发现TBI后大鼠脑组织中miRNA-9的表达有明显改变,提示miRNA-9在TBI进程中发挥重要作用。但miRNA-9是否参与大鼠颅脑创伤后脑血管重塑的进程,并因此影响创伤性脑损伤的预后?本研究观察大鼠TBI后miRNA-9的表达变化,并探讨其对依托泊苷诱导的内皮细胞损伤的保护作用。
1 材料与方法 1.1 实验动物与分组健康清洁级雄性SD大鼠70只,2月龄,体质量(240±15) g,由重庆医科大学实验动物中心提供,按随机数字表法分为7组:伤后6 h, 1、3、7、14、28 d组以及正常组,每组10只。
1.2 细胞培养与主要试剂原代大鼠脑微血管内皮细胞(本课题组培养);依托泊苷(etoposide,ETO)购自上海源叶生物有限公司,用DMSO(购自Solarbio公司)配置成终浓度1 mmol/L,4 ℃保存;DMEM/F12培养基购自HyClone公司;胎牛血清购自德国Capricorn公司;CCK-8试剂盒购自重庆博培生物技术有限公司;TRIzol试剂盒购自大连宝生物工程有限公司;逆转录试剂盒购自大连宝生物工程有限公司;抗活化半胱氨酸天冬氨酸特异性蛋白酶-3蛋白(cleaved cysteinyl aspartate specific proteinase 3,cl-caspase-3) 购自武汉博士德生物技术有限公司;抗GAPDH购自武汉三鹰生物技术有限公司;抗B细胞淋巴瘤/白血病-2蛋白(B-cell lymphoma-2,Bcl-2) 和抗B细胞淋巴瘤/白血病-2相关X蛋白(Bcl-2 associated X,Bax)购自苏州睿瀛生物技术有限公司;抗CD31购自美国Abcam公司;IP及Western裂解液、二抗HRP购自武汉博士德生物技术有限公司;二抗山羊抗兔488购自武汉三鹰生物技术有限公司;miRNA引物、miRNA mimics试剂、FECTTM CP转染试剂购自广州锐博生物科技有限公司。
1.3 方法 1.3.1 建立大鼠控制性皮质撞击损伤模型(controlled cortical impact,CCI)使用3.5%水合氯醛以10 μL/g腹腔注射麻醉大鼠。麻醉后在大鼠前、后囟门间开7 mm×7 mm的骨窗。颅脑损伤仪设置固定参数(深度2.5 mm,撞击速度3.5 m/s,停留时间500 ms,撞击头直径5 mm)后对大鼠右顶叶进行垂直撞击。伤后使用骨蜡覆盖创口,缝合皮肤[4]。
1.3.2 原代内皮细胞培养取2只新生7 d的SD大鼠幼鼠,消毒幼鼠皮肤,无菌条件下断头取脑,分离脑膜并收集脑皮质于预冷的DMEM/F12培养液中。将分离的脑皮质用预冷的PBS液清洗3次后,剪成1 mm3左右大小。加入4 mL质量分数为0.1%的Ⅱ型胶原酶,悬浮混匀后用3.5 mL巴氏管吹打30次;37 ℃细胞孵箱消化30 min后,加入质量分数为0.1%的胶原酶/分散酶共同消化30 min;然后收集悬液在4 ℃、800×g条件下离心5 min。弃上清液,加入适量的DMEM/F12培养液吹打混匀后通过200目筛网,收集滤液后4 ℃,1 000×g离心10 min,离心后取靠近试管底部红色沉淀的黄白色部分,即得到纯度较高的微血管段。用适量含15%胎牛血清的DMEM/F12重悬后接种于涂有鼠尾胶的T25培养瓶中,置于37 ℃、5% CO2细胞培养箱内培养,6 h后更换培养液,随后每天更换1次培养液[5]。
1.3.3 细胞鉴定从6孔板中取出载有内皮细胞的玻片,PBS轻柔清洗3遍,室温下用4%多聚甲醛固定30 min,PBS清洗3遍后,加入0.1% Triton X-100破膜10 min。37 ℃恒温箱内山羊血清封闭30 min。不冲洗,5% BSA稀释一抗( 1:1 000稀释)血小板-内皮细胞粘附分子(CD31),滴加至玻片表面,4 ℃孵育过夜。PBS稀释山羊抗兔488荧光二抗,37 ℃水浴箱中避光孵育1 h,PBS洗去多余二抗,DAPI染色5 min,PBS冲洗3遍,50%甘油封片[6]。用荧光显微镜观察并拍照。
1.3.4 细胞转染将细胞以1×105/mL接种于6孔板,分别分为正常组、损伤模型组、miRNA-9过表达损伤模型组、空转染损伤模型组。37 ℃、5% CO2条件下用含15% FBS的DMEM/F12培养液连续培养,待细胞密度达80%时,miRNA-9过表达损伤模型组、空转染损伤模型组按FECTTM CP说明书转染步骤分别转染终浓度为50 nmol/L的miRNA-9合成物和miRNA-9阴性对照,48 h后收集细胞进行miRNA和相关蛋白抽提。
1.3.5 细胞活力检测使用CCK-8检测细胞活力,细胞以3 000/孔种植于96孔板,待细胞密度达80%时,除正常组外分别更换含终浓度1、5、10、50、100、200 μmol/L依托泊苷的培养液,培养24 h后,各组分别加入10 μL CCK-8溶液,于37 ℃孵箱培养2 h后用酶标仪测定在450 nm处的光密度值[D(450)];选择细胞活力下降最明显的依托泊苷浓度作为TBI体外细胞模型内皮细胞的预处理浓度。细胞分组及转染后,按照选定依托泊苷浓度处理细胞24 h后,使用CCK-8测量细胞活力,每组设5个复孔[7]。
1.3.6 组织总RNA提取取正常组及伤后6 h, 1、3、7、14、28 d各时间点伤灶周围5 mm组织,各加入1 mL TRIzol,低温超声5 min后将组织裂解液转入无RNA酶的EP管,室温放置5 min后加入0.2 mL氯仿,剧烈振荡后放置5 min,12 000×g、4 ℃离心15 min。取上层水相置于新的EP管中,加入等体积的异丙醇,室温放置10 min后,12 000×g、4 ℃离心10 min。弃上清,将沉淀用1 mL预冷的75%乙醇洗涤2次,自然干燥后用去RNA酶水溶解RNA沉淀。使用Thermo-fisher公司核酸测量仪Nanodrop测定所提各组RNA浓度。细胞总RNA提取方法及步骤同组织提取方法。
1.3.7 逆转录及荧光定量PCR(qPCR)逆转录参照逆转录试剂盒配置20 μL反应体系:miRNA模板1.6 μg,RT引物工作液1.6 μL,70 ℃放置10 min,冰育2 min;再加入RT buffer 4 μL,Mix(2.5 nmol/L)1 μL,去RNA酶水补足至20 μL,进行逆转录反应,37 ℃ 15 min,85 ℃ 5 s。qPCR反应体系为20 μL:SYBR Premix Ex TaqⅡ 10 μL,上、下游引物(10 μmol/L)各0.8 μL,模板cDNA 2 μL,dH2O 6 μL,Rox Reference Dye 0.4 μL。miRNA反应条件:预变性,95 ℃,20 s,PCR反应,40个循环,95 ℃,10 s;60 ℃,30 s;延伸,70 ℃,10 s。
1.3.8 Western blot检测CD31、Bcl-2、Bax、cl-caspase-3表达变化组织总蛋白提取及表达检测:取正常组及伤后6 h,1、3、7、14、28 d各时间点伤灶周围5 mm组织,各加入1 mL IP及Western blot裂解液,低温超声5 min后,12 000 r/min离心5 min,取上清用BCA法测定蛋白浓度,蛋白定量后,将上样蛋白配置为每孔100 μg。各组行SDS-PAGE凝胶电泳分离、转膜、5%脱脂牛奶封闭后,加入一抗抗体,抗CD31和抗GAPDH( 1:1 000稀释),4 ℃孵育12 h后加入HRP标记的山羊抗兔二抗抗体,37 ℃孵育2 h,洗涤3次后,使用Fusion成像软件行化学显影、拍照、统计。
细胞总蛋白提取及表达检测:除加入一抗抗体分为抗Bcl-2、抗Bax、抗cl-caspase-3外(均 1:500稀释),其余步骤同前述。
1.4 统计学处理采用SPSS 19.0统计软件对获得的数据进行处理,计量资料数据以x±s表示。不同时间点伤灶周围组织miRNA-9、CD31蛋白表达量及内皮细胞各分组qPCR、CCK-8、Western blot检测结果均采用单因素方差分析进行统计,组间两两比较采用LSD-t检验。检验水准α=0.05。
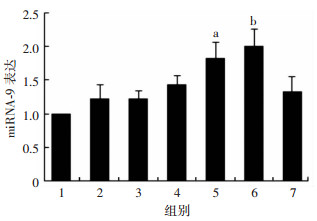
2 结果 2.1 qPCR检测TBI后各时间点伤灶周围组织miRNA-9的表达变化与正常组相比,建立CCI模型后7、14 d伤灶周围组织中miRNA-9的表达明显升高(P<0.05,P<0.01,图 1)。
|
|
a:P<0.05,b:P<0.01, 与正常组比较 1:正常组;2:伤后6 h组;3:伤后1 d组;4:伤后3 d组;5:伤后7 d组;6:伤后14 d组;7:伤后28 d组 图 1 qPCR检测FBI后各时间点伤灶周围脑组织中miRNA-9的表达变化 |
2.2 Western blot检测TBI后各时间点CD31的表达变化
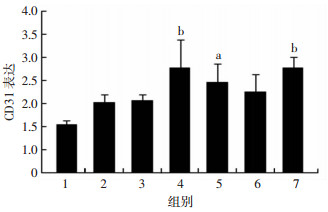
与正常组相比,建立CCI模型后3、7、28 d伤灶周围组织中CD31的表达明显升高(P<0.05,P<0.01,图 2)。
|
|
a:P<0.05,b:P<0.01,与正常组比较 1:正常组;2:伤后6 h组;3:伤后1 d组;4:伤后3 d组;5:伤后7 d组;6:伤后14 d组;7:伤后28 d组 图 2 Western blot检测TBI后各时间点伤灶周围脑组织中CD31的表达变化 |
2.3 内皮细胞鉴定
用内皮细胞标志性蛋白CD31的抗体作为一抗,Alexa488标记抗体作为二抗,在荧光显微镜下观察,由图 3可见内皮细胞被染成绿色,同时用DAPI染细胞核。观察同一视角下内皮细胞与细胞核的叠加率,切换多个视野进行观察和计数,证实本实验培养出的大鼠皮质原代脑微血管内皮细胞纯度在95%以上。

|
| A: DAPI; B: CD31; C:合并 图 3 CD31相关抗原免疫荧光鉴定(IF ×160) |
2.4 体外TBI模型建立
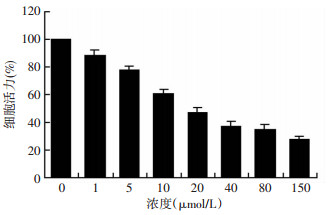
应用CCK-8检测不同浓度依托泊苷(1、5、10、20、40、80、150 μmol/L)刺激内皮细胞24 h后的细胞活力情况,结果显示,依托泊苷浓度为20 μmol/L时细胞活力降低超过50%(图 4)。因此,本研究选用依托泊苷浓度20 μmol/L,刺激时间24 h作为细胞造模参数。
|
| 图 4 依托泊苷浓度对内皮细胞活力的影响 |
2.5 细胞建立模型后qPCR检测miRNA-9表达变化及CCK-8检测细胞活力
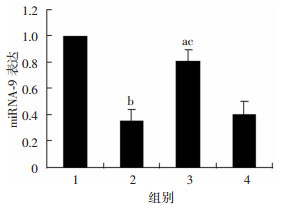
建立凋亡模型24 h后,与正常组相比,损伤模型组细胞miRNA-9的表达显著降低(P<0.01),miRNA-9过表达损伤模型组miRNA-9表达略有降低(P<0.05);但miRNA-9过表达损伤模型组与损伤模型组相比,miRNA-9表达明显增加(P<0.05,图 5)。
|
|
a:P<0.05,b:P<0.01,与正常组比较;c:P<0.05,与损伤模型组比较 1:正常组;2:损伤模型组;3:miRNA-9过表达损伤模型组;4:空转染损伤模型组 图 5 PCR检测建模转染后4组细胞miRNA-9表达 |
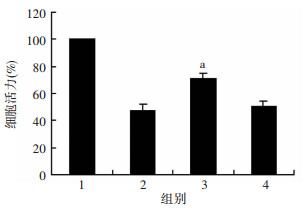
转染造模24 h后,CCK-8检测显示过表达miRNA-9损伤模型组细胞活力较损伤模型组细胞活力明显提高(P<0.05, 图 6)。
|
|
a:P<0.05,与损伤模型组比较 1:正常组;2:损伤模型组;3:miRNA-9过表达损伤模型组;4:空转染损伤模型组 图 6 CCK-8检测建模转染后4组细胞活力 |
2.6 Western blot检测Bcl-2、Bax、cl-caspase-3表达
如图 7所示,损伤模型组、空转染损伤模型组、miRNA-9过表达损伤模型组与正常组相比,Bcl-2蛋白表达明显降低(P<0.01);但miRNA-9过表达损伤模型组Bcl-2蛋白表达水平较损伤模型组明显升高(P<0.01);正常组Bax蛋白表达水平明显低于损伤模型组(P<0.01)、空转染损伤模型组(P<0.05),但miRNA-9过表达损伤模型组Bax蛋白表达水平较损伤模型组明显降低(P<0.05),与正常组相比差异无统计学意义(P>0.05);损伤模型组、空转染损伤模型组、miRNA-9过表达损伤模型组与正常组相比,Bcl-2/Bax值明显降低(P<0.01),但miRNA-9过表达损伤模型组Bcl-2/Bax值高于损伤模型组(P<0.05);正常组cl-caspase-3蛋白表达水平低于损伤模型组(P<0.01)、空转染损伤模型组(P<0.05),但miRNA-9过表达损伤模型组cl-caspase-3蛋白表达水平较损伤模型组明显降低(P<0.05),与正常组相比差异无统计学意义(P>0.05)。

|
|
1:正常组;2:损伤模型组;3:空转染损伤模型组;4:miRNA-9过表达损伤模型组; a:P<0.05,b:P<0.01,与正常组比较;c:P<0.05,d:P<0.01,与损伤模型组比较 A:Western blot检测;B~E:分别为Bcl-2、Bax、Bcl-2/Bax、活化caspase-3半定量分析结果 图 7 Western blot检测各组Bcl-2、Bax、活化caspase-3表达 |
3 讨论
目前为止,由于TBI后各种病理损伤和修复机制错综复杂,导致其临床治疗仍未取得满意的效果[8]。近年来越来越多研究证实在TBI恢复期,血管内皮细胞可以发生结构和功能的改变,刺激血管和神经再生,促进预后神经功能的恢复。GUO等[9]在TBI后1 d观察到伤灶周围有血管内皮前体细胞(endothelial progenitor cell, EPC)出现,在伤后3 d观察到伤灶周围出现呈血管管腔样排列的EPC。MADEDDU[10]通过将EPC移植到伤灶组织内来促进脑损伤后神经功能恢复。HUANG等[11]通过将内皮祖细胞移植到伤灶组织内,增强伤后血管新生,促进颅脑创伤后脑功能重塑和后续的神经功能恢复。因此,维持伤后内皮细胞正常生理状态对神经功能的恢复至关重要。Bcl-2为抗凋亡因子,其通过维持线粒体外膜的构造完整性,阻止线粒体内Cytc、Smac、AIF等因子向细胞浆释放,从而抑制线粒体凋亡途径的启动[12], 抑制细胞凋亡。Bax为凋亡因子,活化的Bax裂解为多种特定的天冬氨酸蛋白片段。这些蛋白水解片段可促成DNA的裂解和细胞核形态学的改变,从而启动细胞凋亡[13-15]。Bax还可与自身结合形成Bax-Bax同源二聚体,是线粒体膜通道的成分之一,其可改变线粒体膜的通透性,调节Cytc、Smac、AIF等的释放,从而诱发Caspase相关的凋亡反应[16]。Bcl-2能与Bax竞争性结合,形成Bcl-2-Bax异源二聚体,抑制Bax活化,关闭线粒体膜离子通道,抑制凋亡[17]。
microRNA是一类小的非编码RNA,由20~26个核苷酸组成,通过与靶基因mRNA3’-UTR区碱基配对,降解mRNA或阻碍其翻译。miRNA-9作为神经元生成过程中关键的调控因子在大脑的发生、发育过程中发挥重要作用。有研究报道miRNA-9能够促进骨髓间充质干细胞定向分化为神经元细胞[18]。在内皮细胞研究方面,CUI等[19]的研究结果表明miRNA-9可以通过降低NRP1的表达抑制三氧化二砷诱导的人脐静脉内皮细胞株的迁移和管腔形成,从而影响血管新生, 但另有研究报道miRNA-9抑制NF-κB等炎症因子的表达且可以促进淋巴管内皮细胞的增殖和成管能力[20]。
由此我们可知,miRNA-9在不同疾病模型下对内皮细胞增殖及成管能力等影响不尽相同,且国内外尚少见针对miRNA-9在TBI方面的研究报道。因此我们提出假设,TBI后miRNA-9可以通过提高内皮细胞活力,促进伤灶区域血管重塑,促进神经功能恢复。本研究通过检测伤后不同时间点伤灶脑组织中miRNA-9和内皮细胞标志物CD31蛋白的表达变化,发现两者表达变化趋势相同。通过提取原代脑微血管内皮细胞,构建体外TBI细胞模型,过表达miRNA-9并检测细胞活性及相关凋亡蛋白Bcl-2、Bax、cl-caspase-3的表达情况,免疫沉淀结果显示过表达miRNA-9后细胞内Bcl-2明显增加,Bax减少,Bcl-2/Bax值增加,cl-caspase-3表达减少;CCK-8结果显示过表达miRNA-9后细胞活力升高。以上结果表明TBI后伤灶区域miRNA-9表达增多且过表达miRNA-9可以提高依托泊苷诱导损伤的内皮细胞活力,提示TBI后miRNA-9表达增加有助于脑血管重塑的发生,为miRNA-9有望成为TBI新的治疗靶点提供了依据。
| [1] | GHAJAR J. Traumatic brain injury[J]. Lancet, 2000, 356(9233): 923–929. DOI:10.1016/S0140-6736(00)02689-1 |
| [2] | CHOPP M, LI Y, ZHANG J. Plasticity and remodeling of brain[J]. J Neurol Sci, 2008, 265(1-2): 97–101. DOI:10.1016/j.jns.2007.06.013 |
| [3] | LEI P, LI Y, CHEN X, et al. Microarray based analysis of microRNA expression in rat cerebral cortex after traumatic brain injury[J]. Brain Res, 2009, 1284: 191–201. DOI:10.1016/j.brainres.2009.05.074 |
| [4] | CAO F, JIANG Y, WU Y, et al. Apolipoprotein E-mimetic COG1410 reduces acute asogenic edema following traumatic brain injury[J]. J Neurotrauma, 2016, 33(2): 175–182. DOI:10.1089/neu.2015.3887 |
| [5] |
查雨锋, 张顺, 苏航, 等. 一种高纯度和高活力的大鼠脑微血管内皮细胞的提取及原代培养方法[J].
中国药理学通报, 2014, 30(11): 1616–1619.
ZHA Y F, ZHANG S, S H, et al. A highly purified and actie extract and primitie culture method for rat microascular endothelial cells[J]. Chin Pharmacol Bull, 2014, 30(11): 1616–1619. DOI:10.3969/j.issn.1001-1978.2014.11.027 |
| [6] |
张洪荣, 程崇杰, 蒋理, 等. ApoE亚型蛋白对神经元轴突生长的影响[J].
第三军医大学学报, 2014, 36(15): 1562–1566.
ZHANG H R, CHENG C J, JIANG L, et al. Effect of ApoE isoforms on growth of neuronal axons in mice[J]. J Third Mili Med Uni, 2014, 36(15): 1562–1566. DOI:10.16016/j.1000-5404.2014.15.025 |
| [7] |
李宁, 万文婷, 金林红. CCK-8法和MTT法检测人前列腺癌PC3细胞活性的最佳条件比较研究[J].
贵州大学学报:自然科学版, 2009, 26(3): 18–20, 24.
LI N, WAN W T, JIN L H. Optimal experiment conditions of comparison between CCK-8 and MTT in cell proliferation assays on pc3 cells[J]. J Guizhou Uni(Nat Sci), 2009, 26(3): 18–20, 24. DOI:10.3969/j.issn.1000-5269.2009.03.006 |
| [8] | RISDALL J E, MENON D K. Traumatic brain injury[J]. Philos Trans R SocLond, B, Biol Sci, 2011, 366(1562): 241–250. DOI:10.1098/rstb.2010.0230 |
| [9] | GUO X, LIU L, ZHANG M, et al. Correlation of CD34+ cells with tissue angiogenesis after traumatic brain injury in a rat model[J]. J Neurotrauma, 2009, 26(8): 1337–1344. DOI:10.1089/neu.2008.0733 |
| [10] | MADEDDU P. Therapeutic angiogenesis and asculogenesis for tissue regeneration[J]. Exp Physiol, 2005, 90(3): 315–326. DOI:10.1113/expphysiol.2004.028571 |
| [11] | HUANG X T, ZHANG Y Q, LI S J, et al. Intracerebro entricular transplantation of ex io expanded endothelial colony-forming cells restores blood-brain barrier integrity and promotes angiogenesis of mice with traumatic brain injury[J]. J Neurotrauma, 2013, 30(24): 2080–2088. DOI:10.1089/neu.2013.2996 |
| [12] | ROY M J, VOM A, CZABOTAR P E, et al. Cell death and the mitochondria: therapeutic targeting of the BCL-2 family-drien pathway[J]. Br J Pharmacol, 2014, 171(8): 1973–1987. DOI:10.1111/bph.12431 |
| [13] | POLSTER B M, FISKUM G. Mitochondrial mechanisms of neural cell apoptosis[J]. J Neurochem, 2004, 90(6): 1281–1289. DOI:10.1111/j.1471-4159.2004.02572.x |
| [14] | LIU J, LI J, YANG Y, et al. Neuronal apoptosis in cerebral ischemia/reperfusion area following electrical stimulation of fastigial nucleus[J]. Neural Regen Res, 2014, 9(7): 727–734. DOI:10.4103/1673-5374.131577 |
| [15] | KOWALTOWSKI A J, FISKUM G. Redox mechanisms of cytoprotection by Bcl-2[J]. Antioxid Redox Signal, 2005, 7(3-4): 508–514. DOI:10.1089/ars.2005.7.508 |
| [16] | NESS J M, HARVEY C A, STRASSER A, et al. Selectie inolement of BH3-only Bcl-2 family members Bim and Bad in neonatal hypoxia-ischemia[J]. Brain Res, 2006, 1099(1): 150–159. DOI:10.1016/j.brainres.2006.04.132 |
| [17] | WANG H Q. Interaction of presenilins with FKBP38 promotes apoptosis by reducing mitochondrial Bcl-2[J]. Human Molecular Genetics, 2005, 14(13): 1889–1902. DOI:10.1093/hmg/ddi195 |
| [18] | HAN R, KAN Q, SUN Y, et al. MiR-9 promotes the neural differentiation of mouse bone marrow mesenchymal stem cells ia targeting zinc finger protein 521[J]. Neurosci Lett, 2012, 515(2): 147–152. DOI:10.1016/j.neulet.2012.03.032 |
| [19] | CUI Y, HAN Z, HU Y, et al. MicroRNA-181b and microRNA-9 mediate arsenic-induced angiogenesis ia NRP1[J]. J Cell Physiol, 2012, 227(2): 772–783. DOI:10.1002/jcp.22789 |
| [20] | CHAKRABORTY S, ZAWIEJA D C, DAVIS M J, et al. MicroRNA signature of inflamed lymphatic endothelium and role of miR-9 in lymphangiogenesis and inflammation[J]. Am J Physiol, Cell Physiol, 2015, 309(10): C680–C692. DOI:10.1152/ajpcell.00122.2015 |



