孟鲁司特钠 (montelukast sodium) 是一种强效的选择性半胱氨酰白三烯受体-1(CysLT1) 受体拮抗剂,能够竞争性抑制白三烯D4(LTD4) 与CysLT1的相互作用,避免炎症介质发挥功效,抑制气道高反应并减轻平滑肌收缩和呼吸道水肿从而改善肺功能[1],临床用于成人和儿童哮喘的预防和长期治疗。目前孟鲁司特钠的口服颗粒剂和咀嚼片广泛用于儿童,颗粒剂适于用6个月以上婴幼儿,咀嚼片适用于2岁以上儿童,但儿童吞咽及咀嚼不便,且用药顺应性差,口服后血浆浓度达峰时间为3 h,为迅速发挥药效,有必要研究其他给药剂型。
直肠是重要的给药途经与给药部位,尤其适合于婴幼儿及不能吞咽的患者用药。在正常情况下直肠内部是空的,药物吸收较少受到其他肠道内容物影响;药物吸收后经直肠中静脉、下静脉及髂内静脉直接进入体循环,减少了肝脏首过效应;另外给药部位即是药物吸收部位,因此用药后起效快,与静脉给药相当;但因其褶皱少,无绒毛,吸收面积小,且上皮细胞连接较小肠紧密从而减少了药物吸收。直肠吸收促进剂是提高药物直肠吸收的重要手段,通过改变直肠黏膜结构、与直肠黏膜细胞中Ca2+结合、使黏膜中磷脂和胆固醇释放等方式增强药物在直肠内的吸收速度与程度[2-4]。而孟鲁司特钠此前并无经直肠给药及相关吸收促进剂对其作用的研究报道,本研究采用家兔直肠给药方式,并以静脉给药为对照,对孟鲁司特钠经家兔直肠的吸收特性以及不同吸收促进剂 (吐温-80、癸酸钠、月桂氮卓酮、胆酸钠、月桂酸钠、L-精氨酸、EDTA-2Na和盐酸氯丙嗪等) 对孟鲁司特钠经直肠吸收的影响进行考察,为孟鲁司特钠直肠给药剂型研究提供生物药剂学依据。
1 材料与方法 1.1 试药孟鲁司特钠 (瀚香生物科技,纯度>98%),孟鲁司特钠对照品 (上海历鼎生物技术有限公司),吐温-80(国药集团化学试剂有限公司,分析纯),月桂氮卓酮 (芮城县兴庆化工厂,分析纯),癸酸钠 (上海生物工程有限公司,分析纯),月桂酸钠 (上海生物工程有限公司,分析纯),胆酸钠 (上海生物工程有限公司,分析纯),L-精氨酸 (第二军医大学药学系药物研究室),EDTA-2Na (重庆川东化工有限公司,分析纯),盐酸氯丙嗪 (东港市宏达制药有限公司,含量99.9%),乙腈 (DIMA TECHNOLOGY INC,USA,色谱纯),甲醇 (DIMA TECHNOLOGY INC,USA,色谱纯)。
1.2 仪器Agilent 1200 Series液相色谱仪及其荧光检测器;高速离心机 (美国Abbott公司),BT 124S电子分析天平 (Sartorius)。
1.3 实验动物体质量2.0~2.5 kg的健康成年家兔36只,雌雄各半,许可证号:SYXK (渝)2012-0002,由第三军医大学实验动物中心提供。
1.4 方法 1.4.1 溶液的配制 1.4.1.1 空白血浆家兔于采血前禁食12 h,取不同家兔耳缘静脉血,离心,收集血浆冷冻待用。
1.4.1.2 孟鲁司特钠灌肠用溶液及静注给药溶液配制称取1 g孟鲁司特钠及适量促进剂溶于25 mL超纯水中混匀,灌肠时注射器取5 mL (即含200 mg孟鲁司特钠) 直肠给药。另取适量孟鲁司特钠溶于适量的0.9%氯化钠注射液中作为静注给药的对照溶液。
1.4.1.3 孟鲁司特钠对照品溶液精密称取孟鲁司特钠对照品1.00 mg,置于1 mL的棕色容量瓶中,用甲醇溶解稀释至刻度,混匀即可。
1.4.2 色谱条件[5]色谱柱:Diamonsil C18(2) 200 mm×4.6 mm,5 μm;柱温:35 ℃;流动相:0.02%三乙胺溶液 (pH=7.21)-乙腈 (45 :55);流速:1.4 mL/min;荧光检测波长:λex=350 nm,λem=450 nm;进样量:10 μL。
1.4.3 血浆样品处理取待测血浆0.3 mL,加入乙腈0.6 mL,振荡混匀3 min,离心5 min (13 000 r/min),取上清液10 μL,进HPLC[6]测定。
1.4.4 专属性在1.4.2色谱条件下进样。
1.4.5 标准曲线精密量取孟鲁司特钠对照品溶液适量,加入空白血浆稀释成10、5、2、1、0.5、0.2、0.1 μg/mL系列浓度标准血浆样品,按1.4.3方式处理。以孟鲁司特钠峰面积 (y) 对浓度 (x) 进行线性回归,得到回归方程y=24.215 73x-3.416 60e-2, r=0.999 95, 线性范围为0.1~10 μg/mL。
1.4.6 精密度和方法回收率实验按1.4.5方式处理,制备最低定量限、低、中、高 (0.1、0.2、1、8 μg/mL) 4种浓度的标准血浆样品,按1.4.3方式处理进样,各浓度日内重复制备测定5次,并连续3 d制样测定,计算日内、日间精密度和方法回收率。
1.4.7 稀释效应精密称取100 mg孟鲁司特钠于10 mL容量瓶中,空白血浆溶解并稀释至5 μg/mL。取该孟鲁司特钠血浆样品,按1.4.3方式处理,平行测定5次,得到稀释效应相对标准差 (RSD) 为4.03%,表明该方法可适用于高浓度孟鲁司特钠血样的分析。
1.4.8 样品稳定性实验将标准血浆样品在-70 ℃冰箱冻存2周,室温放置4 h,血浆-70 ℃室温反复冻融2次及血浆样品经处理后在室温 (10 ℃) 放置24 h, 测定浓度。
1.4.9 样品的采集家兔于实验前12 h禁食不禁水,于固定盒固定稳固。① 用含200 mg孟鲁司特钠的灌肠液从肛门插入直肠进行给药[7],吸收促进剂组各选择3个浓度,每个浓度取3只家兔平行测定。于给药前 (0 h) 和给药后的0.17、0.33、0.50、1.00、2.00、3.00、5.00、7.00 h从耳缘静脉取血2 mL。② 用含200 mg孟鲁司特钠的静注液从耳缘静脉进行给药,同法取血。③ EDTA-2Na、盐酸氯丙嗪因和孟鲁司特钠发生配伍反应生成黄色絮状物,故预先将1%EDTA-2Na、2%盐酸氯丙嗪溶液进行直肠给药处理,10 min后生理盐水冲洗干净,再用含200 mg孟鲁司特钠的灌肠液直肠给药,其余吸收促进剂与孟鲁司特钠灌肠液混合均匀直接从肛门插入直肠进行给药,同法取血。将①②③ 取得的血液于肝素抗凝管中,混匀,离心,分离血浆,于-70 ℃冷冻贮存,分析时置室温融化,再按1.4.3方法处理进样测定。家兔于再次实验前需间隔2周清洗期。
1.5 统计学分析采用SPSS 13.0统计软件,对血药浓度数据进行t检验。
2 结果 2.1 专属性结果孟鲁司特钠的保留时间为4.68 min,空白血浆中的内源性物质对孟鲁司特钠的测定无干扰,方法专属性良好 (图 1)。
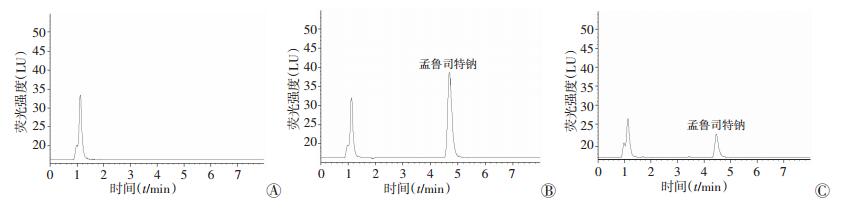
|
| A:空白血浆;B:空白血浆+10 μg/mL孟鲁司特钠;C:孟鲁司特钠血浆样品 图 1 孟鲁司特钠的专属性实验结果 |
2.2 精密度和方法回收率实验结果
本方法和设备的重复性及实验结果的稳定性和准确度良好 (表 1)。
| 浓度 (μg/mL) | 日内精密度 (n=5, x±s) | 日间精密度 (n=15, x±s) | 回收率[n=5, (x±s)%] |
| 0.1 | 0.101±0.008 | 0.094±0.007 | 96.07±8.51 |
| 0.2 | 0.189±0.010 | 0.184±0.009 | 93.50±4.62 |
| 1 | 0.960±0.019 | 0.930±0.034 | 87.00±2.63 |
| 8 | 7.905±0.288 | 7.706±0.359 | 99.22±2.70 |
2.3 样品稳定性实验结果
样品经系列处理后结果没有明显变化 (表 2),表明在本实验条件下,孟鲁司特钠标准血浆样品稳定性能够满足研究需要。
| 浓度 (μg/mL) | 冷冻 | 室温 | 反复冻融 | 血样处理后 |
| 0.2 | 0.191±0.014 | 0.185±0.014 | 0.181±0.005 | 0.187±0.008 |
| 1 | 1.006±0.021 | 0.931±0.049 | 0.928±0.041 | 0.962±0.040 |
| 8 | 8.072±0.191 | 7.539±0.294 | 7.703±0.500 | 7.713±0.298 |
2.4 孟鲁司特钠经家兔直肠吸收及吸收促进剂的影响
平均血药浓度-时间结果见图 2A~H,孟鲁司特钠经静脉注射给药结果见图 2I。不同的促进剂及其使用浓度对孟鲁司特钠经直肠的吸收均有影响,促进程度为吐温-80:10%>5%>15%,癸酸钠:1%>0.5%>0.2%,月桂氮卓酮:4%>2%>10%,胆酸钠:0.2%>0.5%>0.1%,L-精氨酸:1.5%>1%>0.5%,月桂酸钠:3%>2%>1%;预先用1%EDTA-2Na、2%盐酸氯丙嗪处理,其作用效果相近,并与10%月桂氮卓酮、0.1%胆酸钠、0.5%L-精氨酸、1%月桂酸钠相当,同样未显著改善孟鲁司特钠经直肠的吸收。10%吐温-80使孟鲁司特钠AUC0-t提高近9倍。除了0.2%胆酸钠达峰时间为0.5 h外,其余的促进剂均使孟鲁司特钠在1 h时达到血药浓度峰值。实验亦表明,相对于静脉给药,孟鲁司特钠自身及加入上述促进剂后经直肠吸收的生物利用度仍然较低。
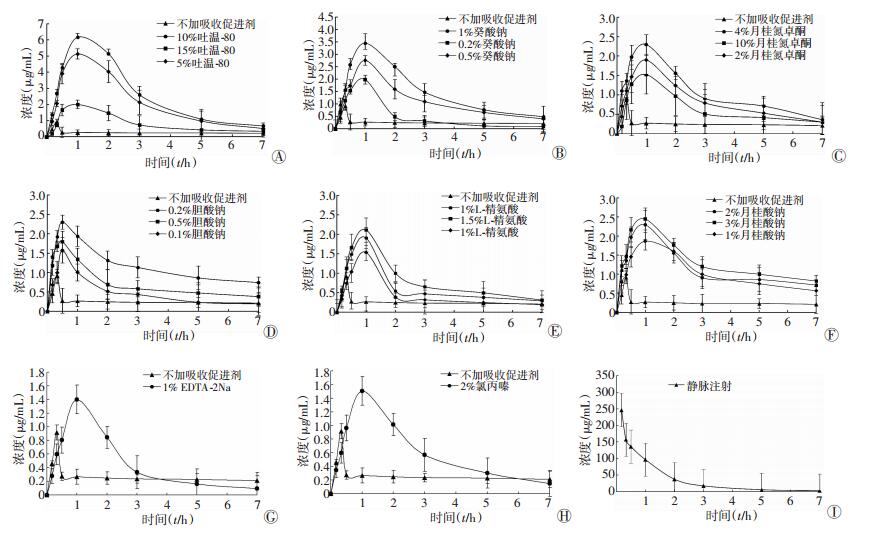
|
| A:不同浓度吐温-80对孟鲁司特钠的影响;B:不同浓度癸酸钠对孟鲁司特钠的影响;C:不同浓度月桂氮卓酮对孟鲁司特钠的影响;D:不同浓度胆酸钠对孟鲁司特钠的影响;E:不同浓度L-精氨酸对孟鲁司特钠的影响;F:不同浓度月桂酸钠对孟鲁司特钠的影响;G:1% EDTA-2Na对孟鲁司特钠的影响;H:2%氯丙嗪对孟鲁司特钠的影响;I:孟鲁司特钠静脉注射 图 2 不同吸收促进剂对孟鲁司特钠经直肠吸收的影响及静脉注射情况 |
与不加促进剂的孟鲁司特钠灌肠液 (对照组) 比较,加入10%吐温-80、1%癸酸钠、0.2%胆酸钠、4%月桂氮卓酮、3%月桂酸钠、1.5%L-精氨酸后孟鲁司特钠AUC0-t间差异有统计学意义 (P < 0.05)。
各吸收促进剂对孟鲁司特钠在家兔直肠吸收的影响及孟鲁司特钠家兔静脉注射的药动学参数见表 3。
| 吸收促进剂 | T1/2(h) | Tmax(h) | Cmax(mg/L) | AUC0-t[mg/(L·h)] | F (%) | SD |
| 10%吐温-80 | 1.38 | 1.00 | 6.176 | 18.619 | 5.28 | 0.171 |
| 1%癸酸钠 | 2.49 | 1.00 | 3.455 | 10.622 | 3.01 | 0.246 |
| 0.2%胆酸钠 | 2.36 | 0.50 | 2.296 | 7.480 | 2.12 | 0.272 |
| 4%月桂氮卓酮 | 4.98 | 1.00 | 2.299 | 8.216 | 2.33 | 0.239 |
| 3%月桂酸钠 | 2.98 | 1.00 | 2.111 | 5.707 | 1.62 | 0.541 |
| 1.5%L-精氨酸 | 4.36 | 1.00 | 2.296 | 8.141 | 2.31 | 0.277 |
| 1%EDTA-2Na | 2.22 | 1.00 | 1.401 | 2.557 | 0.73 | 0.176 |
| 2%盐酸氯丙嗪 | 2.34 | 1.00 | 1.508 | 2.914 | 0.83 | 0.358 |
| 不加促进剂 | 1.01 | 0.33 | 0.917 | 1.791 | 0.51 | 0.349 |
| 静脉注射 | 1.15 | 0.17 | 246.150 | 352.314 | 100.00 | 0.283 |
3 讨论
影响药物在肠道吸收的因素很多,如肠上皮细胞紧密连接、药物理化性质、剂型与处方组成等。药物分子跨肠上皮细胞吸收转运方式有3种:通过细胞膜的被动扩散 (跨细胞途径)[1];通过相邻细胞的被动扩散 (细胞旁路转运)[2];载体介导的转运 (载体介导的跨细胞途径)[3]。在正常生理情况下,离子和小分子物质可以通过紧密连接,一些大分子药物不能通过,紧密连接受到损伤,则细胞通透性增加。因此改变细胞膜的流动性,调节紧密连接的通透性,是促进药物跨膜转运的重要手段。非离子型表面活性剂吐温-80、月桂氮卓酮、脂肪酸盐癸酸钠、胆酸钠、月桂酸钠、L-精氨酸等是常用的促进剂[8],通过改变直肠黏膜结构,使上皮细胞间紧密连接暂时疏松,利于药物经细胞旁路通过;增强细胞膜流动性使细胞膜磷脂层紊乱,使通透性增加等方式达到吸收促进作用。
本实验结果表明,孟鲁司特钠自身难以经直肠吸收,消除迅速,生物利用度很低,可能与孟鲁司特钠分子量大不易吸收以及作为盐类水溶性大有关;加入上述促进剂均可提高孟鲁司特钠经直肠的吸收,Cmax提高2.3~6.8倍,AUC0-t提高3.2~10.3倍;不同促进剂作用下,孟鲁司特钠经直肠给药的T1/2差异较大,可能与吸收促进剂的促进机理不同导致吸收差异有关;实验亦提示促进剂的促吸收程度与促进剂的使用浓度有关。除了吐温-80和月桂氮卓酮加入灌肠液成混悬剂可能会影响其稳定性,在给药前应振摇使其恢复均匀外,其余促进剂与灌肠液均溶解完全呈溶液剂。① 加入吐温-80,孟鲁司特钠经直肠吸收的AUC0-t提高近9倍;Cmax提高近7倍。作为非离子表面活性剂,吐温-80的作用机制可能是改变溶液的界面张力,将药物包裹或嵌合在含药胶团中;另外提高黏膜上皮细胞脂质成分的流动性,改变细胞膜的微黏度,以及通过抑制存在于肠黏膜上的P-糖蛋白活性可增加底物药物的渗透能力[9]。实验观察到随使用浓度增大,其促进作用并不完全随之提高,可能是灌肠溶液黏度随吐温-80浓度加大而增大,分子扩散阻力增加,阻碍了药物的扩散转运[10]。吐温-80的溶血作用最弱,且本实验使用剂量在正常剂量之内,尽量使用低浓度以降低其毒性作用。② 月桂氮卓酮使孟鲁司特钠在直肠吸收的AUC0-t提高近4.5倍,Cmax提高2倍,促进结果与吐温-80类似,当提高其浓度时,促进作用反而降低,可能与溶液黏度提高,阻碍药物分子扩散导致吸收减少有关。③ 癸酸钠是一种低毒、有效的脂肪酸盐类促吸收剂,是目前本类中唯一被批准在药品中使用的吸收促进剂,已在瑞典、丹麦和日本的氨苄西林栓剂中应用[11]。本实验中使用癸酸钠作促进剂,与孟鲁司特钠溶解完全,AUC0-t提高近3.5倍,且随着浓度的增大促进作用提高。其作用机制可能与其能够和膜脂质蛋白发生作用,使膜结构发生紊乱,以及与细胞紧密连接处的离子发生螯合作用,使肌动蛋白微丝收缩并暂时打开上皮细胞紧密连接,从而增加药物细胞旁路转运有关。由于该作用具有可逆性,因此对肠黏膜损伤小[12]。也有报道显示,癸酸钠使紧密连接中的一些特定蛋白如claudin4、claudin5和occludin蛋白的分布变化,以此打开了细胞间紧密连接而促进药物吸收[13]。在降低癸酸钠紧密连接毒性的研究中,Imai等[14]发现癸酸钠和甘草酸二钾联合应用时不仅显著提高鲑鱼降钙素在大鼠结肠的吸收,同时结肠黏膜细胞膜和Caco-2细胞单层膜中均未观察到形态学变化与细胞毒性反应,这提示甘草酸二钾的加入不仅可协同癸酸钠的促吸收作用,还可降低癸酸钠对细胞的损伤而对肠道黏膜进行保护。④ 同样为脂肪酸盐的月桂酸钠,AUC0-t提高近3.2倍,Cmax提高近2.5倍,其促进作用随着使用浓度的增大而提高,但效果没有癸酸钠显著。其促进机制可能是打开了细胞间紧密连接使药物透过直肠黏膜的速率加快,也可能是对直肠黏膜细胞造成损伤从而促进药物吸收[15]。形态学研究证实,月桂酸钠作为吸收促进剂被单独应用时可能造成大鼠直肠黏膜细胞侵蚀、皱缩和膜蛋白溶解,而当牛磺酸和谷氨酰胺作为促进剂辅剂加入后则可极大程度地降低月桂酸钠对直肠黏膜细胞的损伤,这提示了可添加氨基酸作为细胞保护剂以实现脂肪酸及脂肪酸盐在促吸收作用中的安全性。⑤ 使用胆酸钠为促进剂,AUC0-t提高近4.2倍,达峰时间0.5 h,较其他促进剂为快,同样在高浓度时促进作用反而下降。其促进机制可能是其结构类似于胆固醇,易于嵌入细胞膜脂质双层,提高脂质双层的流动性,药物容易跨细胞膜转运;也可能通过增加细胞Ca2+浓度,导致球蛋白轻链激酶 (MLCK) 活化、肌球蛋白轻链 (MLC) 磷酸化而使肌动蛋白-肌球蛋白丝收缩,造成细胞紧密连接暂时松弛,从而促进药物经细胞旁路途径的吸收转运[16];另外也可能与其能够形成胶束降低肠道黏液的黏度有关[17]。显然这种作用可造成肠黏膜损伤, 但透膜电阻的迅速恢复表明这种损伤是可逆的, 当与亚油酸、磷脂或胆固醇合用时可明显降低此类促进剂的细胞毒性。⑥ L-精氨酸于1 h达到Cmax且提高近2.3倍,AUC0-t提高近4.5倍。其促进机制可能是L-精氨酸在氧气和NADPH (烟酰胺腺嘌呤二核苷磷酸) 存在下,由一氧化氮合酶 (NOS) 催化,经中间产物鸟氨酸产生L-胍氨酸和NO[18]。而NO使occludin mRNA表达明显减少, 影响紧密连接蛋白occludin的表达, 表明NO可影响细胞旁路转运,对肠上皮细胞产生作用,使细胞紧密连接扩张,从而生理性地增加细胞旁路的通透性,促进大分子药物的吸收,且对黏膜上皮无细胞毒性作用。⑦ EDTA-2Na是强效螯合剂,有研究报道EDTA可增加安替比林与酚红的直肠吸收,其机理可能是降低上皮细胞Ca2+浓度,从而打开细胞间紧密连接, 促进药物吸收[19]。盐酸氯丙嗪可与多种饱和及不饱和脂质体膜相互作用,尤其是与带负电荷的磷脂更易结合,进而改变脂质体膜的流动性[20]。作为钙调素抑制剂,氯丙嗪在低浓度时通过影响上皮细胞Ca2+浓度影响紧密连接调节细胞旁路增加药物转运,而高浓度时则表现为类似表面活性剂作用,进一步提高直肠黏膜上皮细胞膜流动性从而降低其稳定性,使质膜间隙扩大,破坏膜的完整性使药物吸收增加[21]。有实验证明盐酸氯丙嗪可显著促进安乃近经大鼠直肠的吸收,且与其浓度线性相关。在本实验中促进作用不明显,可能与EDTA-2Na、盐酸氯丙嗪经冲洗后,直肠上皮细胞紧密连接状态的可逆性恢复以及细胞自我修复有关。
孟鲁司特钠口服后血浆浓度达峰时间为3 h。而本实验采用直肠给药并加入促进剂后达峰时间为1 h,对于迅速缓解哮喘症状极为有利。本研究中吐温-80促进作用相对较好,对孟鲁司特钠经直肠给药制剂的处方研究提供了参考依据。
| [1] |
林琳, 马忠英, 乔逸, 等. 孟鲁司特钠分散片的人体生物等效性研究[J].
解放军药学学报, 2011, 27(4): 334–336.
Lin L, Ma Z Y, Qiao Y, et al. Bioequivalence of montelukast dispersible tablets in healthy volunteers[J]. Pharm J Chin PLA, 2011, 27(4): 334–336. DOI:10.3969/j.issn.1008-9926.2011.04.016 |
| [2] | Junginger H E. Excipients as Absorption Enhancers[M]//Krishna R, Yu L. Biopharmaceutics Applications in Drug Development.New York:Springer US, 2008:139-174.DOI: 10.1007/978-0-387-72379-2. |
| [3] | Sharma P, Varma M V, Chawla H P, et al. Absorption enhancement, mechanistic and toxicity studies of medium chain fatty acids, cyclodextrins and bile salts as peroral absorption enhancers[J]. Farmaco, 2005, 60(11/12): 884–893. DOI:10.1016/j.farmac.2005.08.008 |
| [4] | Rege B D, Yu L X, Hussain A S, et al. Effect of common excipients on Caco-2 transport of low-permeability drugs[J]. J Pharm Sci, 2001, 90(11): 1776–1786. DOI:10.1002/jps.1127 |
| [5] |
李文淑, 刘树红, 孙斌, 等. 孟鲁斯特钠咀嚼片在健康人体内药动学和生物等效性[J].
现代生物医学进展, 2012, 12(2): 337–340.
Li W S, Liu S H, Sun B, et al. Study on bioavailability of montelukast sodium chewable tablets[J]. Progress in Modern Biomedicine, 2012, 12(2): 337–340. DOI:10.13241/j.cnki.pmb.2012.02.061 |
| [6] | Alsarra I, Khalil N Y, Sultan M, et al. Spectrofluorometric determination of momtelukast in dosage forms and spiked human plasma[J]. Pharmazie, 2005, 60(11): 823–826. |
| [7] |
杨振华, 偶志红, 徐丹丹. 不同吸收促进剂对氯唑西林钠栓溶出度和家兔血药浓度的比较[J].
中国医院药学杂志, 1998, 18(1): 5–8.
Yang Z H, Ou Z H, Xu D D. Different absorption promoter of cloxacillin sodium suppository dissolution and the comparison of rabbit plasma concentration[J]. Chinese Journal of Hospital Pharmacy, 1998, 18(1): 5–8. DOI:10.3321/j.issn:1001-5213.1998.01.002 |
| [8] |
侯雪梅, 李国栋, 李卫华. 化学促渗剂及其机理的探讨[J].
上海医药, 2008, 29(5): 231–235.
Hou X M, Li G D, Li W H. The discussion of chemical enhancers mechanism[J]. Shanghai Medical & Pharma J, 2008, 29(5): 231–235. DOI:10.3969/j.issn.1006-1533.2008.05.016 |
| [9] |
李国锋, 黄蓓蓓, 腊蕾, 等. 几种表面活性剂对P-gp底物罗丹明123经肠黏膜透过性的影响[J].
中国药学杂志, 2008, 43(16): 1252–1256.
Li G F, Huang B B, La L, et al. Effect of some surfactants on permeabilities of rhodamine 123, a P-gp substrate through the rat intestinal membranes in vitro[J]. Chin Pharm, 2008, 43(16): 1252–1256. DOI:10.3321/j.issn:1001-2494.2008.16.012 |
| [10] |
张明令, 张海燕, 丛英, 等. 吐温-80在水溶液中的表面活性研究[J].
中成药, 2010, 32(1): 55–58.
Zhang M L, Zhang H Y, Cong Y, et al. Research on Tween-80 surfactant in aqueous solution[J]. Chin Trad Pat Med, 2010, 32(1): 55–58. DOI:10.3969/j.issn.1001-1528.2010.01.016 |
| [11] | Lindmark T, Kimura Y, Artursson P. A bsorption enhancement through intracellular regulation of tight junction permeability by medium chain fatty acids in Caco-2 cells[J]. J Pharmacol Exp Ther, 1998, 284(1): 362–369. |
| [12] | Coyne C B, Kelly M M, Boucher R C, et al. Enhanced epithelial gene transfer by modulation of tight junctions with sodium caprate[J]. Am J Respir Cell Mol Biol, 2000, 23(5): 602–609. DOI:10.1165/ajrcmb.23.5.4164 |
| [13] | Suqibayashi K, Onuki Y, Takayama K. Displacement of tight junction proteins from detergent-resistant membrane domains by treatment with sodium caprate[J]. Eur J Pharm Sci, 2009, 36(2/3): 246–253. DOI:10.1016/j.ejps.2008.09.011 |
| [14] | Imai T, Sakai M, Ohtake H, et al. Absorption-enhancing effect of glycyrrhizin induced in the presence of capric acid[J]. Int J Pharm, 2005, 294(1/2): 11–21. DOI:10.1016/j.ijpharm.2004.12.029 |
| [15] | Miyake M, Kamada N, Oka Y, et al. Development of suppository formulation safely improving rectal absorption of rebamipide, a poorly absorbable drug, by utilizing sodium laurate and taurine[J]. J Control Release, 2004, 99(1): 63–71. DOI:10.1016/j.jconrel.2004.06.007 |
| [16] | Emori H, Yokohama S, Nishihata T. Small intestinal absorption of bropirimine in rats and effect of bile salt on the absorption[J]. J Pharm Pharmacol, 1995, 47(6): 487–492. DOI:10.1111/jphp.1995.47.issue-6 |
| [17] | Mukaizawa F, Taniguchi K, Miyake M, et al. Novel oral absorption system containing polyamines and bile salts enhances drug transport via both transcellular and paracellular pathways across Caco-2 cell monolayers[J]. Int J Pharm, 2009, 367(1/2): 103–108. DOI:10.1016/j.ijpharm.2008.09.027 |
| [18] |
黄波, 陈畅. 一氧化氮的功能及其作用机制 (Ⅰ)——性质与功能[J].
生物物理学报, 2012, 28(3): 173–184.
Huang B, Chen C. Function and mechanism of nitric oxide (Ⅰ)-character and function[J]. ACTA BIOPHYSICA SINICA, 2012, 28(3): 173–184. DOI:10.3724/SP.J.1260.2012.20007 |
| [19] | Aungst B J. Intestinal permeation enhancers[J]. J Pharm Sci, 2000, 89(4): 429–442. DOI:10.1002/(SICI)1520-6017(200004)89:4<429::AID-JPS1>3.0.CO;2-J |
| [20] | Wisniewska A, Wolnicka-Glubisz A. ESR studies on the effect of cho1esterol on chlorpromazine interaction with saturated and unsaturated liposome membranes[J]. Biophys Chem, 2004, 111(1): 43–52. DOI:10.1016/j.bpc.2004.04.001 |
| [21] |
杨丹, 王章阳, 陈勇川, 等. 盐酸氯丙嗪促进药物直肠吸收机制研究[J].
第三军医大学学报, 2009, 31(10): 926–930.
Yang D, Wang Z Y, Chen Y C, et al. In vitro mechanisms of drug absorption in rectum promoted by chlorpromazine hydrochloride[J]. J Third Mil Med Univ, 2009, 31(10): 926–930. DOI:10.3321/j.issn:1000-5404.2009.10.014 |



