酵母沉默信息调节因子2相关酶1(Sirtuin type 1, Sirt1) 是酵母沉默信息调节因子2(Sir2) 的同源基因,是依赖NAD+的组蛋白去乙酰化酶。作为一种核蛋白,Sirt1广泛分布于人体各组织器官,参与炎症、脂质代谢、细胞应激、细胞凋亡/增殖等,而这些生理病理过程也正是急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)发生、发展的重要影响因素。因此,Sirt1被认为是炎症反应尤其是ARDS的关键元件和炎症反应调节剂之一[1]。研究发现乙酰白藜芦醇预处理激活Sirt1表达能减轻ARDS小鼠的炎症反应[2],但Sirt1参与ARDS发生、发展的机制目前仍未阐明。NF-κB是细胞炎症反应基因的重要转录激活因子,也是调控ARDS炎症反应的关键,RelA/p65亚基是NF-κB转录活性的关键部位; 而肺血管内皮-肺泡上皮屏障的损伤是ARDS的核心病理生理变化,肺泡Ⅱ型上皮细胞(AEC Ⅱ)是构筑该屏障的重要组分。本研究以Sirt1过表达小鼠为基础,分析Sirt1在AEC Ⅱ LPS炎症损伤中对NF-κB的作用,为进一步理解Sirt1在ARDS病程中的作用机制提供依据。
1 材料与方法 1.1 材料 1.1.1 动物准备Sirt1 super B6.Cg-Tg(Sirt1) ASrn/J(Tg小鼠)雄性小鼠2只、雌性野生型(WT)小鼠2只均购自美国Jackson实验室。饲养在第三军医大学新桥医院SPF(specific pathogen free)级动物层流隔离室,室内恒温20~26 ℃,照明12 h昼夜交替。小鼠饲料由第三军医大学新桥医院制备,并喂食花生米增加营养。饲养期间密切观察小鼠生长情况。采用8周以上小鼠按照雌雄1:1近亲繁殖,子代小鼠21 d断乳分笼,待8周后亦近亲繁殖。
1.1.2 主要试剂和实验设备DNA提取扩增套装(TIANGEN),qRT-PCR试剂盒(All-in-One),TRIzol、RIPA强裂解液、BCA蛋白浓度检测试剂盒、Tris-base、SDS-PAGE凝胶配制试剂盒、Ⅰ型胶原酶、LPS(Biosharp),Mouse Sirt1 Antibody (C-term,ABGENT),Actin β Polyclonal Antibody(ruiying biological),NF-κB/p65 (Acetyl Lys310) Polyclonal Antibody(Immunology Way),小鼠IgG(Bioss),胰酶(Gibco),胎牛血清(Sciencell),碱性磷酸酶染色试剂盒、苏木精-伊红染液(武汉谷歌生物科技),SP-C兔多克隆抗体(Santa Cruz),羊抗兔IgG-FITC(中杉金桥),小鼠IL-6 ELISA检测试剂盒、小鼠TNF-α ELISA检测试剂盒(QuantiCyto),电泳设备(SDS-PAGE),PCR仪(Bio-Rad),水平电泳仪(北京六一),紫外分光光度计(Thermo),PCR仪(RotorGene GX-3000),酶标仪(BIO-TEK),倒置显微镜(尼康),组化笔(Gene tech)。
1.2 方法 1.2.1 动物基因型鉴定① 基因组DNA提取。对10~12 d子代小鼠打耳标编号,并剪取0.5~1.0 cm尾巴进行基因型鉴定。按照TIANGEN快速DNA提取扩增套装提取基因组DNA:将尾巴放入1.5 mL EP管中,加裂解缓冲液200 μL,充分研磨后加入蛋白酶K 10 μL,56 ℃孵育过夜,95 ℃处理5 min,13 000 r/min离心5 min。将上清吸出,用紫外分光光度计进行DNA定量。② 聚合酶链反应(polymerase chain reaction,PCR)。引物由Jackson实验室提供,Tg上游引物: 5′-AGATAGTTCACCGGGGTGAGA-3′,下游引物:5′-TC-GGTCGAAGAGTATCTGGTG-3′,片段大小350 bp。内参上游引物:5′-CAAATGTTGCTTGTCTGGTG-3′,下游引物:5′-GTCAGTCGAGTGCACAGTTT-3′,片段大小200 bp。反应体系25 μL。扩增条件:95 ℃ 3 min; 95 ℃ 30 s、60 ℃ 30 s、72 ℃ 1 min,35个循环; 72 ℃ 10 min; 10 ℃保温。
1.2.2 小鼠肺组织Sirt1表型鉴定 1.2.2.1 qRT-PCR检测小鼠Sirt1 mRNA表达差异① TRIzol提取肺组织RNA:无菌条件下取出成年小鼠肺组织,100 mg肺加入1 mL Trizol,经异丙醇沉淀、75%乙醇洗涤后,用无酶水溶解RNA,紫外分光光度计进行RNA定量和质检。② 反转录反应。③ 实时荧光定量PCR检测:引物信息来自文献[3]。Sirt1上游5′-CCCTTCTCAGTCTGCTCCAC-3′,下游5′-CTCCA-CGAACAGCTTCACAA-3′; GAPDH上游:5′-ACCTTTGGCATTGTGGAAGG-3′,下游5′-ACACATTGGGGGTAGGAACA-3′。扩增条件:95 ℃ 10 min; 95 ℃ 10 s、60 ℃ 20 s、72 ℃ 20 s检测荧光,40个循环; 72 ℃ 10 min; 10 ℃保温。结果用2-△ΔCt法进行数据分析。
1.2.2.2 Western blot检测小鼠Sirt1蛋白表达差异① 肺组织蛋白准备:无菌条件下取出肺组织,100 mg肺加入1 mL含PMSF的RIPA强裂解液,冰上裂解30 min,12 000 r/min离心10 min,取上清,用BCA蛋白浓度测定法检测蛋白浓度。将抽提的蛋白定量后加入蛋白上样缓冲液,沸水中变性5 min,-20 ℃保存备用。② 蛋白电泳和显影:配制10% SDS-PAGE凝胶,蛋白上样后80 V恒压电泳至样品跑到浓缩胶与分离胶的分界处,120 V恒压电泳至溴酚蓝跑出电泳槽;300 mA恒流、4 ℃电转150 min将蛋白转印至PVDF膜(孔径0.22 μm);用含5%脱脂奶粉的TBST 37 ℃封闭1 h,加入兔抗鼠Sirt1抗体(1:500) 或兔抗鼠β-actin抗体(1:1 000) 4 ℃孵育过夜;TBST洗膜15 min×3次;加入山羊抗兔抗体(1:1 000) 37 ℃孵育1 h,TBST洗膜15 min×3次后敷上发光液,暗室曝光显影。
1.2.3 ARDS小鼠肺组织HE染色病理变化差异① ARDS小鼠模型:随机选取Tg和WT成年小鼠各12只,分别随机分为实验组和对照组,实验组腹腔注射LPS 15 mg/kg[4],对照组腹腔注射生理盐水,自由进食水,12 h后处理。② 肺组织石蜡切片HE染色:无菌条件下取出肺组织,分别放入5 mL离心管中,用4%多聚甲醛固定24 h,经浸洗、脱水、浸蜡后,石蜡包埋、切片、制片,进行常规HE染色。
1.2.4 AECⅡ的分离培养和鉴定[5] 1.2.4.1 AECⅡ的分离制备IgG包被6孔板和Ⅰ型胶原酶包被6孔板,室温保存。出生1 d的小鼠剪尾以备做PCR鉴定,无菌条件下取出肺组织,用5%血清+1%双抗的杜氏磷酸缓冲液(DPBS)冲洗,直至肺组织变成白色。将肺组织移入另一个培养皿中,剪碎,用含有0.1% Ⅰ型胶原酶(0.01 g/L)、5%胎牛血清的分解液4 ℃作用12 h,37 ℃孵育2 h,加入DMEM完全培养基,100 μm细胞筛网过滤至15 mL离心管,1 000 r/min离心5 min,弃上清,加PBS 1 mL重悬细胞。台盼蓝染色,血球计数板计数。
1.2.4.2 免疫粘附法细胞筛选将细胞接种于小鼠IgG包被的培养皿中,培养3 h;吸取未贴壁的细胞800 r/min离心4 min,收集细胞,1×105/mL接种于Ⅰ型胶原酶包被6孔板。6 h后倒置显微镜下观察。
1.2.4.3 AECⅡ的鉴定① 制备细胞爬片。② 碱性磷酸酶(ALP)染色[6]:4%多聚甲醛固定细胞爬片15 min,PBS漂洗3次,5 min/次; 破膜10~15 min,PBS漂洗3次,5 min/次;细胞爬片置于碱性磷酸酶孵育液中37 ℃孵育4 h,流水浸洗2 min,2%硝酸钴水溶液作用5 min,流水浸洗2 min,1%硫化铵水溶液处理30 s,流水浸洗2 min;苏木精染细胞核;中性树胶封片。③ SP-C免疫荧光[7]:4%多聚甲醛固定30 min,PBS洗3次,每次5 min;组化笔画圈,加50~100 μL破膜工作液,室温孵育10 min,PBS洗3次,每次5 min;滴加抗SP-C兔多克隆抗体(1:50),湿盒内4 ℃孵育过夜;滴加FITC荧光标记羊抗兔二抗(1:200),避光室温孵育50 min;DAPI复染细胞核,封片。
1.2.5 鉴定LPS损伤后AECⅡ IL-6和TNF-α的表达根据PCR结果鉴定区分两种不同Sirt1基因背景的AEC Ⅱ,将两种AEC Ⅱ分别随机设置LPS 10 μg/mL[8]处理实验组和空白对照组。在0、2、4、6、8、12、24 h检测细胞上清液中IL-6和TNF-α的表达水平。准备生物素化抗体工作液和酶结合物工作液,上样,36 ℃孵育90 min,加入生物素化抗体工作液,36 ℃孵育60 min,加入酶结合物工作液,36 ℃避光孵育30 min,加入显色底物(TMB)36 ℃避光孵育15 min,加入终止液,3 min内测量D(450) 值。
1.2.6 检测AECⅡ LPS损伤后NF-κB/p65蛋白和乙酰化NF-κB/p65蛋白表达差异两种不同Sirt1基因背景的AECⅡ分别设置LPS损伤实验组和空白对照组,12 h后提取细胞总蛋白:弃掉培养液,用预冷的PBS洗细胞3次,刮脱细胞收集至离心管,1 000 r/min离心5 min,1×107个细胞加入1 mL细胞裂解液,吹打细胞至蛋白析出,14 000 r/min,4 ℃离心15 min。BCA法检测蛋白浓度。Western blot检测AECⅡ LPS损伤后NF-κB/p65蛋白、乙酰化NF-κB/p65蛋白表达差异[9]。
1.3 统计学处理采用SPSS 17.0统计软件,正态分布的资料用x±s描述,不符合正态分布或标准差过大的用中位数和四分位数表示,两组间均数比较采用t检验。
2 结果 2.1 基因型鉴定通过DNA提取和PCR鉴定小鼠基因型,结果如图 1:1~4表达350 bp条带和200 bp条带,为Tg小鼠; 5~8只表达200 bp条带,为WT小鼠。
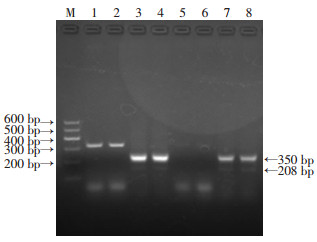
|
| M:标准;1~4:Tg小鼠;5~8:WT小鼠 图 1 小鼠基因鉴定 |
2.2 小鼠肺组织Sirt1表型鉴定
qRT-PCR和Western blot鉴定小鼠肺组织Sirt1 mRNA和蛋白表达差异,发现Tg小鼠肺组织Sirt1 mRNA的表达水平显著高于WT小鼠(P=0.08),Tg小鼠肺组织蛋白的表达水平显著高于WT小鼠(P=0.015,图 2)。
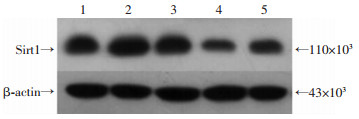
|
| 1~3:Tg小鼠肺组织Sirt1;4、5:WT小鼠肺组织Sirt1 图 2 Western blot检测两组小鼠肺组织Sirt1蛋白表达 |
2.3 LPS处理小鼠肺组织HE染色病理变化差异
Tg小鼠和WT小鼠正常肺组织对比未见明显差异(图 3A~F)。腹腔注射LPS 15 mg/kg 12 h后,与WT小鼠相比,Tg小鼠肺组织损伤较轻。主要表现为WT小鼠比Tg小鼠肺组织弥漫性出血更明显,肺泡腔内红细胞漏出、肺泡间隔破坏更为严重,肺组织内中性粒细胞浸润更显著(图 3G~L)。
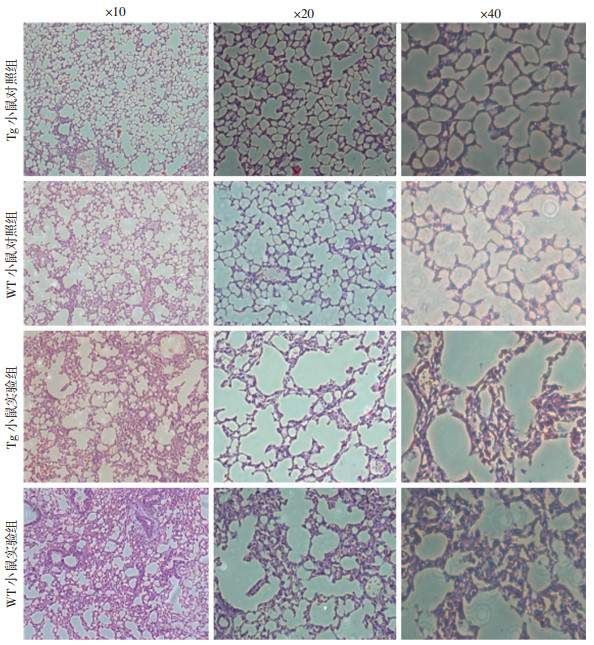
|
| 图 3 各组小鼠肺组织HE染色病理观察 |
2.4 AECⅡ的分离培养及鉴定
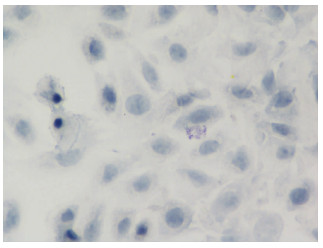
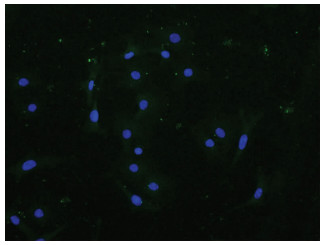
AECⅡ分离纯化后在光镜下呈圆形或立方形(图 4),ALP染色和SP-C免疫荧光鉴定细胞:ALP染色后阳性反应的细胞细胞质中表达深蓝色细颗粒状酶反应产物,细胞核被苏木精染成蓝色(图 5); 免疫荧光鉴定阳性细胞质内呈现绿色荧光,提示该细胞表达SP-C蛋白(图 6),阳性细胞比例>92%。
|
| 图 4 光镜下AECⅡ呈圆形或立方形(×200) |
|
| 图 5 分离纯化的小鼠AECⅡ经碱性磷酸酶染色后倒置光学显微镜下观察(×400) |
|
| 图 6 经SP-C免疫荧光染色后AECⅡ细胞的免疫荧光观察(×200) |
2.5 ELISA检测LPS损伤后AECⅡ IL-6和TNF-α的表达
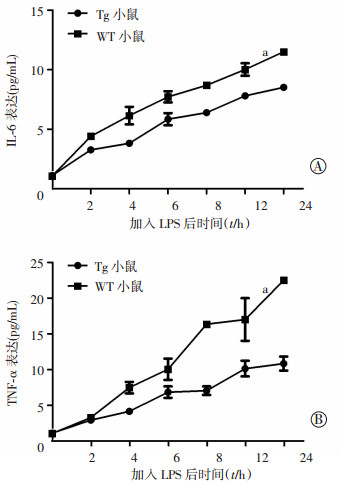
两种不同Sirt1背景的AECⅡ加LPS后IL-6和TNF-α的表达随时间推移逐渐增加,与0 h对比差异显著(P<0.01)。两种AECⅡ未加LPS刺激之前IL-6和TNF-α的表达差异无统计学意义(P=0.478);加入LPS 4、8、12、24 h后,WT小鼠AECⅡ上清液中IL-6、TNF-α的表达均显著高于Tg小鼠(P<0.05,P<0.01,图 7)。
|
| A: IL-6 a: P<0.05,与Tg小鼠比较;B: TNF-α a: P<0.01,与Tg小鼠比较 图 7 ELISA检测LPS损伤后肺泡Ⅱ型上皮细胞IL-6和TNF-α的表达 |
2.6 AECⅡ LPS损伤后NF-κB/p65和乙酰化NF-κB/p65表达差异
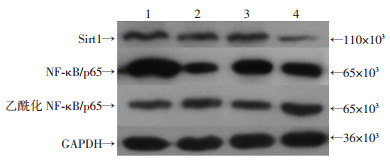
两种AECⅡ经LPS 10 μg/mL处理后,与各自的空白对照组相比Sirt1表达下降,且WT小鼠AECⅡ下降更明显,WT小鼠AECⅡ在LPS处理前后NF-κB/p65的变化倍数是Tg小鼠AECⅡ的1.77倍(P=0.004),乙酰化NF-κB/p65的变化倍数是Tg小鼠AECⅡ的2.91倍(P=0.040,图 8)。
|
| 1:Tg小鼠;2:WT小鼠;3:LPS处理后Tg小鼠;4:LPS处理后WT小鼠 图 8 Western blot检测肺泡Ⅱ型上皮细胞LPS损伤后NF-κB/p65和乙酰化NF-κB/p65表达 |
3 讨论
炎症损伤是ARDS的重要事件,ARDS炎症损伤的主要靶细胞为AECⅡ和肺微血管内皮细胞。AECⅡ具有合成和分泌肺表面活性物质、转化为肺泡Ⅰ型上皮细胞、参与维持肺泡内液体平衡以及免疫防御等多种生理功能[10],因此明确AECⅡ在ARDS病程中的损伤机制对于ARDS的治疗具有重要意义。Sirt1因具有去乙酰化组蛋白和多种细胞因子的功能参与炎症、凋亡、自噬、氧化应激等多种生理病理过程,也在ARDS等多种疾病中具有重要作用。LPS是ARDS的重要生物致病因素之一,也广泛用于动物急性呼吸窘迫综合征模型的制备,因此本实验利用不同Sirt1基因背景小鼠来源的AECⅡ,由LPS构建动物和细胞炎症损伤模型分析Sirt1在ARDS中的作用,期望为ARDS中AECⅡ损伤机制研究提供更多实验数据。
3.1 Sirt1减轻了ARDS小鼠和AECⅡLPS损伤后的炎症反应该实验所用Sirt1转基因小鼠来自Jackson实验室[3]。将小鼠繁殖后筛选鉴定基因型,以区分不同Sirt1基因背景的小鼠(图 1)。经qRT-PCR和Western blot检测(图 2),Tg小鼠肺组织Sirt1 mRNA和蛋白的表达水平显著高于WT小鼠,明确了Sirt1在小鼠肺部的表达情况,为后续实验奠定了基础。从LPS致伤动物和细胞两种模型的研究发现,Tg小鼠和Tg小鼠来源的AECⅡ比WT小鼠对LPS的抵抗性更强:表现为与WT小鼠相比LPS致伤Tg小鼠肺组织损伤程度较轻,而LPS致伤WT小鼠比Tg小鼠肺组织弥漫性出血更明显,肺泡腔内红细胞漏出、肺泡间隔破坏更为严重,肺组织内中性粒细胞浸润更显著(图 3G-I、J-L);Tg小鼠来源的AECⅡ LPS致伤后炎症因子的表达水平在多个时间点都低于WT小鼠AECⅡ(图 7)。有学者研究[2]发现乙酰化白藜芦醇(3,5,4′-Tri-O-acetylresveratrol,AC-Res)预处理激活Sirt1表达能减轻ARDS小鼠的炎症反应; 且AC-Res处理肺组织和白藜芦醇(resveratrol,Res)处理NR8383细胞均能显著降低LPS诱导的TNF-α、IL-6、IL-1β的产生和分泌。本实验观察到的现象与文献[2]的结论一致。这提示Sirt1能够减轻ARDS小鼠和AECⅡLPS损伤后的炎症反应,但Sirt1在ARDS中的作用机制仍然不清楚。
3.2 Sirt1可能通过去乙酰化NF-κB/p65减轻小鼠AECⅡ LPS炎症损伤NF-κB是细胞炎症反应基因的重要转录激活因子,细胞内LPS-钟形受体4 (toll like receptor 4,TLR4) 应答所致的炎症反应也通过经典的NF-κB信号通路。在生理和病理条件下NF-κB的两个活性基团p65和p50亚基需经过多种翻译后修饰才能发挥核转录因子作用,其中乙酰化是其行使转录活性的重要修饰。研究发现Sirt1能去乙酰化RelA/p65赖氨酸310残基,使NF-κB的转录活性下降[11-12]。因此,本实验对Sirt1在AECⅡ LPS损伤中对NF-κB的影响做进一步研究。两种不同Sirt1基因背景小鼠来源的AECⅡ经LPS(10 μg/mL)致伤后Sirt1表达均有不同程度的变化,WT小鼠AECⅡSirt1下降更为显著。两种AECⅡ的空白对照组间NF-κB/p65和乙酰化NF-κB/p65的表达量也有较大的差异,因此将LPS处理前后NF-κB/p65和乙酰化NF-κB/p65的变化倍数进行比较,发现LPS致伤后WT小鼠AECⅡ的NF-κB/p65和乙酰化NF-κB/p65的变化倍数均高于Tg小鼠AECⅡ(图 8),因此推测:Tg小鼠AECⅡ LPS损伤后去乙酰化状态的NF-κB/p65较WT小鼠AECⅡ含量高。证明:LPS处理可下调Sirt1的表达,而Sirt1可能通过去乙酰化NF-κB/p65参与调控AECⅡ LPS炎症损伤,抑制ARDS小鼠肺部炎症反应。但两种AECⅡ的NF-κB/p65和乙酰化NF-κB/p65表达不同的原因以及Sirt1对NF-κB/p65是否还存在其他的作用位点和方式仍然不明,需要进一步探索。
| [1] | MA L, ZHAO Y, WANG R, et al. 3, 5, 4'-Tri-O-acetylresveratrol attenuates lipopolysaccharide-induced acute respiratory distress syndrome via MAPK/SIRT1 pathway[J]. Mediat inflamm, 2015, 2015: 1–12. DOI:10.1155/2015/143074 |
| [2] | LIANG L, LIU X, WANG Q, et al. Pharmacokinetics, tissue distribution and excretion study of resveratrol and its prodrug 3, 5, 4'-tri-O-acetylresveratrol in rats[J]. Phytomedicine, 2013, 20(6): 558–563. DOI:10.1016/j.phymed.2012.12.012 |
| [3] | PFLUGER P T, HERRANZ D, VELASCO-MIGUEL S, et al. Sirt1 protects against high-fat diet-induced metabolic damage[J]. Proc Natl Acad Sci USA, 2008, 105(28): 9793–9798. DOI:10.1073/pnas.0802917105 |
| [4] | CHEN J K, WANG W C, ZANG L, et al. Repression of a chromatin modifier aggravates lipopolysaccharide-induced acute lung injury in mouse[J]. Biochem Biophys Res Commun, 2016, 471(4): 515–521. DOI:10.1016/j.bbrc.2016.02.043 |
| [5] | GEREKE M, AUTENGRUBER A, GRöBE L, et al. Flow cytometric isolation of primary murine type Ⅱ alveolar epithelial cells for functional and molecular studies[J]. J Vis Exp Jove, 2012(70): e4322–e4322. DOI:10.3791/4322 |
| [6] | MEBAN C. Fine structural localization of alkaline phosphatase in the granular pneumonocytes of hamster lung[J]. Histochemistry, 1975, 43(4): 367–372. DOI:10.1007/bf00490195 |
| [7] | SWAIN R J, KEMP S J, GOLDSTRAW P, et al. Spectral monitoring of surfactant clearance during alveolar epithelial type Ⅱ cell differentiation[J]. Biophys J, 2008, 95(12): 5978–5987. DOI:10.1529/biophysj.108.136168 |
| [8] | GUO L, LI S, ZHAO Y, et al. Silencing angiopoietin-like protein 4 (ANGPTL4) protects against lipopolysaccharide-induced acute lung injury via regulating SIRT1 /NF-kB pathway[J]. J Cell Physiol, 2015, 230(10): 2390–2402. DOI:10.1002/jcp.24969 |
| [9] | PAN W, YU H, HUANG S, et al. Resveratrol protects against TNF-α-induced injury in human umbilical endothelial cells through promoting sirtuin-1-induced repression of NF-KB and p38 MAPK[J]. PLoS One, 2016, 11(1): e0147034. DOI:10.1371/journal.pone.0147034 |
| [10] | LUCAS R, VERIN A D, BLACK S M, et al. Regulators of endothelial and epithelial barrier integrity and function in acute lung injury[J]. Biochem Pharmacol, 2009, 77(12): 1763–1772. DOI:10.1016/j.bcp.2009.01.014 |
| [11] | YANG H, ZHANG W, PAN H, et al. SIRT1 activators suppress inflammatory responses through promotion of p65 deacetylation and inhibition of NF-κB activity[J]. PLoS One, 2012, 7(9): e46364. DOI:10.1371/journal.pone.0046364 |
| [12] | HWANG J W, YAO H, CAITO S, et al. Redox regulation of SIRT1 in inflammation and cellular senescence[J]. Free Radic Biol Med, 2013, 61: 95–110. DOI:10.1016/j.freeradbiomed.2013.03.015 |



