2. 610083 成都,成都军区总医院神经内科
2. Department of Neurology, General Hospital of Chengdu Military Command, Chengdu, Sichuan Province, 610083, China
动脉粥样硬化是造成心脑血管疾病的重要原因。动脉粥样硬化形成的重要标志是泡沫细胞在血管内皮下沉积。泡沫细胞是由巨噬细胞或血管平滑肌细胞 (vascular smooth muscle cell,VSMC) 摄取脂质成分,细胞内大量脂质成分聚积使得细胞外观呈现泡沫样改变而形成。血管平滑肌细胞是中晚期动脉粥样硬化斑块中泡沫细胞的主要来源[1]。但相对于巨噬细胞,血管平滑肌细胞源性泡沫细胞形成的具体分子机制研究较少,尚需深入的研究探讨。
沉默信息调节因子1(silent mating type information regulation 2 homolog-1,SIRT1) 是一种广泛存在于哺乳动物细胞中的核蛋白,主要通过对组蛋白、转录因子及其他蛋白修饰的赖氨酸残基进行去乙酰化而调节基因的表达,进而参与细胞能量代谢、衰老、凋亡和抗动脉粥样硬化[2]等多个病理生理过程。有研究显示,SIRT1可通过抑制过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ) 的活性而减少脂肪前体细胞内脂质含量,抑制其向脂肪细胞的转化[3-4]。但SIRT1在平滑肌源性泡沫细胞形成中的作用尚不明确。酰基辅酶A:胆固醇酰基转移酶1(A-cholesterol acyltransferase 1,ACAT1) 是细胞内催化游离胆固醇酯化成为胆固醇酯,进而形成泡沫细胞的关键酶,已被证实在巨噬细胞[5]和血管平滑肌细胞[6]泡沫细胞形成中发挥重要作用。据此我们推测SIRT1可能通过影响ACAT1的表达,进而抑制血管平滑肌细胞中脂质的沉积,抑制平滑肌源性泡沫细胞的形成。本研究应用SIRT1激动剂及抑制剂调控其表达,观察其在血管平滑肌泡沫细胞形成中的作用及其相关机制。
1 材料与方法 1.1 实验动物及主要试剂SPF级8周龄C57BL/6J雄性小鼠6只,体质量18~22 g,购自北京华阜康生物科技公司,实验动物质量许可证号为SCXK (京)2014-0004。胎牛血清 (FBS)、DMEM购自美国HyClone公司,油红O购自美国Sigma公司,氧化型低密度脂蛋白 (oxidized low density lipoprotein,ox-LDL) 购自广东奕源生物公司,SIRT1、ACAT1、PPARγ一抗购自美国Santa Cruz公司,SIRT1激动剂SRT1720(SRT) 购自Selleck Chemicals公司 (Houston,TX,USA),抑制剂Nicotinamide (Nic) 购自Supelco公司 (Bellefonte,PA,USA),α-SMA购自ABCAM公司,PPARγ激动剂Rosiglitazone (RSG) 购自索来宝公司,抑制剂GW9662购自Medchem express公司。其余试剂均为国产或进口分析纯。
1.2 方法 1.2.1 血管平滑肌细胞原代培养及鉴定C57BL/6J雄性小鼠断颈处死后迅速取胸主动脉,采用组织贴块法,刮去血管外的结缔组织,剪碎,均匀贴在培养瓶底,用含20% FBS和1%双抗的DMEM高糖培养基培养。培养4~10 d后可见VSMC爬出组织块,继续生长8~14 d后进行传代培养。选取2~7代状态良好的细胞用于实验。取3代VSMC以1×105/孔接种于12孔板贴壁后,用免疫染色固定液固定,PBS洗涤,0.3% Triton打孔,α-SMA一抗4 ℃孵育过夜,Cy3标记山羊抗小鼠IgG二抗室温避光孵育2 h,DAPI避光染核,抗荧光猝灭封片剂封片,激光共聚焦显微镜下观察。
1.2.2 实验分组及模型建立细胞铺板培养,换无血清DMEM饥饿24 h,再加入ox-LDL培养,使脂质沉积于细胞内,建立泡沫细胞模型,后续实验均在此泡沫细胞模型基础上进行。为了检测SIRT1在ox-LDL (80 μg/mL) 刺激下随时间的变化,将VSMC分为空白对照,ox-LDL作用24、48、72 h组 (n=4)。为了检测ACAT1、PPARγ在VSMC泡沫化中的作用,在加入ox-LDL (80 μg/mL) 同时加入SIRT1激动剂 (SRT,1 μmol/L) 和抑制剂 (Nic,100 μmol/L),将VSMC分为空白对照组、ox-LDL组、SRT+ox-LDL组、SRT+Nic+ox-LDL组 (n=3)。为了检测PPARγ对ACAT1表达的影响,在加入ox-LDL (80 μg/mL) 同时加入PPARγ激动剂 (RSG,50 μmol/L) 或抑制剂 (GW9662,10 μmol/L),将VSMC分为ox-LDL对照组、ox-LDL+RSG组、ox-LDL+GW9662组 (n=3)。
1.2.3 Western blot检测药物干预24 h后收集细胞,BCA法测定蛋白浓度,SDS-PAGE凝胶电泳,转膜,5%脱脂奶粉室温封闭4 h,加入SIRT1(1 :500)、ACAT1(1 :1 000) 和PPARγ(1 :1 000) 一抗4 ℃孵育过夜,次日TBST洗膜10 min×4次,二抗室温孵育2 h,TBST洗膜10 min×4次,ECL显影。Lab Works软件分析蛋白条带灰度值。
1.2.4 油红O染色VSMC以2×105 /孔定量接种于24孔板中,无血清DMEM饥饿24 h,再将VSMC分为空白对照组、ox-LDL组、SRT+ox-LDL组、SRT+ Nic+ox-LDL组,培养48 h。取出后,用PBS液漂洗2次,4%多聚甲醛固定30 min,油红O避光染色,蒸馏水清洗,倒置显微镜下观察。
1.3 统计学分析使用SPSS 18.0统计软件,每项实验至少重复3次,数据以x±s表示。多组之间比较用单因素方差分析,两组间的比较用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 原代VSMC培养及鉴定采用组织块贴块法培养小鼠胸主动脉VSMC,普通光镜 (图 1A) 见VSMC呈带状三角形、菱形等。应用免疫荧光染色方法标记VSMC的标志性蛋白α-SMA,激光共聚焦显微镜下可见胞质呈现红色荧光 (图 1B、C、D),证实培养的细胞为VSMC,且目的细胞纯度达95%以上,可用于实验。
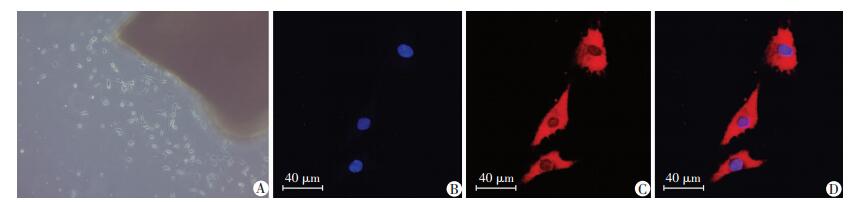
|
| A:第4天原代血管平滑肌细胞变化 (LM ×100);B:DAPI染色细胞核;C:红色荧光染色细胞质中的α-SMA;D:B与C融合图像 图 1 培养原代VSMC及鉴定 |
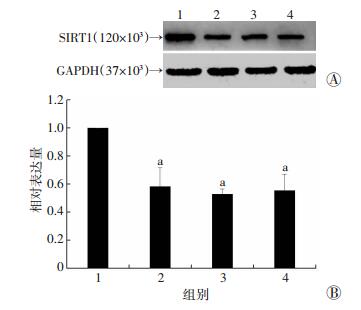
2.2 ox-LDL诱导的VSMC泡沫化过程中SIRT1表达显著降低
在ox-LDL诱导的VSMC泡沫样变过程中,SIRT1的表达显著降低,SIRT1在ox-LDL作用24、48、72 h后,蛋白表达分别降低了42%、47%、44%(P < 0.01,图 2);直至ox-LDL作用72 h后,SIRT1表达仍维持在较低水平,但未再呈现进一步降低的趋势。
|
|
1:空白对照组;2~4:分别为ox-LDL (80 μg/mL) 作用24、48、72 h组 A:Western blot检测结果;B:半定量分析结果 (n=4,x±s) a:P < 0.01,与空白对照组比较 图 2 ox-LDL诱导血管平滑肌细胞泡沫化形成中SIRT1的表达 |
2.3 SIRT1抑制ox-LDL诱导的VSMC泡沫细胞形成
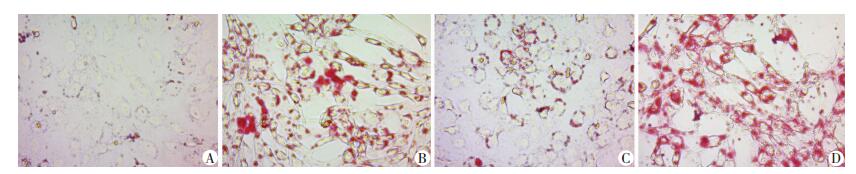
应用ox-LDL (80 μg/mL) 刺激培养的VSMC发生泡沫样变。Ox-LDL作用48 h后,油红O染色显示细胞形态增大变圆,细胞核增大,细胞质内出现大量红色脂滴,呈戒环状聚集于细胞质内。采用SIRT1的激动剂 (SRT,1 μmol/L) 和抑制剂 (Nic,100 μmol/L) 调控SIRT1,观察其对ox-LDL诱导的VSMC泡沫细胞形成的影响。结果显示,ox-LDL诱导VSMC 48 h后细胞内脂滴明显增多,呈泡沫样改变;应用SIRT1的激动剂 (SRT+ox-LDL组) 则减少细胞内脂滴聚集;而同时给予SIRT1抑制剂 (SRT+Nic+ox-LDL组) 则可阻断SRT的作用,使得ox-LDL诱导的细胞内脂滴聚集增多 (图 3)。
|
| A:空白对照组;B:ox-LDL组;C:SRT+ox-LDL组;D:SRT+Nic+ox-LDL组 图 3 油红O染色检测ox-LDL诱导48 h VSMC泡沫细胞的形成 (LM ×400) |
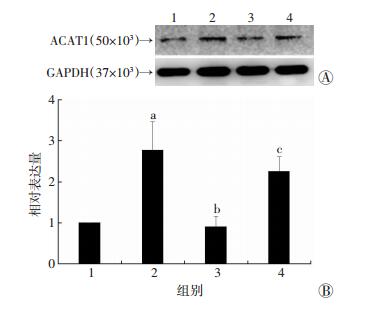
2.4 SIRT1通过调控ACAT1的表达抑制VSMC泡沫细胞形成
结果显示,ox-LDL诱导的VSMC泡沫细胞中,ACAT1的表达显著升高[(2.77±0.70),P < 0.01];加用SIRT1激动剂后 (SRT+ox-LDL组),ACAT1的表达显著下调[(0.90±0.27),P < 0.01];而SIRT1抑制剂 (Nic,100 μmol/L) 则升高ACAT1表达[(2.25±0.37),P < 0.05,图 4]。提示SIRT1可能通过调控ACAT1的表达,抑制细胞内胆固醇酯的合成,从而抑制ox-LDL诱导的VSMC泡沫细胞形成。
|
|
1:空白对照组;2:ox-LDL组;3:SRT+ox-LDL组;4:SRT+Nic+ox-LDL组 A:Western blot检测结果;B:半定量分析结果 (n=3,x±s) a:P < 0.01,与空白对照组比较;b:P < 0.01,与ox-LDL组比较;c:P < 0.05,与SRT+ox-LDL组比较 图 4 干预SIRT1血管平滑肌细胞培养24 h ACAT1的表达 |
2.5 SIRT1可上调VSMC中PPARγ的表达
应用SIRT1激动剂 (SRT,1 μmol/L) 和抑制剂 (Nic,100 μmol/L) 进一步检测SIRT1对PPARγ表达的影响。结果显示,ox-LDL诱导的VSMC泡沫细胞中,PPARγ的表达较对照组显著降低[(0.73±0.12),P < 0.05];加用SIRT1激动剂 (SRT+ox-LDL组) 则上调PPARγ的表达[(0.98±0.16),P < 0.05];而同时给予SIRT1抑制剂 (SRT+Nic+ox-LDL组) 可阻断SIRT1的作用,抑制PPARγ的表达[(0.47±0.13),P < 0.01,图 5]。提示SIRT1可显著上调ox-LDL诱导的VSMC泡沫细胞中PPARγ的表达,SIRT1可能通过此机制参与对VSMC中脂质含量的调控。

|
|
1:空白对照组;2:ox-LDL组;3:SRT+ox-LDL组;4:SRT+Nic+ox-LDL组 A:Western blot检测结果;B:半定量分析结果 (n=3,x±s) a:P < 0.05,与空白对照组比较;b:P < 0.05,与ox-LDL组比较;c:P < 0.01,与SRT+ox-LDL组比较 图 5 干预SIRT1后血管平滑肌细胞培养24 h PPARγ的表达 |
2.6 PPARγ抑制VSMC中ACAT1的表达
在ox-LDL存在的情况下,PPARγ激动剂RSG下调ACAT1的表达[(0.73±0.09),P < 0.01,图 6];而PPARγ抑制剂GW9662则明显上调ACAT1的表达[(1.68±0.09),P < 0.01,图 6]。提示在ox-LDL作用下PPARγ可以调控VSMC中ACAT1的表达。

|
|
1:ox-LDL组;2:ox-LDL+RSG组;3:ox-LDL+GW9662组 A:Western blot检测结果;B:半定量分析结果 (n=3,x±s) a:P < 0.01,均与ox-LDL组比较 图 6 干预PPARγ后血管平滑肌细胞培养24 h ACAT1的表达 |
3 讨论
泡沫细胞是由巨噬细胞或血管平滑肌细胞摄取脂质成分形成的,脂质沉积于细胞内形成脂质小体,使得细胞外观呈现泡沫样改变。泡沫细胞是构成粥样斑块的主要成分,是动脉粥样硬化的重要标志[7]。抑制泡沫细胞的生成不仅可以抑制动脉粥样硬化的病程进展,而且有利于维持斑块的稳定性,防止心脑血管事件的发生。因此,深入探讨泡沫细胞的形成机制,寻找有效的干预靶点,是防治动脉粥样硬化和心脑血管事件的重要环节。本研究应用致动脉粥样硬化因子ox-LDL刺激原代培养的VSMC形成泡沫细胞模型,经油红O染色可见细胞内出现大量的红色脂滴,呈戒环状聚集于增大的胞核周围,提示VSMC泡沫细胞形成。在此基础上,对泡沫细胞形成的分子机制做进一步的探讨。
SIRT1在心脑血管疾病中的抗炎、抗氧化、改善内皮功能等作用受到越来越多的重视[8]。通过对组蛋白/非组蛋白的去乙酰化作用,SIRT1参与调节细胞的增殖、分化、衰老、凋亡和代谢等病理生理过程[2]。本研究发现ox-LDL作用于培养的VSMC,24 h即出现SIRT1表达的显著减少,直至ox-LDL作用72 h后,SIRT1表达仍维持在较低的水平。VSMC泡沫细胞形成伴随着SIRT1的表达降低,提示SIRT1可能在VSMC胞内脂质水平的调控中发挥着重要作用。研究发现,在人类血管平滑肌细胞中,内源性SIRT1的表达随着年龄增加而减少,而且其减少与动脉粥样硬化的损伤存在一定相关性[9]。本研究分别应用SIRT1的激动剂SRT和抑制剂Nic,观察其对VSMC泡沫细胞形成的影响。结果发现,SIRT1激动剂可显著抑制ox-LDL诱导的细胞内脂滴聚集,抑制泡沫细胞的形成;而同时给予SIRT1抑制剂则可阻断这一作用,使得ox-LDL诱导的细胞内脂滴聚集增多。提示SIRT1起到抑制细胞内脂质聚积,抑制泡沫细胞形成的重要作用。有研究报道,SIRT1通过影响VSMC中MMP9[10]和TIMP3[11]表达而增加斑块纤维帽的稳定性,以及抗DNA损伤、增加纤维帽相对厚度和抗中膜重构[12]等机制,发挥抗动脉粥样硬化的作用。本研究结果显示,SIRT1还可参与调控细胞内的脂质平衡,减少脂质聚积,抑制VSMC泡沫细胞的形成,从而发挥抗动脉粥样硬化的作用。
在VSMC泡沫化过程中,ACAT1是其中的关键酶。它可以催化游离胆固醇形成胆固醇酯,并以脂滴的形式存储于细胞中[13]。本研究发现,VSMC泡沫细胞中ACAT1的表达显著升高,SIRT1激动剂可显著下调ACAT1的表达,而SIRT1抑制剂则升高ACAT1表达。因此,SIRT1可能通过调控细胞内ACAT1的表达,抑制细胞内胆固醇酯的合成,从而抑制ox-LDL诱导的VSMC泡沫细胞形成。
细胞内ACAT1的表达受到核转录因子PPARγ的调控。PPARγ为核受体超家族成员,可调节多种参与脂质代谢、脂肪形成和糖代谢的相关蛋白的表达。研究显示,在肺炎衣原体诱导的巨噬细胞源性泡沫细胞中,单独使用PPARγ激动剂RSG可抑制60% ACAT1蛋白表达[14]。本实验室以往的研究证明,应用PPARγ激动剂可明显抑制VSMC中ACAT1的表达,并抑制泡沫细胞的形成[6]。本研究结果也证明,PPARγ的活化显著抑制ACAT1的表达,而使用PPARγ抑制剂之后ACAT1的表达明显增加。由于PPARγ是已知的SIRT1的调控分子,由此推测,PPARγ可能介导了SIRT1对ACAT1表达的调控。
SIRT1激动剂对PPARγ的影响在不同细胞中并不一致。在脂肪细胞中,SIRT1激动剂可抑制PPARγ表达,从而增加脂肪动员[15]。而在巨噬细胞中,SIRT1激动剂白藜芦醇可以促进PPARγ的表达[16],激活SIRT1可以通过肝X受体 (LXR) 途径增加巨噬细胞中ABCA1/ABCG1的表达,从而增加胆固醇的外流。本研究结果显示,SIRT1激动剂使得PPARγ表达明显增加,而SIRT1抑制剂则阻断这一作用,与Voloshyna等[16]在巨噬细胞中得到的结果相似。
综上所述,SIRT1可显著上调ox-LDL诱导的VSMC泡沫细胞中PPARγ的表达,进而抑制ACAT1水平,抑制细胞内胆固醇酯的聚积和泡沫细胞的形成。上调和活化SIRT1可能对抑制VSMC泡沫细胞形成,延缓动脉粥样硬化进程具有一定的作用。
| [1] | Allahverdian S, Chehroudi A C, McManus B M, et al. Contribution of intimal smooth muscle cells to cholesterol accumulation and macrophage-like cells in human atherosclerosis[J]. Circulation, 2014, 129(15): 1551–1559. DOI:10.1161/CIRCULATIONAHA.113.005015 |
| [2] | Winnik S, Auwerx J, Sinclair D A, et al. Protective effects of sirtuins in cardiovascular diseases from bench to bedside[J]. Eur Heart J, 2015, 36(48): 3404–3412. DOI:10.1093/eurheartj/ehv290 |
| [3] | Chong Z Z, Wang S, Shang Y C, et al. Targeting cardiovascular disease with novel SIRT1 pathways[J]. Future Cardiol, 2012, 8(1): 89–100. DOI:10.2217/fca.11.76 |
| [4] | Feng S, Reuss L, Wang Y. Potential of Natural Products in the Inhibition of Adipogenesis through Regulation of PPARgamma Expression and/or Its Transcriptional Activity[J]. Molecules, 2016, 21(10): 1278. DOI:10.3390/molecules21101278 |
| [5] | Chistiakov D A, Bobryshev Y V, Orekhov A N. Macrophage-mediated cholesterol handling in atherosclerosis[J]. J Cell Mol Med, 2016, 20(1): 17–28. DOI:10.1111/jcmm.12689 |
| [6] | Yin Y W, Liao S Q, Zhang M J, et al. TLR4-mediated inflammation promotes foam cell formation of vascular smooth muscle cell by upregulating ACAT1 expression[J]. Cell Death Dis, 2014, 5: e1574. DOI:10.1038/cddis.2014.535 |
| [7] | Allahverdian S, Pannu P S, Francis G A. Contribution of monocyte-derived macrophages and smooth muscle cells to arterial foam cell formation[J]. Cardiovasc Res, 2012, 95(2): 165–172. DOI:10.1093/cvr/cvs094 |
| [8] | Zhang M J, Zhou Y, Chen L, et al. SIRT1 improves VSMC functions in atherosclerosis[J]. Prog Biophys Mol Biol, 2016, 121(1): 11–15. DOI:10.1016/j.pbiomolbio.2016.02.003 |
| [9] | Thompson A M, Wagner R, Rzucidlo E M. Age-related loss of SirT1 expression Results in dysregulated human vascular smooth muscle cell function[J]. Am J Physiol Heart Circ Physiol, 2014, 307(4): H533–H541. DOI:10.1152/ajpheart.00871.2013 |
| [10] | Cheng G, Zhang X, Gao D, et al. Resveratrol inhibits MMP-9 expression by up-regulating PPAR alpha expression in an oxygen glucose deprivation-exposed neuron model[J]. Neurosci Lett, 2009, 451(2): 105–108. DOI:10.1016/j.neulet.2008.12.045 |
| [11] | Cardellini M, Menghini R, Martelli E, et al. TIMP3 is reduced in atherosclerotic plaques from subjects with type 2 diabetes and increased by SirT1[J]. Diabetes, 2009, 58(10): 2396–2401. DOI:10.2337/db09-0280 |
| [12] | Gorenne I, Kumar S, Gray K, et al. Vascular smooth muscle cell sirtuin 1 protects against DNA damage and inhibits atherosclerosis[J]. Circulation, 2013, 127(3): 386–396. DOI:10.1161/CIRCULATIONAHA.112.124404 |
| [13] | Yu X H, Fu Y C, Zhang D W, et al. Foam cells in atherosclerosis[J]. Clin Chim Acta, 2013, 424: 245–252. DOI:10.1016/j.cca.2013.06.006 |
| [14] | He P, Mei C, Cheng B, et al. Chlamydia pneumoniae induces macrophage-derived foam cell formation by up-regulating acyl-coenzyme A:cholesterol acyltransferase 1[J]. Microbes Infect, 2009, 11(2): 157–163. DOI:10.1016/j.micinf.2008.11.001 |
| [15] | Wang S, Moustaid-Moussa N, Chen L, et al. Novel insights of dietary polyphenols and obesity[J]. J Nutr Biochem, 2014, 25(1): 1–18. DOI:10.1016/j.jnutbio.2013.09.001 |
| [16] | Voloshyna I, Hai O, Littlefield M J, et al. Resveratrol mediates anti-atherogenic effects on cholesterol flux in human macrophages and endothelium via PPARgamma and adenosine[J]. Eur J Pharmacol, 2013, 698(1/2/3): 299–309. DOI:10.1016/j.ejphar.2012.08.024 |



