2. 400038 重庆,第三军医大学:基础医学部全军免疫研究所
2. Institute of Immunology, College of Basic Medical Sciences, Third Military Medical University, Chongqing, 400038, China
胰腺癌 (pancreatic cancer,PC) 是恶性程度极高、生存预后极差的肿瘤[1]。我国胰腺癌的发病率以每年3%~4%的速度增长,到目前为止居恶性肿瘤死亡率第五位[2]。在胰腺癌发生、发展早期可出现局部浸润和远端转移[3],致使外科手术、化疗和放疗等手段的效果均不尽人意,其术后中位生存时间 < 6个月,5年生存率 < 6%[4]。因此,胰腺癌是目前肿瘤学研究的重点之一。
长链非编码RNA (long non-coding RNA,LncRNA) 是一类转录本长度超过200个核苷酸的RNA分子,哺乳动物基因组序列中4%~9%的序列产生的转录本是LncRNA[5]。这些LncRNA最初被认为是基因转录组的“噪音”且不能发挥生物学功能,因此未受到重视[6-7]。随着研究的深入,学者们发现LncRNA具有多种生物学功能,通过染色质修饰以及基因组印记、转录激活、转录后调控和蛋白功能调节等方式参与了恶性肿瘤的发生发展、侵袭转移[8-12]。本课题组在前期工作基础上,通过基因芯片筛选出在胰腺癌组织中高表达的LncRNA LOC100506123。本研究旨在探讨LncRNA LOC100506123的高表达对人胰腺癌细胞增殖及迁移的影响。
1 材料与方法 1.1 细胞来源正常胰腺导管上皮细胞HPDE及胰腺癌细胞系 (AsPC-1、BxPC-3、Panc-1、CFPAC-1) 从美国ATCC细胞库购买。24例临床胰腺癌及8例正常胰腺组织来自第三军医大学西南医院2014年10月至2016年6月肝胆外科C区胰腺癌标本库。
1.2 主要试剂高糖型DMEM培养基、MEM培养基 (HyClone公司);青/链霉素溶液 (碧云天公司);DEPC水 (碧云天公司);0.25%胰蛋白酶 (HyClone公司);特级胎牛血清 (ScienCell公司);CCK-8试剂盒 (日本同仁);RNA提取、反转录及qRT-PCR (TAKARA公司);Lipofectamine@2000转染试剂 (Thermo Fisher公司);引物 (上海英骏公司);siRNA (吉玛基因公司);Transwell小室 (Millipore公司)。其余试剂及耗材均由第三军医大学免疫研究所提供。
1.3 细胞培养及转染人胰腺癌细胞系 (AsPc-1、CFPAC-1) 接种于6孔板中,每孔接种4×105个细胞,放入恒温培养箱 (5%CO2,37 ℃) 中培养24 h。转染前使细胞铺满约60%,并每孔换液为2 mL的无血清无青/链霉素的MEM培养基。按照Lipofectamine® 2000推荐步骤,使每孔100 pmol siRNA、5.0 μL Lipofectamine® 2000。每系细胞都设有对照组 (NC)、实验组 (siR-1、siR-2、siR-3),干扰序列见表 1。
| 名称 | 序列 |
| siR-NC | 正义链: 5′-UUCUCCGAACGUGUCACGUTT-3′ 反义链: 5′-ACGUGACACGUUCGGAGAATT-3′ |
| siR-1 | 正义链: 5′-GCUGCUGAGUAACUGUGAUTT-3′ 反义链: 5′-AUCACAGUUACUCAGCAGCTT-3′ |
| siR-2 | 正义链: 5′-GGUCUCGAAUCAUCCUGAUTT-3′ 反义链: 5′-AUCAGGAUGAUUCGAGACCTT-3′ |
| siR-3 | 正义链: 5′-GGAACAACUAGAGGGAGAATT-3′ 反义链: 5′-UUCUCCCUCUAGUUGUUCCTT-3′ |
1.4 RNA提取
采用液氮低温研磨胰腺癌组织,加入1 mL TRIzol, 室温静置5 min,每管加入氯仿0.2 mL,剧烈振荡15 s,室温放置2 min,低温离心 (4 ℃,12 000 r/min,15 min)。然后吸取上层水相500 μL,移入另一无酶EP管中,并加入500 μL异丙醇,充分混匀,室温放置7 min,低温离心 (4 ℃,12 000 r/min,10 min),弃上清,再加入1 mL 75%乙醇,涡旋混匀,室温放置7 min,低温离心 (4 ℃,7 500 r/min,5 min),弃上清,真空干燥7 min。最后加入50 μL DEPC水,加热至60 ℃使RNA溶解,测浓度。同法提取细胞总RNA。
1.5 qRT-PCR检测按照反转录试剂盒 (PrimeScriptTMRT reagent Kit with gDNA Eraser) 说明,每孔加入1 000 μg RNA,20 μL体系进行反转录成cDNA。以GAPDH为内参,采用Real-time PCR检测LOC100506123的表达情况。LOC100506123基因、内参GAPDH上下游引物见表 2。按照PCR试剂盒说明,反应体系为25 μL,加入cDNA模板2.0 μL,SYBRR Premix Ex TaqⅡ(2×) 12.5 μL,上下游引物各1.0 μL,DEPC水8.5 μL。PCR反应条件为:预变性,95 ℃,2 min。变性,95 ℃,30 s;退火温度55 ℃,30 s;延伸,72 ℃,20 s;50个循环。每孔都分别设置3个复孔。采用2-ΔΔCt分析法,按照公式分别计算实验组、对照组的ΔCt,以空白组的ΔCt为参照,计算2-ΔΔCt,然后以3个复孔的均值和标准差作图,即为LOC100506123的相对表达量。
| 名称 | 序列 |
| LOC100506123 | 上游:5′-CCACAGACACTACCCAAAGC-3′ 下游:5′-TTTAGCCTCCACACTGGTTG-3′ |
| GAPDH | 上游:5′-GGTCTCCTCTGACTTCAACA-3′ 下游:5′-GTGAGGGTCTCTCTCTTCCT-3′ |
1.6 CCK-8细胞增殖实验
将转染siRNA (siR-NC、siR-1、siR-2) 达24 h的AsPc-1、CFPAC-1种植于96孔板中,使每孔细胞为4 000个。分别在6、24、48、72 h检测。具体步骤为:每孔换液后,分别加入10 μL CCK-8溶液 (注意不要在孔中形成气泡,它们会影响光密度值的测定); 将96孔板在培养箱中孵育4 h;用酶标仪测定在450 nm处的光密度值[D(450)],并绘制增殖曲线。
1.7 Transwell实验将转染siRNA (siR-NC、siR-1、siR-2) 达24 h的AsPc-1、CFPAC-1种植于Transwell小室中,每个小室中细胞为2×105个 (小室中不含血清,小室外为20%FBS培养基),培养箱中培养18 h后,用4%多聚甲醛固定1 h,并用小棉球擦拭掉小室内的细胞;苏木精-伊红 (HE) 染色,显微镜下观察计数并拍摄图像。
1.8 统计学分析采用SPSS 16.0统计软件,数据以x±s表示,进行独立样本t检验或单因素方差分析。P < 0.05表示差异有统计学意义。
2 结果 2.1 LOC100506123在胰腺癌组织及细胞系中的表达采用qRT-PCR在正常胰腺 (8例) 及胰腺癌 (24例) 中检测LncRNA LOC100506123的表达, 结果显示,LOC100506123在胰腺癌组织中的表达显著高于正常胰腺 (P < 0.05, 图 1A)。检测LOC100506123在细胞株的表达情况, 结果表明:LOC100506123在胰腺癌细胞系AsPC-1、BxPC-3、Panc-1、CFPAC-1中的表达明显高于正常胰腺导管上皮细胞系HPDE (P < 0.01)。其中尤以AsPC-1、CFPAC-1更为显著,分别是正常细胞的20、18.8倍 (图 1B)。
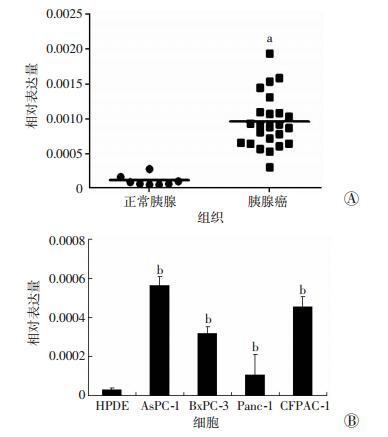
|
| A:在正常胰腺与胰腺癌组织中的表达a: P < 0.01, 与正常胰腺组织比较; B:在正常胰腺细胞与胰腺癌细胞中的表达b: P < 0.01, 与HPDE细胞比较 图 1 LOC100506123在胰腺癌组织及细胞系中的表达 |
2.2 胰腺癌细胞对siRNA片段的有效摄取及干扰效率
在胰腺癌AsPC-1细胞转染FAM-siRNA后,经24 h培养换液后在荧光显微镜下观察显示:细胞状态良好,FAM-siRNA荧光强度高,且均匀分布在细胞内,转染效率约达90%(图 2)。分别在24、48 h收集转染siRNA (NC、siR-1、siR-2、siR-3) 的胰腺癌细胞,提取细胞总RNA后采用qRT-PCR检测LncRNA LOC100506123的干扰效率,结果显示,siR-1、siR-2干扰效率更为明显 (图 3)。
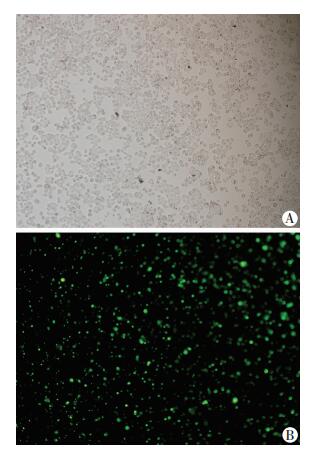
|
| A:白光;B:荧光 图 2 转染FAM-siRNA后24 h胰腺细胞形态 (×100) |
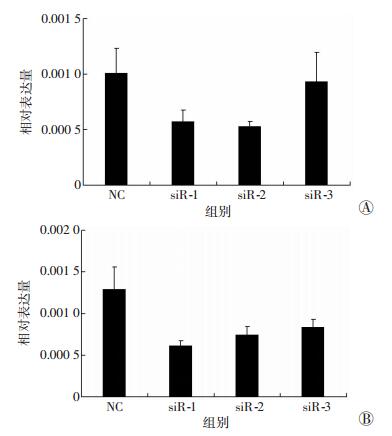
|
| A:24 h;B:48 h 图 3 转染siRNA后不同时间各组胰腺癌细胞LncRNA LOC100506123的表达 |
2.3 干扰LOC100506123表达后对胰腺癌细胞增殖的影响
在胰腺癌细胞系AsPC-1、CFPAC-1中下调LOC100506123表达后,采用CCK-8检测细胞的增殖情况。结果显示,AsPC-1、CFPAC-1的细胞增殖能力明显减弱 (图 4)。
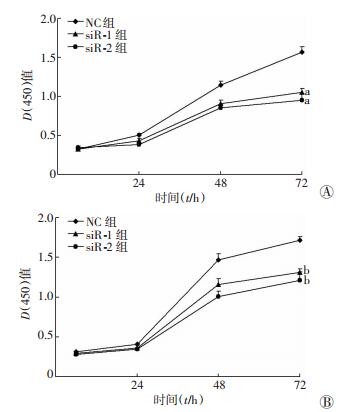
|
| a:P < 0.05, b:P < 0.01, 与NC组比较A:AsPC-1细胞;B:CFPAC-1细胞 图 4 LOC100506123对AsPC-1和CFPAC-1细胞增殖的影响 |
2.4 干扰LOC100506123表达后对胰腺癌细胞迁移的影响
在胰腺癌细胞系AsPC-1、CFPAC-1中下调LOC100506123表达后,采用Transwell检测细胞的迁移情况。结果显示,AsPC-1、CFPAC-1的细胞迁移能力明显减弱 (图 5)。

|
| 图 5 LOC100506123对AsPC-1和CFPAC-1细胞迁移的影响 (HE ×200) |
3 讨论
LncRNA是一类定位于细胞质或细胞核中, 由RNA聚合酶Ⅱ参与合成的, 长度大于200个核苷酸的非编码RNA分子[13]。LncRNA在肿瘤的发生、发展等生物学过程中发挥着重要作用[14-16]。其方式有如下几类:① 通过诱导组蛋白修饰和使染色质发生重构、干扰转录因子与启动子结合等方式直接影响邻近编码基因的表达;② 作为调节因子,通过与靶蛋白结合而影响基因转录;③ 在细胞质中与蛋白结合并影响其定位;④ 通过碱基互补配对,发挥“分子海绵”作用吸附miRNA从而调节生物学功能等[17]。长链非编码RNA在胰腺癌发生发展过程中的作用也有较多探索。Wang等[18]发现,LncRNA HOTTIP-005、XLOC-006390、RP11-567G11.1在胰腺癌中高表达且与临床分期分级密切相关, 可以作为新型的肿瘤标志物。Cheng等[10]研究发现,胰腺癌中高表达LncRNA HOTTIP能通过作用于HOX基因,促进胰腺癌的增殖与侵袭转移。Li等[19]发现,lncRNA NUTF2P3-001可通过抑制miR-3923/KRAS信号通路,促进胰腺癌的发生。可见,关于LncRNA与肿瘤的研究已成为目前的热点之一。
本研究探讨了LncRNA LOC100506123在胰腺癌细胞中的表达情况,以及其对胰腺癌细胞增殖和转移的影响。LncRNA LOC100506123定位于人类染色体2q11.2,长度为717 bp (https://www.ncbi.nlm.nih.gov/nuccore/NR_130704.1)。我们发现LOC100506123在胰腺癌细胞系AsPC-1、BxPC-3、Panc-1、CFPAC-1中高表达,分别是正常胰腺导管上皮细胞系HPDE的20、12、1.97、18.8倍;人胰腺癌细胞系AsPC-1、CFPAC-1分别是从有腹腔多个脏器转移和有肝脏转移的患者获得,二者具有高度的转移特性;而Panc-1与BxPC-1分别来源于仅有局部浸润甚至没有任何转移的患者,转移特性弱。结合本课题组在各细胞系中检测的LncRNA LOC100506123的表达量,发现与它们各自的转移能力相一致。随后,采用siRNA下调AsPC-1、CFPAC-1两株细胞中LOC100506123的表达,能显著抑制肿瘤细胞转移。同时,胰腺癌细胞AsPC-1、CFPAC-1的增殖也显著减弱[20]。总之,本研究证实了LncRNA LOC100506123高表达于胰腺癌中,在促进肿瘤细胞的增殖及迁移方面发挥着重要作用。
| [1] | Abel E V, Simeone D M. Biology and clinical applications of pancreatic cancer stem cells[J]. Gastroenterology, 2013, 144(6): 1241–1248. DOI:10.1053/j.gastro.2013.01.072 |
| [2] | Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] | Hijiya N, Tsukamoto Y, Nakada C, et al. Genomic Loss of DUSP4 Contributes to the Progression of Intraepithelial Neoplasm of Pancreas to Invasive Carcinoma[J]. Cancer Res, 2016, 76(9): 2612–2625. DOI:10.1158/0008-5472.CAN-15-1846 |
| [4] | Xu Y, Chang R, Peng Z, et al. Loss of polarity protein AF6 promotes pancreatic cancer metastasis by inducing Snail expression[J]. Nat Commun, 2015, 6: 7184. DOI:10.1038/ncomms8184 |
| [5] | Li Y, Chen H, Pan T, et al. LncRNA ontology: inferring lncRNA functions based on chromatin states and expression patterns[J]. Oncotarget, 2015, 6(37): 39793–39805. DOI:10.18632/oncotarget.5794 |
| [6] | Silva A, Bullock M, Calin G. The Clinical Relevance of Long Non-Coding RNAs in Cancer[J]. Cancers, 2015, 7(4): 2169–2182. DOI:10.3390/cancers7040884 |
| [7] | Li J, Liu D, Hua R, et al. Long non-coding RNAs expressed in pancreatic ductal adenocarcinoma and lncRNA BC008363 an independent prognostic factor in PDAC[J]. Pancreatology, 2014, 14(5): 385–390. DOI:10.1016/j.pan.2014.07.013 |
| [8] | Di Gesualdo F, Capaccioli S, Lulli M. A pathophysiological view of the long non-coding RNA world[J]. Oncotarget, 2014, 5(22): 10976–10996. DOI:10.18632/oncotarget.2770 |
| [9] | He Y, Meng X M, Huang C, et al. Long noncoding RNAs: Novel insights into hepatocelluar carcinoma[J]. Cancer Lett, 2014, 344(1): 20–27. DOI:10.1016/j.canlet.2013.10.021 |
| [10] | Cheng Y, Jutooru I, Chadalapaka G, et al. The long non-coding RNA HOTTIP enhances pancreatic cancer cell proliferation, survival and migration[J]. Oncotarget, 2015, 6(13): 10840–10852. DOI:10.18632/oncotarget.3450 |
| [11] | Lu Z, Xiao Z, Liu F, et al. Long non-coding RNA HULC promotes tumor angiogenesis in liver cancer by up-regulating sphingosine kinase 1 (SPHK1)[J]. Oncotarget, 2016, 7(1): 241–254. DOI:10.18632/oncotarget.6280 |
| [12] | Ji J, Tang J, Deng L, et al. LINC00152 promotes proliferation in hepatocellular carcinoma by targeting EpCAM via the mTOR signaling pathway[J]. Oncotarget, 2015, 6(40): 42813–42824. DOI:10.18632/oncotarget.5970 |
| [13] |
郭勤浩, 赵岩, 陈洁静, 等. BRAF激活的长链非编码RNA在结直肠癌中的表达及功能[J].
中华消化外科杂志, 2014, 13(5): 376–380.
Guo Q H, Zhao Y, Chen J J, et al. Expression and function of BRAF-activated long non-coding RNA in colorectal cancer[J]. Chin J Dig Surg, 2014, 13(5): 376–380. DOI:10.3760/cma.j.issn.1673-9752.2014.05.011 |
| [14] | Zhao L, Guo H, Zhou B, et al. Long non-coding RNA SNHG5 suppresses gastric cancer progression by trapping MTA2 in the cytosol[J]. Oncogene, 2016, 35(44): 5770–5780. DOI:10.1038/onc.2016.110 |
| [15] | Matsumura K, Kawasaki Y, Miyamoto M, et al. The novel G-quadruplex-containing long non-coding RNA GSEC antagonizes DHX36 and modulates colon cancer cell migration[J]. Oncogene, 2017, 36(9): 1191–1199. DOI:10.1038/onc.2016.282 |
| [16] | Vennin C, Spruyt N, Robin Y M, et al. The long non-coding RNA 91H increases aggressive phenotype of breast cancer cells and up-regulates H19/IGF2 expression through epigenetic modifications[J]. Cancer Lett, 2017, 385: 198–206. DOI:10.1016/j.canlet.2016.10.023 |
| [17] |
吕细林, 黄刚, 肖曼, 等. 过表达长链非编码RNA H19促进miR-124-3p表达抑制肝癌细胞增殖[J].
第三军医大学学报, 2016, 38(6): 554–559.
Lyu X L, Huang G, Xiao M, et al. LncRNA H19-mediated miR-124-3p up-regulation suppresses proliferation in hepatocellular carcinoma cells[J]. J Third Mil Med Univ, 2016, 38(6): 554–559. DOI:10.16016/j.1000-5404.201508089 |
| [18] | Wang Y, Li Z, Zheng S, et al. Expression profile of long non-coding RNAs in pancreatic cancer and their clinical significance as biomarkers[J]. Oncotarget, 2015, 6(34): 35684–35698. DOI:10.18632/oncotarget.5533 |
| [19] | Li X, Deng S J, Zhu S, et al. Hypoxia-induced lncRNA-NUTF2P3-001 contributes to tumorigenesis of pancreatic cancer by derepressing the miR-3923/KRAS pathway[J]. Oncotarget, 2016, 7(5): 6000–6014. DOI:10.18632/oncotarget.6830 |
| [20] | Deer E L, Gonz lez-Hern ndez J, Coursen J D, et al. Phenotype and genotype of pancreatic cancer cell lines[J]. Pancreas, 2010, 39(4): 425–435. DOI:10.1097/MPA.0b013e3181c15963 |



