2. 400037 重庆,第三军医大学新桥医院全军肿瘤研究所
2. Cancer Institute, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China
肝癌是全球常见的恶性肿瘤之一,其恶性程度极高、病情进展迅速、患者预后差,严重威胁着人类的生命健康[1-2]。早期肝癌以肝切除、肝移植为最佳治疗手段,晚期肝癌患者的治疗方法主要有化疗栓塞、放化疗、分子靶向治疗、生物治疗等。尽管临床上发展了许多新的治疗手段和策略,但就目前而言,化疗仍是肝癌最常用的治疗方法。与其他治疗手段相比,化疗所需费用较低,患者更易接受,且适用性较广。临床上常采用经典的化疗方案进行抗肿瘤治疗,其中阿霉素是临床治疗肝癌的常用化疗药物,阿霉素在治疗初期效果较好,肿瘤缩小较明显。但肝癌细胞易对阿霉素产生耐药性,且毒副作用较大。目前,临床常规化疗方案并不能使肿瘤患者的生存率得到很大改善,需要发展新的更有效的肝癌治疗方案。
线粒体作为细胞能量代谢和凋亡途径调控的中心,对肿瘤细胞特殊的能量代谢调控和细胞内源性凋亡调控反应均发挥着重要作用。干扰线粒体功能的药物与阿霉素等化疗药物联合使用可通过影响线粒体功能,激活细胞凋亡相关通路,增强阿霉素的抗肿瘤效应[3-5]。但是其治疗效果仍不理想。新近研究认为异质性肿瘤组织中存在极少量具有自我更新能力和多向分化潜能肿瘤细胞,被命名为“肿瘤干细胞”或“肿瘤干细胞样细胞”,它们对常规化疗药物不敏感,是肿瘤复发、转移的根源。本课题组前期研究发现一种七甲川花菁荧光小分子IR-780具有线粒体靶向性,并对肿瘤细胞具有特异性识别能力,特别是对肿瘤干细胞样细胞具有较强的选择性蓄积能力。同时,IR-780大量蓄积于肿瘤细胞线粒体中,影响线粒体能量代谢和电子传递过程,可促线粒体凋亡途径的发生[6]。在此基础上,本实验将IR-780与常规化疗药物阿霉素联合应用,观察其对肝癌细胞的杀伤作用,特别是对其中干细胞样细胞的杀伤效应,为发展新的临床肝癌治疗方案提供理论依据。
1 材料与方法 1.1 材料人肝癌细胞株HepG2、Huh-7、QGY-7703、SMMC-7721由第三军医大学军事预防医学院全军复合伤研究所保存。DMEM高糖培养基和DMEM/F12培养基购自美国HyClone公司,胎牛血清及B27细胞培养添加剂购自美国Gibco公司,重组人表皮生长因子(rhEGF)和重组人碱性成纤维细胞生长因子(rbFGF)购自美国PeproTech公司,Cell Counting kit-8(CCK-8) 试剂盒购自日本同仁化学研究所,超低吸附细胞培养皿购自美国Corning公司,OCT4兔多克隆抗体购自美国Abcam公司,裸鼠购于本校实验动物中心,Triton X-100购自美国Sigma公司,流式细胞仪为BD FACSVerseTM(美国BD Biosciences公司),倒置荧光显微镜购自德国Leica公司。
1.2 方法 1.2.1 细胞培养HepG2、Huh-7、QGY-7703、SMMC-7721肝癌细胞常规培养于含10%胎牛血清和1%青霉素-链霉素的DMEM高糖培养基中,置于37 ℃、5%CO2细胞培养箱内,取对数生长期细胞传代并进行后续实验。Huh-7细胞悬浮培养方法:采用无血清培养基(含有20 ng/mL rhEGF、20 ng/mL rbFGF和2% B27的DMEM/F12培养基)接种于超低吸附培养皿中,置于37 ℃、5%CO2细胞培养箱内培养,每隔3 d半量更换新鲜培养基,倒置显微镜观察肿瘤细胞球形成情况。收集并机械分离细胞球制成单细胞悬液后进行传代培养。
1.2.2 细胞毒性检测收集贴壁HepG2、Huh-7、QGY-7703、SMMC-7721细胞及Huh-7细胞球,将其吹散制成单细胞悬液,细胞计数后以3 000/孔接种于96孔板,贴壁培养24 h。次日分别向各孔细胞中加入不同浓度的阿霉素溶液(0、0.025、0.050、0.100、0.200、0.400 μmol/L)100 μL和IR-780(0、1.250、2.500、5.000、10.000、20.000 μmol/L)100 μL,每个处理组做3个复孔(单用IR-780组为对照组)。药物处理72 h后,各培养孔中加入10 μL CCK-8工作液,置于细胞培养箱中孵育2 h,酶标仪检测细胞活性,并分别计算阿霉素和IR-780对不同肝癌细胞的半数致死浓度LC50。
1.2.3 迁移实验分别收集贴壁和悬浮的Huh-7细胞,消化制备成单细胞悬液后接种于6孔细胞培养板,每孔加入约5×105个细胞,置于37 ℃、5%CO2细胞培养箱内过夜。次日,待细胞铺满,用100 μL的无菌枪头在6孔板中作平行的2条细胞划痕,PBS清洗细胞3次,洗去脱落的细胞,加入不含血清的正常DMEM高糖培养基。细胞分3组,对照组:加入不含胎牛血清的DMEM高糖培养基;阿霉素组:加入1 mL新鲜配制的0.200 μmol/L阿霉素溶液;IR-780+阿霉素组:加入1 mL新鲜配制的1.250 μmol/L IR-780联合0.200 μmol/L阿霉素的溶液。放入37 ℃、5%CO2细胞培养箱内培养,分别于划痕0、6、12、24 h后显微镜下观察划痕并拍照。
1.2.4 克隆形成实验收集贴壁和悬浮的Huh-7细胞后分别进行细胞计数,按每孔500个细胞接种于6孔板中,每孔加入2 mL含有10%FBS的DMEM培养基,定期换液,在37 ℃、5%CO2条件下培养2周。用PBS液清洗后4%多聚甲醛固定,结晶紫染色液染色10 min,按 > 50个细胞计数克隆形成单位。
1.2.5 细胞周期检测将贴壁和悬浮的Huh-7细胞收集后,PBS液清洗,离心后用75%酒精在4 ℃条件下固定过夜,离心收集细胞,加入含50 μL溴化乙锭(PI)的PBS 500 μg/mL,4 ℃避光孵育30 min。流式细胞仪分别检测两种细胞周期分布情况,并对两种细胞周期分布进行比较分析。
1.2.6 免疫荧光染色收集贴壁生长的Huh-7细胞和悬浮培养的Huh-7细胞球,分离成单细胞悬液后种植于无菌盖玻片上,置于37 ℃、5%CO2细胞培养箱内培养。次日4%多聚甲醛固定15 min,PBS漂洗后用0.2% Triton X-100室温下破膜10 min,山羊工作血清室温封闭30 min后滴加OCT4一抗溶液(1 :100稀释),4 ℃避光孵育过夜。次日,PBS洗涤爬片2遍后滴加AlexaFluor 568标记的山羊抗兔二抗(1 :50稀释),37 ℃避光孵育1 h,PBS洗涤3遍,DAPI室温下染核5 min,再次用PBS洗涤3遍后滴加抗荧光淬灭剂封片,倒置荧光显微镜观察拍照。
1.2.7 裸鼠皮下成瘤实验4~6周龄(雌性,5只)的裸鼠。分别收集贴壁的Huh-7细胞和悬浮的Huh-7细胞球,吹散成单细胞悬液后,以1×105/100 μL细胞悬液(DMEM :Matrigel=1 :1) 分别接种至裸鼠两侧腹部。比较贴壁细胞与悬浮细胞在裸鼠体内的成瘤能力。
1.2.8 体内研究IR-780联合阿霉素对肝癌干细胞样细胞的杀伤作用4~6周龄(雌性,15只)的裸鼠分成3组:对照组、阿霉素组和IR-780+阿霉素组,每组各5只。收集悬浮的Huh-7细胞球,吹散成单细胞悬液,以1×107/100 μL细胞悬液(DMEM :Matrigel=1 :1) 分别接种至裸鼠左右两侧腹部。待肿瘤长出后,分别按单药组2.0 mg/kg阿霉素和联合组0.5 mg/kg IR-780+2.0 mg/kg阿霉素腹腔注入(对照组腹腔注射等体积PBS液),每隔1 d用药,连续注射6次。每2天用卡尺测量移植瘤长径a和短径b,计算小鼠肿瘤体积(V=1/2ab2)。停药2 d后,将小鼠处死,取出皮下肿瘤测量。
1.3 统计学分析采用SPSS 13.0统计软件,数据以x±s表示,计量资料采用单因素方差分析,两组间均数比较采用t检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 IR-780联合阿霉素对肝癌细胞的杀伤效应观察IR-780对不同肝癌细胞的杀伤效应,分别于QGY-7703、SMMC-7721、Huh-7和HepG2 4种肝癌细胞中加入不同浓度的IR-780,CCK-8法检测各孔细胞活性。低浓度的IR-780对4种肝癌细胞杀伤作用较低,其中1.250 μmol/L IR-780几乎无毒性(图 1A)。为研究IR-780的化疗联合效应,将1.250 μmol/L IR-780与不同浓度的阿霉素溶液(0、0.025、0.050、0.100、0.200、0.400 μmol/L)联合使用,比较单用阿霉素及IR-780联合阿霉素对4种肝癌细胞的杀伤作用,并分别计算半数致死浓度LC50。IR-780联合阿霉素对4种肝癌细胞的LC50分别为0.14、0.16、0.13、0.15 μmol/L,均较单用阿霉素的LC50显著降低(P < 0.05,图 1B)。表明IR-780可增强阿霉素的抗肿瘤作用,故后续实验采用1.250 μmol/L IR-780与0.200 μmol/L阿霉素的组合进一步研究其联合效应。细胞划痕实验(图 1C)表明:IR-780联合阿霉素可显著减慢肝癌细胞的迁移速度。上述结果证明了IR-780联合阿霉素可提高对肝癌细胞的杀伤效应,降低肿瘤细胞迁移能力。
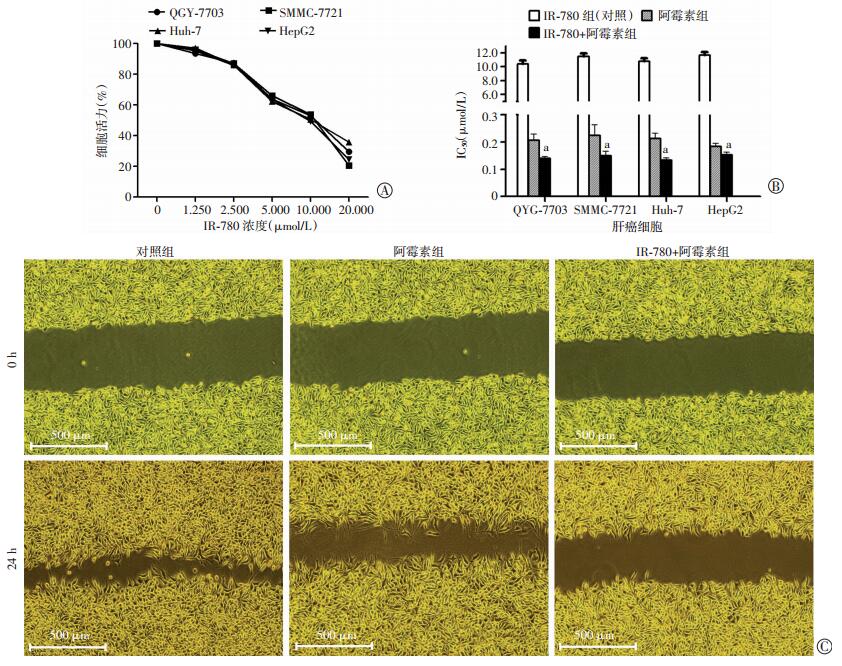
|
| A:CCK-8检测不同浓度IR-780对4种肝癌细胞活力的影响;B:各组细胞半数致死浓度LC50比较 a: P < 0.05,与阿霉素组比较;C:细胞划痕实验检测各组细胞迁移能力 图 1 IR-780联合阿霉素对肝癌细胞的杀伤作用 |
2.2 肝癌干细胞样细胞的培养与鉴定
采用无血清悬浮培养从Huh-7细胞中分离出肝癌干细胞样细胞用于后续实验。与贴壁的Huh-7细胞相比,约第15天Huh-7细胞肿瘤球体完全形成,此后悬浮细胞球的数目逐渐增多(图 2A)。集落形成实验中,与贴壁细胞相比悬浮的Huh-7细胞在相同条件下形成的集落数目更多(图 2B),表明悬浮细胞具有更强的克隆形成能力。如图 2C所示:悬浮细胞中有77.34%的细胞分布于G1期,11.11%的细胞分布在S期,而贴壁细胞中只有60.19%的细胞分布在G1期,34.67%的细胞分布在S期,提示悬浮细胞处于相对静止的细胞周期。干性相关基因OCT4的免疫荧光实验中,与普通贴壁细胞的荧光相比,Huh-7细胞球的荧光强度明显增强(图 2D),表明Huh-7细胞球的OCT4表达水平更高,提示悬浮细胞具有更强的干细胞相关特性。体内荷瘤实验表明:悬浮细胞在裸鼠皮下形成的肿瘤较贴壁细胞更大,具有更强的致瘤能力(图 2E),提示悬浮细胞较贴壁细胞具有更强的干细胞特性。
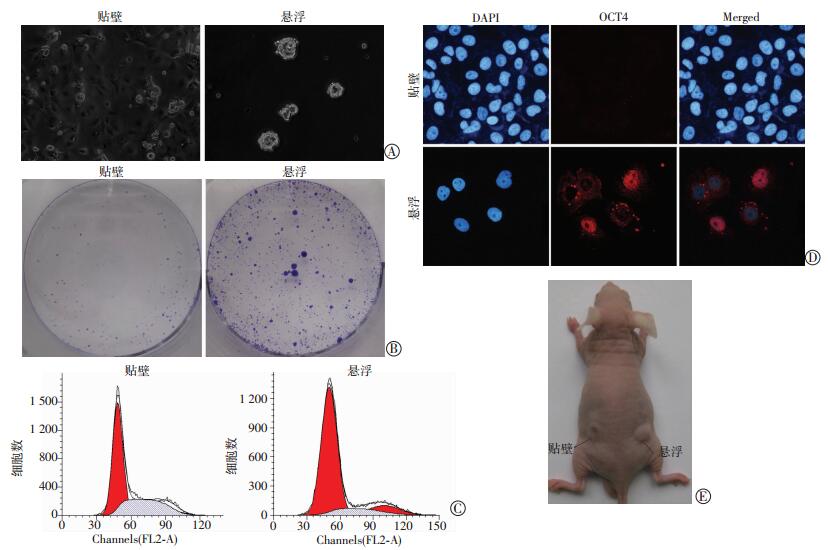
|
| A:贴壁培养与悬浮培养后细胞形态(倒置显微镜×100);B:两种细胞的克隆形成能力;C:两种细胞的周期分布;D:两种细胞OCT4免疫荧光染色(×200);E:两种细胞荷瘤能力比较 图 2 肝癌干细胞样细胞的培养及鉴定 |
2.3 体外实验观测IR-780联合阿霉素对肝癌干细胞样细胞的杀伤效应
采用不同浓度的阿霉素溶液(0、0.025、0.050、0.100、0.200、0.400 μmol/L)及1.250 μmol/L IR-780联合不同浓度的阿霉素处理细胞,观测单用阿霉素和IR-780联合阿霉素对肝癌干细胞样细胞的杀伤作用,并分别计算LC50。结果显示:两组的LC50差异有统计学意义[(0.30±0.02)vs (0.22±0.04)μmol/L,P < 0.05]。表明IR-780联合阿霉素对肝癌干细胞样细胞具有更强的杀伤效应。进一步检测IR-780联合阿霉素对肝癌干细胞样细胞迁移能力的影响,通过细胞划痕实验观察到联合用药24 h可明显减慢肝癌干细胞样细胞的迁移速度(图 3),提示IR-780联合阿霉素可增强抗肝癌干细胞样细胞的效应。
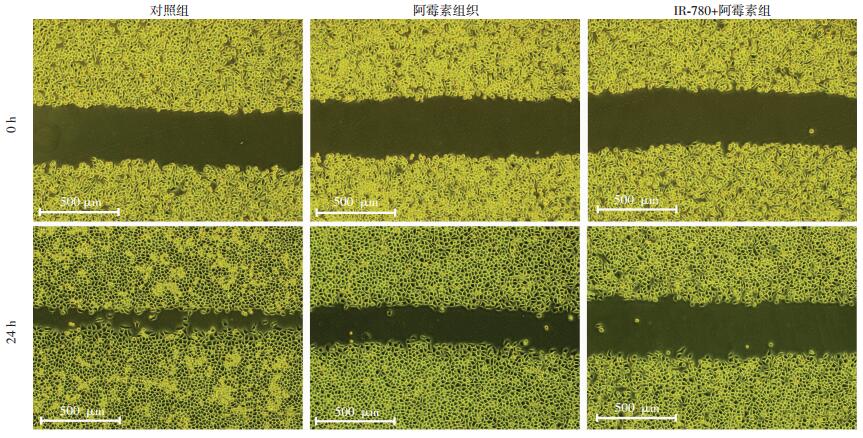
|
| 图 3 细胞划痕实验检测各组细胞迁移能力 |
2.4 体内实验观测IR-780联合阿霉素对肝癌干细胞样细胞的杀伤效应
将悬浮培养的Huh-7细胞球机械分离成单细胞后接种于裸鼠皮下,构建小鼠荷瘤模型。待肿瘤长出后,连续监测肿瘤体积,同时连续对荷瘤裸鼠腹腔注射2.0 mg/kg阿霉素和0.5 mg/kg IR-780联合2.0 mg/kg阿霉素,第12天观察期结束。3组中IR-780联合阿霉素组的肿瘤体积最小(P < 0.05,图 4A)。取出裸鼠肿瘤块,观察结果显示IR-780联合阿霉素组的肿瘤块最小(图 4B)。以上体内实验结果表明:IR-780可增强阿霉素对肝癌干细胞样细胞的杀伤效应。

|
| A:各组裸鼠的肿瘤体积比较 a:P < 0.05,与阿霉素组比较;B:各组裸鼠肿瘤组织块图像 图 4 IR-780联合阿霉素对肿瘤干细胞样细胞的杀伤作用 |
3 讨论
目前,临床上治疗肝癌的常用化疗药有顺铂、氟尿嘧啶、拓扑替康、多西他赛和吉西他滨、蒽环类药物如阿霉素、表阿霉素、羟基喜树碱、丝裂霉素等。其中,阿霉素较为常用,治疗初期效果较好,但患者常出现骨髓抑制、严重的恶心呕吐、心脏毒性等,治疗后期肿瘤常出现耐药。因此,在不增加药物毒副作用的前提下,提高阿霉素抗肿瘤效应是急需解决的问题。研究表明联合化疗与单一用药相比,具有明显的优越性。首先,减轻单一药物剂量过大、时间过长所致药物毒副作用;其次,联合化疗可减少肿瘤细胞耐药的可能性;最后,作用机理不同的药物联合使用,可杀伤异质性不同的肿瘤细胞,增强抗肿瘤效应。因此,本研究将IR-780与阿霉素联合使用,观察两者联合使用对肿瘤的杀伤效应。
研究显示肿瘤组织由异质性的细胞群体组成,其中存在极少量肿瘤细胞,具有正常干细胞相似的特性,即自我更新能力和多向分化潜能。目前,肿瘤干细胞已在白血病、肝癌、肺癌、胶质瘤、乳腺癌等多种肿瘤中得到验证[7-8],并认为肿瘤干细胞能够耐受化疗,是肿瘤复发、侵袭、转移的根源[9-13]。因此,发展一种杀伤肿瘤干细胞的新策略可大大提高治疗肿瘤的效果。当前的研究通常采用表面标记物CD133、CD44、ALDH、EpCAM等进行肿瘤干细胞分选[14-15],然而由于对肿瘤干细胞的认识还不够,缺乏公认的肿瘤干细胞特异性标志物,新的特异性更高的肿瘤干细胞分选方法正在被研究和发现[16-17]。本研究采用无血清悬浮培养的方法从肝癌细胞Huh-7中分离出一群成悬浮球生长的细胞,经鉴定该细胞表达干细胞特异性标志物OCT4,具有更强的自我更新能力和裸鼠皮下成瘤能力等肿瘤干细胞的特性。在无血清悬浮培养的条件下,只有具备干细胞潜能的肿瘤细胞才能长期生存,分化程度较高的细胞则逐渐死亡,经过多次传代之后,仅具备自我更新能力的肿瘤细胞可以生存下来[18]。因此,这一群肿瘤干细胞样细胞已被广泛应用于肿瘤干细胞的鉴定、富集和纯化[19-20]。这为本研究观察IR-780联合阿霉素对肿瘤干细胞的杀伤作用以及探索针对肿瘤干细胞的肿瘤治疗策略提供了基础。
IR-780是一类两端氮杂环中间含有多个次甲基长共轭链的七甲川花菁类近红外荧光小分子。课题组前期研究发现IR-780对肿瘤细胞具有特异性识别能力,包括在多种移植瘤和化学药物诱导成瘤的动物模型中对肿瘤组织均具有良好的靶向成像功能,可实时动态地监测肿瘤的杀伤过程[21-23]。同时,对其中的耐药肿瘤细胞具有更强的选择性蓄积能力,在高剂量条件下对肿瘤细胞具有较强的杀伤效应,能够降低肿瘤的复发和转移。深入研究发现:IR-780特异性蓄积于肿瘤细胞的线粒体中,通过影响线粒体功能,诱导线粒体凋亡相关信号通路引起肿瘤细胞死亡[6]。由于该分子具有较强的肿瘤靶向作用,特别是对其中的耐药肿瘤细胞具有更强的蓄积能力,本研究将IR-780与化疗药物阿霉素联合使用,观察其对肝癌干细胞样细胞的协同杀伤效应。结果表明:IR-780可显著增强阿霉素对肝癌细胞及肝癌干细胞样细胞的杀伤作用,进一步证实了IR-780联合阿霉素可明显降低肝癌干细胞样细胞迁移能力和裸鼠皮下成瘤能力。IR-780联合阿霉素较单药阿霉素具有更强的抗肿瘤疗效,该方法为提高肿瘤疗效及杀伤肿瘤干细胞提供了可能的研究途径。目前,关于IR-780增强肝癌干细胞样细胞对阿霉素的杀伤机制正在进行深入探讨。下一步可对IR-780联合化疗药物对不同类型肿瘤干细胞的杀伤作用进行研究。
| [1] | El-Serag H B. Hepatocellular carcinoma[J]. N Engl J Med, 2011, 365(12): 1118–1127. DOI:10.1056/NEJMra1001683 |
| [2] | Oikawa T. Cancer Stem cells and their cellular origins in primary liver and biliary tract cancers[J]. Hepatology, 2016, 64(2): 645–651. DOI:10.1002/hep.28485 |
| [3] | Liu X D, Sun H, Liu G T. 5-Bromotetrandrine enhances the sensitivity of doxorubicin-induced apoptosis in intrinsic resistant human hepatic cancer Bel7402 cells[J]. Cancer Lett, 2010, 292(1): 24–31. DOI:10.1016/j.canlet.2009.11.001 |
| [4] | Yang L, Liu X, Lu Z, et al. Ursolic acid induces doxorubicin-resistant HepG2 cell death via the release of apoptosis-inducing factor[J]. Cancer Lett, 2010, 298(1): 128–138. DOI:10.1016/j.canlet.2010.06.010 |
| [5] | Qian H, Yang Y, Wang X. Curcumin enhanced adriamycin-induced human liver-derived Hepatoma G2 cell death through activation of mitochondria-mediated apoptosis and autophagy[J]. Eur J Pharm Sci, 2011, 43(3): 125–131. DOI:10.1016/j.ejps.2011.04.002 |
| [6] | Wang Y, Liu T, Zhang E, et al. Preferential accumulation of the near infrared heptamethine dye IR-780 in the mitochondria of drug-resistant lung cancer cells[J]. Biomaterials, 2014, 35(13): 4116–4124. DOI:10.1016/j.biomaterials.2014.01.061 |
| [7] | Huntly B J, Gilliland D G. Leukaemia stem cells and the evolution of cancer-stem-cell research[J]. Nat Rev Cancer, 2005, 5(4): 311–321. DOI:10.1038/nrc1592 |
| [8] | Visvader J E, Lindeman G J. Cancer stem cells in solid tumours: accumulating evidence and unresolved questions[J]. Nat Rev Cancer, 2008, 8(10): 755–768. DOI:10.1038/nrc2499 |
| [9] | Gao J, Li W, Guo Y, et al. Nanomedicine strategies for sustained, controlled and targeted treatment of cancer stem cells[J]. Nanomedicine (Lond), 2016, 11(24): 3261–3282. DOI:10.2217/nnm-2016-0261 |
| [10] | Eramo A, Lotti F, Sette G, et al. Identification and expansion of the tumorigenic lung cancer stem cell population[J]. Cell Death Differ, 2008, 15(3): 504–514. DOI:10.1038/sj.cdd.4402283 |
| [11] | McKenzie J L, Takenaka K, Gan O I, et al. Lowrhodamine123 retention identifies long-term human hematopoietic stem cell swithin the Lin-CD34+CD38- population[J]. Blood, 2007, 109(2): 543–545. DOI:10.1182/blood-2006-06-030270 |
| [12] | Miranda-Lorenzo I, Dorado J, Lonardo E, et al. Intracellular autofluorescence:abiomarker for epithelial cancer stem cells[J]. Nat Methods, 2014, 11(11): 1161–1169. DOI:10.1038/nmeth.3112 |
| [13] | Ponti D, Costa A, Zaffaroni N, et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties[J]. Cancer Res, 2005, 65(13): 5506–5511. DOI:10.1158/0008-5472.CAN-05-0626 |
| [14] | Fitzgerald T L, McCubrey J A. Pancreatic cancer stem cells: association with cell surface markers, prognosis, resistance, metastasis and treatment[J]. Adv Biol Regul, 2014, 56(3): 45–50. DOI:10.1016/j.jbior.2014.05.001 |
| [15] | Shao J, Fan W, Ma B, et al. Breast cancer stem cells expressing different stem cell markers exhibit distinct biological characteristics[J]. Mol Med Rep, 2016, 14(6): 4991–4998. DOI:10.3892/mmr.2016.5899 |
| [16] | Magee J A, Piskounova E, Morrison S J. Cancer stem cells: impact, heterogeneity, and uncertainty[J]. Cancer Cell, 2012, 21(3): 283–296. DOI:10.1016/j.ccr.2012.03.003 |
| [17] | Wang J, Li Z H, White J, et al. Lung cancer stem cells and implications for future therapeutics[J]. Cell Biochem Biophys, 2014, 69(3): 389–398. DOI:10.1007/s12013-014-9844-4 |
| [18] |
赵笛, 郑青. 悬浮培养在肿瘤干细胞研究中的应用及局限[J].
肿瘤, 2012, 32(7): 559–563.
Zhao D, Zheng Q. The application and limitation of suspension culture in the study of neoplastic stem cells[J]. Tumor, 2012, 32(7): 559–563. DOI:10.3781/j.issn.1000-7431.2012.07.015 |
| [19] | Zhang L, Jiao M, Li L, et al. Tumorspheres derived from prostate cancer cells possess chemoresistant and cancer stem cell properties[J]. JCancer Res Clin Oncol, 2012, 138(4): 675–686. DOI:10.1007/s00432-011-1146-2 |
| [20] | Miranda-Lorenzo I, Dorado J, Lonardo E, et al. Intracellular autofluorescence:abiomarker for epithelial cancer stem cells[J]. Nat Methods, 2014, 11(11): 1161–1169. DOI:10.1038/nmeth.3112 |
| [21] | Zhang E, Luo S, Tan X, et al. Mechanistic study of IR-780 dye asapotential tumor targeting and drug delivery agent[J]. Biomaterials, 2014, 35(2): 771–778. DOI:10.1016/j.biomaterials.2013.10.033 |
| [22] | Tan X, Luo S, Wang D, et al. A NIR heptamethine dye with intrinsic cancer targeting, imaging and photosensitizing properties[J]. Biomaterials, 2012, 33(7): 2230–2239. DOI:10.1016/j.biomaterials.2011.11.081 |
| [23] | Zhang C, Liu T, Su Y, et al. A near-infrared fluorescent heptamethine indocyanine dye with preferential tumor accumulation for in vivo imaging[J]. Biomaterials, 2010, 31(25): 6612–6617. DOI:10.1016/j.biomaterials.2010.05.007 |



