坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是新生儿期常见且极为严重的胃肠道急症,在出生体质量低于1 500 g的早产儿中发病率达7%,病死率可达20%~30%[1]。研究发现,NEC虽是肠道的炎症性疾病,但常常与败血症、全身炎症反应综合征(SIRS)、休克等全身炎症性疾病伴发[2-5]。目前国内外对其进行了大量研究,但其发病机制仍不明确。细胞焦亡(pyroptosis)是近年新发现的一种程序性的细胞死亡方式,其特征为依赖于半胱天冬酶-1(Caspase-1) 的激活,同时伴有大量促炎症因子(包括IL-1β、IL-18) 的释放[6-8]。由Nod样受体热蛋白结构域相关蛋白3(nucleotide binding oligomerization domain-like receptor family pyrin domain containing 3,NLRP3) 形成的NLRP3炎性小体介导的Caspase-1的激活是非常重要,并且是目前研究最为广泛的一个信号轴。既然细胞焦亡是伴有炎症反应发生的程序性的细胞死亡方式,而NEC又是一种公认的炎症性疾病,那么,细胞焦亡是否参与了NEC的发病,至今尚少见相关报道。本实验建立NEC大鼠模型,检测NLRP3、Caspase-1及相关炎症介质水平,探讨NEC疾病中是否有焦亡现象发生并分析其可能的作用机制,以期为进一步揭示NEC的发病机制及其治疗方法提供新思路。
1 材料与方法 1.1 主要材料50只清洁级新生1 d的SD大鼠,雌雄不限,体质量5~7 g(重庆医科大学动物中心),雅培婴幼儿奶粉(雅培公司,美国),贝克幼犬奶粉(贝克公司,美国),组织RNA提取试剂盒(QIAGEN公司,德国),逆转录试剂盒(TaKaRa,日本),PVDF膜(Bio-Rad公司,美国),脱脂奶粉(BD公司,美国),兔抗大鼠Caspase-1抗体、山羊抗兔二抗(Abcam公司,英国),ECL增强化学发光检测试剂盒(Pierce公司,美国),IL-1β ELISA检测试剂盒(武汉优尔森科技有限公司,中国)、IL-18 ELISA检测试剂盒(武汉伊莱瑞特生物科技有限公司,中国)。
1.2 方法 1.2.1 实验动物分组及处理50只新生1 d的SD大鼠按随机数字表法分成2组:正常对照组、坏死性小肠结肠炎新生大鼠组(NEC组),每组25只。正常对照组:与母鼠同笼,鼠乳喂养,不予处理。NEC组:与母鼠分开,人工喂养+缺氧、冷刺激,以建立新生鼠NEC动物模型[9]。具体建模方法:新生1 d的SD大鼠放置在自制保育箱内,控制保育箱内温度(36±1)℃,湿度45%~60%。根据文献[10-11]报道配制代乳品,经口插入PICC管灌胃喂养。第1天喂养量为0.1 mL/次,每4小时喂养1次,以后每24小时增加0.1~0.15 mL。将新生鼠放入自制的缺氧箱内,向箱内充入纯氮(N2),控制N2流量为10 L/min,当测氧仪测得箱内O2浓度降为零时开始计时,10 min后关闭阀门并将新生鼠取出。5 min后立即将其置于4 ℃冰箱中刺激10 min。缺氧、冷刺激分别于每日早晚8点各进行1次,连续3 d。
1.2.2 大鼠一般状况及体质量变化严密观察大鼠一般状况,有无腹胀、腹泻,血便、黑便,活动是否良好等,并于每日固定时间点测量并记录其体质量。
1.2.3 大鼠肠组织大体形态、病理学形态观察及病理损伤评分各组大鼠于第4天空腹后断头处死,打开腹腔,取出十二指肠下端至回盲部肠管,肉眼观察有无肠腔积气、出血、坏死等NEC样病变。取回盲部近端1~2 cm肠组织,立即固定于4%多聚甲醛溶液中,石蜡包埋、切片、HE染色,光镜下观察肠组织病理学变化并进行组织损伤评分。参照DVORAK等[12]报道的标准,采用双盲法进行肠组织损伤评分, 评分≥2分确定为NEC。每例组织标本观察3个视野,取其平均值。
1.2.4 实时荧光定量PCR检测NLRP3、IL-1β、IL-18 mRNA水平从-80 ℃取出冻存的肠组织,提取总RNA,所有步骤严格按照RNA提取试剂盒(Invitrogen公司,美国)说明书操作。测定每个样本RNA浓度后,按照逆转录试剂盒步骤说明将RNA逆转录为cDNA,然后以cDNA为模板,在CFX90荧光PCR扩增仪上进行NLRP3、IL-1β、IL-18 mRNA扩增。RT-PCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,56 ℃退火5 s,65 ℃延伸5 s,共39个循环。采用2-ΔΔCt(ΔCt=目的基因Ct值-内参Ct值)进行目的基因相对表达量分析。实验以β-actin为内参,β-actin上游引物:5′-TGACAGGATGCAGAAGGAGA-3′,下游引物:5′-TAGAGCCACCAATCCACACA-3′,片段大小106 bp;NLRP3上游引物:5′-GCTGCTCAGCTCTGACCTCT-3′,下游引物:5′-AGGTGAGGCTGCAGTTGTCT-3′,片段大小146 bp;IL-1β上游引物:5′-CACCTCTCAAGCAGAGCACAG-3′,下游引物:5′-GGGTTCCATGGTGAAGTCAAC-3′,片段大小83 bp;IL-18上游引物:5′-ACCGCAGTAATACGGAGCAT-3′,下游引物:5′-TAGGGTCACAGCCAGTCCTC-3′,片段大小168 bp。
1.2.5 Western blot检测Caspasee-1的表达及激活情况取出冻存于-80 ℃的肠组织,按照100 mg组织加入600 μL NP40裂解液的比例加入组织和裂解液,并加入相应体积蛋白酶抑制剂PMSF后进行组织匀浆,4 ℃ 14 000×g离心10 min,提取胞浆总蛋白,BCA法测定蛋白浓度。取40 μg总蛋白进行凝胶电泳,湿法电转印至PVDF膜,用5%脱脂奶粉封闭2 h后孵育抗体,一抗(抗Caspase-1抗体稀释浓度为1 :500,抗GAPDH抗体稀释浓度为1 :1 000),4 ℃孵育过夜,山羊抗兔二抗(稀释浓度为1 :1 000),室温孵育1.5 h,洗膜后ECL法发光显影。最后用UVP凝胶图像处理系统Labworks 4.6软件进行图像分析,以目的条带与内参条带灰度值的比值衡量蛋白表达的多少,比值越高,表明该目标蛋白表达越多。
1.2.6 ELISA检测肠组织IL-1β、IL-18水平取-80 ℃冻存的肠组织,按照100 mg组织加入500 μL组织裂解液的比例加入组织及裂解液,同时加入相应体积的蛋白酶抑制剂PMSF,组织匀浆,4 ℃ 5 000×g离心10 min,取上清液,保存于-20 ℃。采用酶联免疫吸附试验测定IL-1β、IL-18水平,严格按照试剂盒说明书操作。
1.3 统计学方法采用SPSS 22.0统计软件,计量资料采用x±s表示,正态方差齐性资料组间比较采用独立样本t检验,正态方差不齐组间比较采用Mann-Whitney检验。
2 结果 2.1 大鼠一般状况及体质量变化情况从建模第2天开始,NEC组出现明显的胃潴留、腹胀、喂养困难、活动减少、倦怠懒动,甚至黑便、血便,体质量明显降低[(6.20±0.55) g vs (4.87±0.25) g];而正常对照组则生长发育良好,进食及排便正常,活动正常,皮下脂肪丰满,体质量明显增加[(6.23±0.35) g vs (8.30±0.33) g]。
2.2 大鼠肠组织大体形态、病理学形态及病理损伤评分肉眼观察显示:正常对照组大鼠肠管颜色呈淡黄色,肠曲形态自然,弹性佳,无积气、出血、水肿等改变(图 1A)。NEC组大鼠肠组织呈黑红色改变,充血、水肿,肠腔明显积气、扩张,肠壁变薄,肠管僵直,肠曲形态不自然,严重者可有串珠样改变(图 1B)。光镜下观察可见:正常对照组肠组织结构清晰完整,上皮细胞排列整齐,绒毛高耸,肌层较厚,黏膜层、黏膜下层及固有层均未见明显的充血水肿或断裂分离(图 2A)。而NEC组肠上皮细胞排列紊乱,绒毛变性水肿、参差不齐,部分绒毛坏死、脱落或消失,肌层变薄甚至断裂,黏膜层、黏膜下层及固有层可见明显的分离水肿,甚至可见明显的积气及充血改变(图 2B)。双盲法光镜下肠组织病理损伤评分:NEC组肠组织损伤评分(3.13±0.69) 明显高于正常对照组(0.44±0.56),差异有统计学意义(P<0.05)。
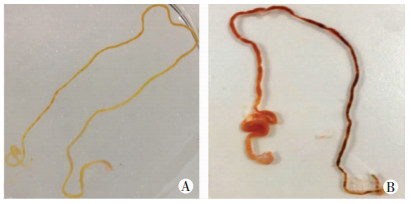
|
| A:正常对照组;B:坏死性小肠结肠炎新生大鼠组 图 1 两组大鼠肠组织肉眼观察 |
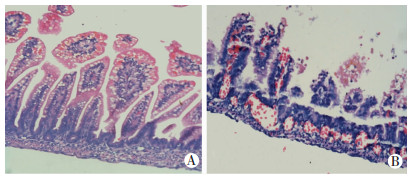
|
| A:正常对照组;B:坏死性小肠结肠炎新生大鼠组 图 2 两组大鼠肠组织病理形态学观察(HE ×200) |
2.3 qPCR检测NLRP3、IL-1β及IL-18基因水平
与正常对照组相比,NEC组大鼠的NLRP3(0.33± 0.16 vs 1.11±0.25)、IL-1β(0.40±0.15 vs 1.25±0.13) 及IL-18 mRNA(1.04±0.16 vs 2.35±0.17) 水平均表达增高(P<0.05)。
2.4 Western blot检测Caspase-1的表达及激活情况与正常对照组相比,NEC组Caspase-1前体的表达量有所降低,而其激活态P20及P10则几乎仅在NEC组中表达(图 3A),半定量分析结果显示差异有统计学意义(P<0.05,图 3B)。

|
| A: Western blot检测1~4:正常对照组,5~9:NEC组;B:半定量分析a:P<0.05,b:P<0.01,与正常对照组比较 图 3 Western blot法检测Caspase-1激活情况 |
2.5 ELISA检测肠组织IL-1β、IL-18水平
与qPCR检测结果一致,肠组织匀浆的ELISA法检测结果亦是NEC组的IL-1β及IL-18水平高于正常对照组(74.4±17.5 vs 300.4±76.5,23.9±19.3 vs 214.4±28.1),差异有统计学意义(P<0.01)。
3 讨论早在2001年,COOKSON等[13]就首次使用“Pyroptosis”来形容在巨噬细胞中发现的Caspase-1依赖的细胞死亡方式,但并未引起大家的注意。直到2014年Doitsh等[6]在HIV感染患者体内发现大量CD4+ T细胞“无辜死去”的现象并进一步研究指出细胞焦亡可能是这一现象的“元凶”后,细胞焦亡才成为人们关注的焦点。大量研究表明,细胞焦亡参与了许多疾病的发生发展,例如各种感染性疾病、心力衰竭、糖尿病、痛风、阿尔兹海默病、急性肾损伤等[14-16]。但关于细胞焦亡是否参与NEC这一复杂疾病的发病,目前尚少见相关报道。
本实验采用缺氧、冷刺激及人工喂养的方式建立NEC的动物模型,检测焦亡相关指标,探究细胞焦亡是否参与了NEC的发病,并分析其可能的作用机制。结果发现,NEC组大鼠在体质量、一般情况、肠道病理损伤等方面均明显区别于正常对照组,说明模型建立成功[17]。在焦亡相关指标方面,首先需明确的是,细胞焦亡与我们熟知的细胞凋亡在细胞形态学、发生机制及生物学效应方面均有明显不同。细胞发生凋亡时,凋亡细胞的内容物被膜包裹形成凋亡小体,在体内被吞噬细胞非炎症性吞噬和清除,该过程依赖于Caspase-3、Caspase-8、Caspase -9的活化,而细胞焦亡,则依赖于Caspase-1的活化[15]。初合成的Caspase-1以无活性的前体形式存在,研究表明,胞内多蛋白复合物炎性小体(inflammasome)可调控Caspase-1前体裂解为具有酶活性的P20及P10。简单来说,炎性小体是由胞内模式识别受体即NOD样受体(NOD’like receptor, NLR)、凋亡相关点样蛋白(ASC)及Caspase-1前体蛋白组成。其中由NLRP3支架、ASC、Caspase-1组成的NLRP3炎性小体是目前研究最为广泛且极为重要的炎性小体,可被多种微生物如细菌RNA、细菌RNA双链类似物、LPS及各种胞内分子(尿酸盐结晶、成孔毒素、ATP等)激活。本研究发现NLRP3炎性小体的mRNA表达在NEC组中明显高于正常对照组,且Caspase-1的激活态P20、P10仅在NEC组中有表达,均表明NEC组中存在显著的焦亡增加现象。另外我们观察到Caspase-1前体在正常对照组及NEC组中均有表达但在正常对照组中表达更为明显,这是由于在NEC组中部分Caspase-1前体裂解为其激活态从而导致NEC组中Caspase-1前体含量降低。活化的Caspase-1可将无活性的IL-1β及IL-18前体裂解为具有活性的IL-1β及IL-18并介导其分泌至胞外发挥相应的生物学效应[15]。本研究发现,不论是IL-1β及IL-18的基因水平还是其蛋白水平,均是NEC组明显高于正常对照组。众所周知,IL-1β、IL-18是常见的促炎症因子,能募集、激活其他免疫细胞,诱导其他炎症介质,放大局部和全身炎症反应,我们推测这可能是细胞焦亡引发NEC的作用机制。另有相关研究报道指出,在炎症肠病(inflammatory bowel disease,IBD)患者体内或葡聚糖硫酸钠(DSS)诱导的结肠炎模型中,IL-1β、IL-18水平亦明显高于正常对照组,并有研究指出NLRP3炎性小体可能参与了这些疾病的发病[18-20]。上述研究结果与本研究有相似之处,IBD与NEC也都是肠道的炎症性疾病,但其发病多在成人,两者发病机制仍有较大不同,而且通过加入DSS诱导建立成年大鼠溃疡性结肠炎的动物模型与本研究所采用的目前公认的NEC建模方法有本质区别。
综上所述,本实验成功建立NEC动物模型并检测NLRP3、Caspase-1前体及激活态、IL-1β、IL-18等细胞焦亡相关指标,得出细胞焦亡参与NEC的发病,并指出IL-1β及IL-18的促炎性作用是其可能的作用机制,为揭示NEC这一复杂疾病的发病机制及治疗提供了一定的理论基础。但NLRP3是通过怎样的途径被激活以及能否通过加入Caspase-1抑制剂来阻断Caspase-1的激活或通过添加IL-1β、IL-18受体阻断剂来达到治疗NEC的目的,仍需进一步的研究。
| [1] | LIM J C, GOLDEN J M, FORD H R. Pathogenesis of neonatal necrotizing enterocolitis[J]. Pediatr Surg Int, 2015, 31(6): 509–518. DOI:10.1007/s00383-015-3697-9 |
| [2] | LEVITON A, DAMMANN O, ENGELKE S, et al. The clustering of disorders in infants born before the 28th week of gestation[J]. Acta Paediatr, 2010, 99(12): 1795–1800. DOI:10.1111/j.1651-2227.2010.01973.x |
| [3] | WU S F, CAPLAN M, LIN H C. Necrotizing enterocolitis: old problem with new hope[J]. Pediatr Neonatol, 2012, 53(3): 158–163. DOI:10.1016/j.pedneo.2012.04.001 |
| [4] | BIZZARRO M J, EHRENKRANZ R A, GALLAGHER P G. Concurrent bloodstream infections in infants with necrotizing enterocolitis[J]. J Pediatr, 2014, 164(1): 61–66. DOI:10.1016/j.jpeds.2013.09.020 |
| [5] | BERRINGTON J E, STEWART C J, CUMMINGS S P, et al. The neonatal bowel microbiome in health and infection[J]. Curr Opin Infect Dis, 2014, 27(3): 236–243. DOI:10.1097/QCO.0000000000000061 |
| [6] | DOITSH G, GALLOWAY N L, GENG X, et al. Cell death by pyroptosis drives CD4 T-cell depletion in HIV-1 infection[J]. Nature, 2014, 505(7484): 509–514. DOI:10.1038/nature12940 |
| [7] | GALLUZZI L, LóPEZ-SOTO A, KUMAR S, et al. Caspases Connect Cell-Death Signaling to Organismal Homeostasis[J]. Immunity, 2016, 44(2): 221–231. DOI:10.1016/j.immuni.2016.01.020 |
| [8] | SHALINI S, DORSTYN L, DAWAR S, et al. Old, new and emerging functions of caspases[J]. Cell Death Differ, 2015, 22(4): 526–539. DOI:10.1038/cdd.2014.216 |
| [9] | QUINTANILLA H D, LIU Y, FATHEREE N Y, et al. Oral administration of surfactant protein-a reduces pathology in an experimental model of necrotizing enterocolitis[J]. J Pediatr Gastroenterol Nutr, 2015, 60(5): 613–620. DOI:10.1097/MPG.0000000000000678 |
| [10] | YU X, RADULESCU A, ZORKO N, et al. Heparin-Binding EGF-Like Growth Factor Increases Intestinal Microvascular Blood Flow in Necrotizing Enterocolitis[J]. Gastroenterology, 2009, 137(1): 221–230. DOI:10.1053/j.gastro.2009.03.060 |
| [11] | GONçALVES F L, SOARES L M, FIGUEIRA R L, et al. Evaluation of the expression of Ⅰ-FABP and L-FABP in a necrotizing enterocolitis model after the use of Lactobacillus acidophilus[J]. J Pediatr Surg, 2015, 50(4): 543–549. DOI:10.1016/j.jpedsurg.2014.07.007 |
| [12] | DVORAK B, KHAILOVA L, CLARK J A, et al. Comparison of epidermal growth factor and heparin-binding epidermal growth factor-like growth factor for prevention of experimental necrotizing enterocolitis[J]. J Pediatr Gastroenterol Nutr, 2008, 47(1): 11–18. DOI:10.1097/MPG.0b013e3181788618 |
| [13] | COOKSON B T, BRENNAN M A. Pro-inflammatory programmed cell death[J]. Trends Microbiol, 2001, 9(3): 113–114. DOI:10.1016/s0966-842x(00)01936-3 |
| [14] | ZHOU K, SHI L, WANG Y, et al. Recent Advances of the NLRP3 Inflammasome in Central Nervous System Disorders[J]. J Immunol Res, 2016, 2016: 9238290. DOI:10.1155/2016/9238290 |
| [15] |
林静, 李大主. 细胞焦亡:一种新的细胞死亡方式[J].
国际免疫学杂志, 2011, 34(3): 213–216.
LIN J, LI D Z. Pyroptosis: a caspase-1-dependent cell death[J]. Inter J Immunol, 2011, 34(3): 213–216. DOI:10.3760/cma.j.issn.1673-4394.2011.03.013 |
| [16] |
陈雨, 侯卫平, 袁发焕. 动力相关蛋白-1在缺氧/复氧诱导人肾小管上皮细胞焦亡机制中的作用[J].
第三军医大学学报, 2016, 38(11): 1251–1256.
CHEN Y, HOU W P, YUAN F H. Role of dynamin-related protein 1 in hypoxia /reoxygenation-induced human renal tubular epithelial cell pyroptosis[J]. J Third Mil Med Univ, 2016, 38(11): 1251–1256. DOI:10.16016/j.1000-5404.201511131 |
| [17] |
宋朝敏, 王红, 吴斌, 等. 新生鼠坏死性小肠结肠炎动物模型建立及评价[J].
中国新生儿科杂志, 2007, 22(5): 280–284.
SONG C M, WANG H, WU B, et al. Establishment and evaluation of necrotizing enterocolitis model in neonatal rat[J]. Chin J Neonatol, 2007, 22(5): 280–284. DOI:10.3969/j.issn.1673-6710.2007.05.008 |
| [18] | ZHANG H, GONG C, QU L, et al. Therapeutic effects of triptolide via the inhibition of IL-1β expression in a mouse model of ulcerative colitis[J]. Exp Ther Med, 2016. DOI:10.3892/etm.2016.3490 |
| [19] | HEDL M, ZHENG S, ABRAHAM C. The IL18RAP region disease polymorphism decreases IL-18RAP/IL-18R1/IL-1R1 expression and signaling through innate receptor-initiated pathways[J]. J Immunol, 2014, 192(12): 5924–5932. DOI:10.4049/jimmunol.1302727 |
| [20] | TIAN Z, LIU Y, YANG B, et al. Astagalus polysaccharide attenuates murine colitis through inhibiton of the NLRP3 inflammasome[J]. Planta Med, 2017, 83(1-02): 70–77. DOI:10.1055/s-0042-108589 |



