糖尿病肾病(diabetic nephropathy,DN)作为糖尿病的主要并发症之一,是目前导致终末期肾脏病的首要病因[1]。以间质炎症及肾小管萎缩、纤维化为主要特征的小管间质损害是DN发生发展的重要病理生理基础[2-3]。Parkin是一种E3泛素连接酶,可调控炎症因子分泌、抑制纤维化等,在糖尿病心肌病、神经病变等多种糖尿病并发症中扮演重要角色[4-6]。目前Parkin在DN中的表达变化规律及其与疾病进展的关系尚不清楚。本研究拟通过观察DN患者肾组织中Parkin的表达变化及其与肾组织结构和功能损伤的关系,为进一步探讨其在DN进展中的作用打下基础。
1 对象与方法 1.1 临床资料选取2015-2016年我院收治的40例2型糖尿病并经肾活检病理检查确诊的DN患者,包括男性22例,女性18例。排除DN合并IgA肾病、膜性肾病、局灶节段硬化性肾小球肾炎等其他肾病,以及恶性肿瘤、病毒性肝炎、结核等疾病患者。选取10例肾肿瘤切除术后经病理诊断为正常肾组织的患者作为对照组,包括男性4例,女性6例。纳入患者均签署知情同意书。收集两组年龄、性别、体质量指数(BMI)、收缩压(SBP)、舒张压(DBP)等临床资料。采集肾活检或手术前1 d患者的血尿标本,按生化方法测定患者血肌酐(Scr)、尿酸(UA)、尿素氮(BUN)、血清胱抑素C(Cyc)、血清白蛋白(Alb)、血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)、糖化血红蛋白(HbA1c)、血糖(Glu)、C反应蛋白(CRP)、尿蛋白定量、尿N-乙 酰-β-氨基葡萄糖苷酶(NAG),并根据CKD-EPI公式计算肾小球滤过率(estimated glomerular filtration,eGFR)。本研究经过我院伦理委员会讨论批准(2016年)。
1.2 主要试剂和仪器鼠抗人Parkin抗体购自美国Santa Cruz公司,兔抗人IL-6、Col-Ⅳ抗体购自美国Abcam公司,兔抗人TGF-β抗体购自美国Proteintech公司,抗小鼠或兔通用性免疫组化二步法检测试剂盒购自丹麦Dako公司,封闭用山羊血清购自北京中山金桥公司,FITC标记山羊抗鼠、Cy3标记山羊抗兔IgG购自上海碧云天公司,LEICA DM1000显微镜购自Leica公司。
1.3 肾组织肾小管上皮细胞Parkin与肾间质炎症因子IL-6、促纤维化因子TGF-β及间质纤维化标志Col-Ⅳ表达的检测肾组织经过常规甲醛固定石蜡包埋,切片厚度为2 μm。采用免疫组化二步法染色,常规过氧化氢、山羊血清封闭,一抗为小鼠抗人Parkin抗体(1 :100)。细胞膜和/或细胞质呈棕黄色为Parkin表达阳性细胞。随机选取10个高倍视野对Parkin表达阳性的肾小管进行计数,计算肾小管上皮细胞Parkin表达的阳性率。免疫荧光染色检测Parkin与IL-6、TGF-β及Col-Ⅳ的表达关系:一抗为小鼠抗人Parkin分别与IL-6、TGF-β、Col-Ⅳ的混合液,二抗为FITC标记羊抗小鼠(1 :50)与Cy3标记羊抗兔(1 :50)混合液。采用激光共聚焦显微镜检测肾小管细胞Parkin与IL-6、TGF-β、Col-Ⅳ的表达。
1.4 病理损伤评分参考2010年《美国肾脏病杂志》针对DN肾间质的新型病理分级系统进行病理损伤评分[7]。肾小管萎缩与间质纤维化(interstitial fibrosis and tubular atrophy,IFTA)评分:0分,无IFTA;1分,病变范围<25%; 2分,病变范围25%~50%;3分,病变范围>50%。间质炎症:0分,无间质炎症;1分,与IFTA相关的炎性浸润;2分,无IFTA区域也存在炎性浸润。肾小球评分依据肾小球硬化程度:0分,无肾小球硬化;1分,小球硬化≤25%;2分,小球硬化26%~50%;3分,小球硬化>50%。每张切片在低倍(100倍)视野下随机选取10个视野,由两名与本研究无关人员进行病理损伤评分,取其平均值。
| 组别 | n | 年龄(岁) | BMI | SBP(mmHg) | DBP(mmHg) | Alb(g/L) | HA1c(%) | Glu(mmol/L) | 尿酸(μmol/L) | CRP(mg/L) | TG(mmol/L) | TC(mmol/L) | HDL(mmol/L) | LDL (mmol/L) | 尿蛋白定量(g/d) | 尿NAG(U/L) | 尿素氮(mmol/L) | 胱抑素C (mg/L) | 血肌酐(μmol/L) | eGFR (mL/min) |
| 对照组 | 10 | 52.7±10.0 | 23.9±3.9 | 116.9±16.6 | 75.6±7.4 | 41.8±4.7 | 5.8±0.5 | 5.2±1.1 | 306.3±97.7 | 3.2±2.0 | 1.4±0.8 | 5.4±1.4 | 1.4±0.4 | 3.5±0.9 | 0.2±0.1 | 19.2±6.7 | 4.6±1.0 | 0.9±0.6 | 70.7±12.8 | 102.7±11.2 |
| 糖尿病肾病组 | 40 | 57.3±9.0 | 25.0±3.4 | 149.1±22.3a | 76.1±11.0 | 38.2±6.6 | 8.1±3.1a | 8.1±3.4a | 355.1±95.2 | 5.6±8.9 | 2.4±3.0 | 7.3±8.8 | 1.3±0.4 | 3.8±1.3 | 2.9±2.9a | 28.1±10.5a | 8.0±3.0a | 1.5±0.7a | 143.5±83.2a | 59.4±31.2a |
| BMI:体质量指数;SBP:收缩压;DBP:舒张压;Alb:血清白蛋白;HA1c:糖仪血红蛋白;Glu:血糖;CRP:C反应蛋白;TG:甘油三酯;TC:血清总胆固醇;HDL:高密度脂蛋白胆固醇;LDL:低密度脂蛋白胆固醇;尿NAG:尿N-乙酰-β-氨基葡萄糖苷酶;eGFR:肾小球滤过率 a:P<0.05,与对照组比较 | ||||||||||||||||||||
1.5 统计学分析
计量资料以x±s表示,采用SPSS 18.0统计软件,DN组临床资料与对照组的比较采用独立样本t检验;Parkin的表达与临床资料的相关性采用Pearson相关 分析,与病理损伤评分(肾小球硬化、肾小管萎缩与间质纤维化、肾间质炎症)的关系采用Spearman 相关分析。
2 结果 2.1 两组临床资料比较与对照组比较,DN组的收缩压、血糖、HA1c、尿蛋白定量、尿NAG、胱抑素C、血肌酐显著升高,eGFR水平明显降低(P<0.05)。两组年龄、BMI、舒张压、血清白蛋白、尿酸、CRP、甘油三酯、总胆固醇、HDL、LDL水平差异均无统计学意义(P>0.05,表 1)。
2.2 不同IFTA评分DN肾组织Parkin的表达变化免疫组化结果显示,Parkin主要于肾小管上皮细胞细胞质中表达。对照组肾组织中Parkin表达广泛,阳性率为(43.5±6.0)%。而随着IFTA评分增加Parkin表达呈逐渐下降的趋势,其中IFTA 0分组 Parkin阳性率为(40.8±4.3)%,IFTA 1分组为(32.8± 4.8)%,IFTA 2分组为(28.5±4.2)%,IFTA 3分组为(19.0±4.9)%。IFTA 1~3分组与对照组比较,差异均有统计学意义(P<0.05)。提示Parkin表达随着DN疾病进展逐渐降低(图 1)。
2.3 肾小管细胞Parkin的表达与肾组织结构损伤评分的相关性相关性分析显示肾组织Parkin表达水平与肾小 球硬化(r=-0.734,P<0.01)、肾小管萎缩及肾间质 纤维化 (r=-0.773,P<0.01)、肾间质炎症(r=-0.673,P<0.01)均呈显著负相关,提示Parkin表达降低与DN肾结构损伤程度密切相关。
2.4 肾小管细胞Parkin的表达与肾脏功能损伤指标的相关性相关性分析显示肾组织Parkin表达水平与年龄、BMI、舒张压、HA1c、血糖、尿酸、CRP、甘油三酯、总胆固醇、HDL、LDL均不相关(P>0.05)。而与肾脏功能损伤指标(尿蛋白定量、尿NAG、尿素氮、血清胱抑素C、血肌酐)和收缩压负相关(P<0.01),与肾小球滤过率、血清白蛋白正相关(P<0.05,表 2)。提示Parkin表达降低与DN肾功能损伤水平密切相关。
| 临床指标 | r值 | P值 |
| SBP | -0.442 | 0.007 |
| Alb | 0.413 | 0.014 |
| 尿素氮 | -0.662 | <0.01 |
| 血清胱抑素c | -0.501 | 0.004 |
| 尿蛋白定量 | -0.606 | <0.01 |
| 尿NAG | -0.572 | <0.01 |
| 血肌酐 | -0.644 | <0.01 |
| eGFR | 0.677 | <0.01 |
| SBP:收缩压; Alb:血清白蛋白;尿NAG:尿N-乙酰-β-氨基葡萄糖苷酶;eGFR:肾小球滤过率 | ||
2.5 肾小管上皮细胞Parkin与IL-6、TGF-β及Col-Ⅳ表达的关系
免疫荧光检测发现DN组肾小管炎症因子IL-6表达较对照组显著增多,Parkin表达阳性的肾小管细胞并不表达IL-6(图 2),亦不表达间质纤维化标志物Col-Ⅳ和促纤维化因子TGF-β(图 3、4)。
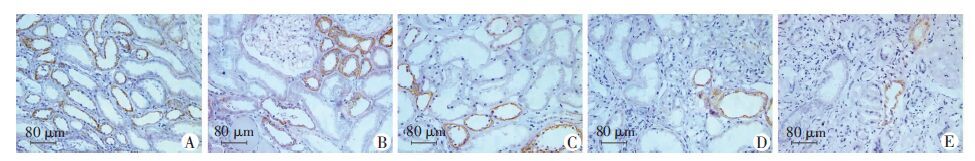
|
| A:对照组;B:IFTA 0分组;C:IFTA 1分组;D:IFTA 2分组;E:IFTA 3分组 图 1 免疫组化检测Parkin在各组患者肾组织中的表达 (二步法) |
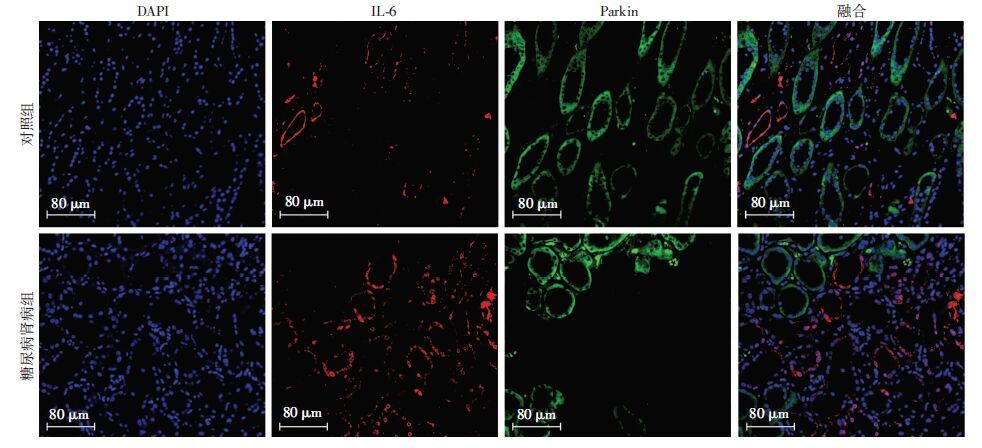
|
| 图 2 免疫荧光检测Parkin与IL-6在各组肾组织中的表达 |
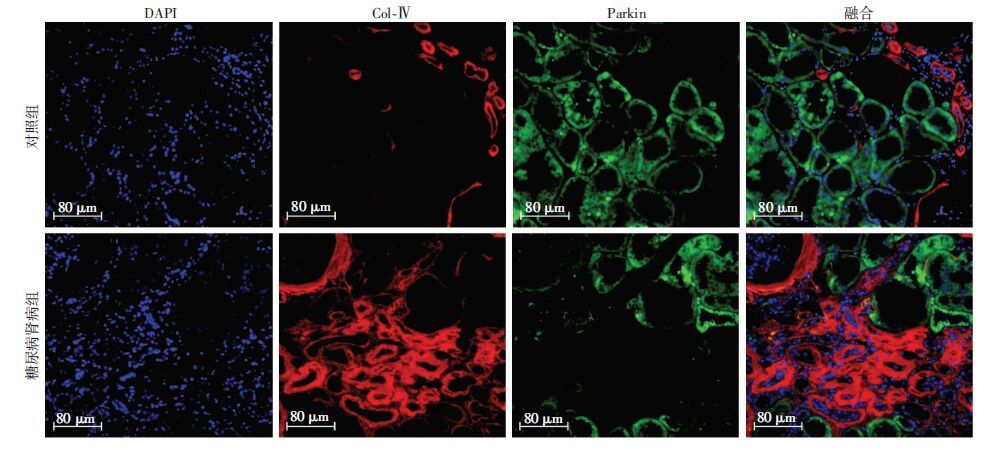
|
| 图 3 免疫荧光检测Parkin与Col-Ⅳ在各组肾组织中的表达 |
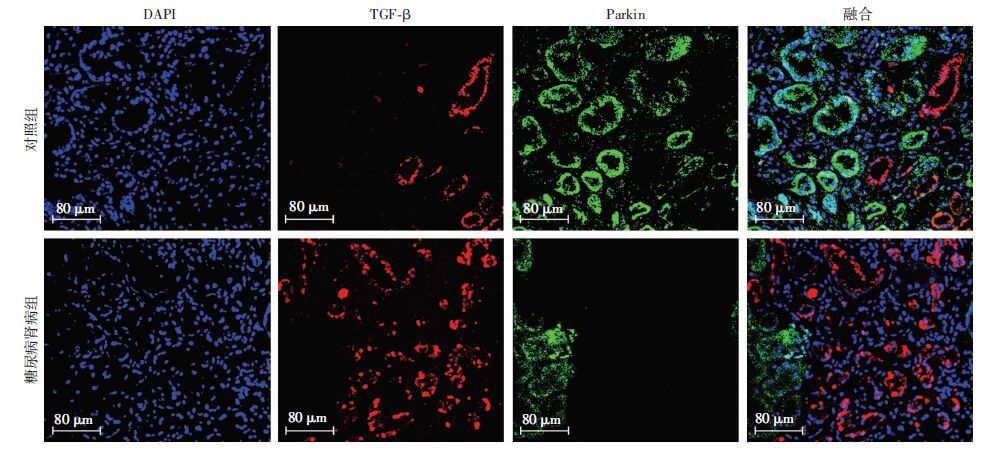
|
| 图 4 免疫荧光检测Parkin与TGF-β在各组肾组织中的表达 |
3 讨论
Parkin是一种E3泛素连接酶,在脑、骨骼肌、心、肝、肾等多种组织器官中广泛表达[8]。研究发现Parkin在糖尿病心脏、神经等相关靶器官损害中表达减少。糖尿病鼠心肌细胞和大脑多巴胺能神经细胞的Parkin表达均明显降低,导致细胞线粒体自噬异常、炎症因子分泌等,引起神经元及心肌细胞的应激性衰老,最终导致糖尿病心肌病与神经病变的发生[5-6]。相似的,在DN小鼠模型中肾小管细胞Parkin的表达下降[9]。本研究在DN患者中证实,Parkin主要在肾小管上皮细胞细胞质中表达,且随着肾小管间质损伤的加重,肾小管细胞Parkin的表达逐渐减少,证明DN可抑制肾小管上皮细胞Parkin表达。进一步分析Parkin的表达与肾脏结构损伤(炎症、间质萎缩及纤维化)评分的相关性发现,肾组织Parkin表达水平与肾小球硬化、肾间质损伤评分均呈负相关,提示Parkin表达降低可能与肾小球硬化、肾小管萎缩、肾间质炎症、肾间质纤维化不断加重存在关联。不仅如此,Parkin的肾小管阳性率与肾功能损伤指标(尿蛋白定量、尿NAG、尿素氮、血清胱抑素C、血肌酐)均呈负相关,与eGFR呈正相关,提示Parkin与DN肾功能损害存在密切联系。此外,本研究发现,Parkin尚与DN患者血清白蛋白水平存在正相关,一方面可能与本研究纳入的样本较少,存在偏倚有关;另一方面可能与Parkin具有调控IL-6表达,延缓小球滤过屏障损伤或球管反馈异常从而减少白蛋白的滤过相关[10-12],但仍需进一步研究证实。
本研究通过免疫荧光共染检测Parkin与肾间质损伤重要的效应分子IL-6、TGF-β及纤维化标志物Col-Ⅳ表达的关系,发现无论对照组或DN组,Parkin仅在健全的肾小管细胞中表达。结合研究[13]报道认为Parkin是线粒体自噬的关键调控因子,在线粒体质量控制中扮演重要角色。研究[14]发现,良好的线粒体质量控制可抑制炎性小体的聚集和促炎性因子的表达。在糖尿病小鼠心肌细胞中,Parkin的表达下降,导致线粒体自噬缺陷,引起细胞内ROS的产生、线粒体DNA向细胞质漏出,以及IL-1β、IL-18等炎性因子的表达[6]。同时上调Parkin的表达可保持线粒体的完整性,抑制老年小鼠心肌细胞IL-1β、TNF-a等炎性因子的表达[15]。由此我们推测在DN中,Parkin可能同样发挥着抑制IL-6表达、抑制炎性反应的作用,但仍需进一步研究证实。Parkin不仅可调控炎症因子的表达,在组织纤维化进程中亦扮演重要角色。研究发现,在四氯化碳介导的大鼠肝脏纤维化模型中,肝细胞内Parkin的表达显著下降,进一步给予褪黑素则可促进肝细胞Parkin的表达,抑制TGF-β的分泌,从而显著改善肝脏纤维化[4]。TGF-β可加速肾小管细胞凋亡、衰老、向间充质干细胞转化,促进成纤维干细胞增生及细胞外基质沉积,是肾小管萎缩及肾间质纤维化的关键细胞因子[16-17]。结合在DN肾组织中,Parkin阳性的肾小管上皮细胞并不表达Col-Ⅳ和TGF-β,我们推测Parkin可能同样发挥着抑制TGF-β表达,抵抗肾小管萎缩及肾间质纤维化的作用,但Parkin是否拮抗DN肾间质纤维化仍需进一步研究证实。
综上所述,本研究发现Parkin的表达随DN肾小管间质损伤的加重逐渐减少,并与DN肾组织结构和功能损害密切相关,但具体作用机制仍需进一步的体内体外干预实验证实。Parkin的减少与肾小管上皮细胞IL-6、TGF-β、Col-Ⅳ的表达增多密切相关,但具体调控机制尚不清楚,这将是我们未来关注的重点。
| [1] | Collins A J, Foley R N, Chavers B, et al. United States Renal Data System 2011 Annual Data Report: Atlas of chronic kidney disease & end-stage renal disease in the United States[J]. Am J Kidney Dis,2012, 59 (1 Suppl 1) : A7, e1 –420. DOI:10.1053/j.ajkd.2011.11.015 |
| [2] | Navarro-Gonzalez J F, Mora-Fernandez C, Muros de Fuentes M, et al. Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J]. Nat Rev Nephrol,2011, 7 (6) : 327 –340. DOI:10.1038/nrneph.2011.51 |
| [3] | Bonventre J V. Can we target tubular damage to prevent renal function decline in diabetes[J]. Semin Nephrol,2012, 32 (5) : 452 –462. DOI:10.1016/j.semnephrol.2012.07.008 |
| [4] | Ka ng, J W, Hong J M, Lee S M. Melatonin enhances mitophagy and mitochondrial biogenesis in rats with carbon tetrachloride-induced liver fibrosis[J]. J Pineal Res,2016, 60 (4) : 383 –393. DOI:10.1111/jpi.12319 |
| [5] | Khang R, Park C, Shin J H. Dysregulation of parkin in the substantia nigra of db/db and high-fat diet mice[J]. Neuroscience,2015, 294 : 182 –192. DOI:10.1016/j.neuroscience.2015.03.017 |
| [6] | Tang Y, Liu J, Long J. Phosphatase and tensin homolog-induced putative kinase 1 and Parkin in diabetic heart: Role of mitophagy[J]. J Diabetes Investig,2015, 6 (3) : 250 –255. DOI:10.1111/jdi.12302 |
| [7] | Tervaert T W, Mooyaart A L, Amann K, et al. Pathologic classification of diabetic nephropathy[J]. J Am Soc Nephrol,2010, 21 (4) : 556 –563. DOI:10.1681/ASN.2010010010 |
| [8] | Youle R J, Narendra D P. Mechanisms of mitophagy[J]. Nat Rev Mol Cell Biol,2011, 12 (1) : 9 –14. DOI:10.1038/nrm3028 |
| [9] | Zhan M, Usman I M, Sun L, et al. Disruption of renal tubular mitochondrial quality control by Myo-inositol oxygenase in diabetic kidney disease[J]. J Am Soc Nephrol,2015, 26 (6) : 1304 –1321. DOI:10.1681/ASN.2014050457 |
| [10] | Navarro-Gonzalez J F, Mora-Fernandez C. The role of inflammatory cytokines in diabetic nephropathy[J]. J Am Soc Nephrol,2008, 19 (3) : 433 –442. DOI:10.1681/ASN.2007091048 |
| [11] | Hellemons M E, Kerschbaum J, Bakker S J, et al. Validity of biomarkers predicting onset or progression of nephropathy in patients with Type 2 diabetes: a systematic review[J]. Diabet Med,2012, 29 (5) : 567 –577. DOI:10.1111/j.1464-5491.2011.03437.x |
| [12] | Vallon V, Thomson S C. Renal function in diabetic disease models: the tubular system in the pathophysiology of the diabetic kidney[J]. Annu Rev Physiol,2012, 74 : 351 –375. DOI:10.1146/annurev-physiol-020911-153333 |
| [13] | Scarffe L A, Stevens D A, Dawson V L, et al. Parkin and PINK1: much more than mitophagy[J]. Trends Neurosci,2014, 37 (6) : 315 –324. DOI:10.1016/j.tins.2014.03.004 |
| [14] | Suliman H B, Piantadosi C A. Mitochondrial Quality Control as a Therapeutic Target[J]. Pharmacol Rev,2016, 68 (1) : 20 –48. DOI:10.1124/pr.115.011502 |
| [15] | Hoshino A, Mita Y, Okawa Y, et al. Cytosolic p53 inhibits Parkin-mediated mitophagy and promotes mitochondrial dysfunction in the mouse heart[J]. Nat Commun,2013, 4 : p. 2308 . DOI:10.1038/ncomms3308 |
| [16] | Meng X M, Nikolic-Paterson D J, Lan H Y. TGF-beta: the master regulator of fibrosis[J]. Nat Rev Nephrol,2016, 12 (6) : 325 –338. DOI:10.1038/nrneph.2016.48 |
| [17] | Loeffler I, Wolf G. Transforming growth factor-beta and the progression of renal disease[J]. Nephrol Dial Transplant,2014, 29 (Suppl 1) : i37 –i45. DOI:10.1093/ndt/gft267 |



