2. 610041 成都,四川大学华西医院病理研究室
2. Laboratory of Pathology, West China Hospital, Sichuan University, Chengdu, Sichuan Province, 610041, China
心力衰竭(heart failure,HF)即心衰,是各种心血管疾病发展的最终结果,是心脏结构和功能异常、心室舒缩功能障碍导致心排量不能满足机体循环代谢需求的临床综合征,其严重危害人类健康,确诊5年内病死率仍高达50%[1-2]。探寻新的心衰防治靶点具有重要的临床价值。研究证实,microRNAs(miRNAs)的异常表达与多种心血管疾病有关,是心血管疾病的共同特征[3-4]。临床心衰过程中有众多miRNAs参与其中,如miR-1、miR-21、miR-133等[5],但是否存在某个miRNA在其中起关键作用尚无定论。此前研究发现,心肌特异性miR-1是调控心肌肥大的一个关键miRNA,在动物心肌肥大模型以及人类心脏疾病中均表达降低[6-8]。但是,一个miRNA可以调控多个目标基因,一个目标基因又可受不同的miRNA调控,miRNA与miRNA之间存在协同或拮抗作用。因此,miR-1对心血管疾病特别是心衰是否真的具有特别重要的存在意义尚不可定。鉴于此,本研究利用心肌特异性Dicer敲基因小鼠制备心衰模型,观察在Dicer基因缺失miRNA普遍不可逆性异常表达的背景下,miR-1对小鼠心功能的影响,探讨心肌特异性miR-1对心衰防治的潜在价值。
1 材料与方法 1.1 实验动物Myh6-creERT转基因工具鼠及Dicerloxp/loxp小鼠均由四川大学华西医院病理研究室提供,严格按照SPF级饲养条件进行操作,动物合格证号:SCXK(川)2015-030。实验过程中使用的小鼠为8周龄雄性Myh6-creERT/Dicerloxp/loxp小鼠,体质量为(25±3) g,采用Myh6-Cre/Loxp重组系统通过Dicerloxp/loxp小鼠和Myh6-creERT小鼠杂交获得。
1.2 主要实验试剂他莫昔芬(tamoxifen,TMX;Sigma,美国);miR-1类似物(miR-1 mimic)及miRNA阴性对照试剂(广州锐博生物科技有限公司);Dicer抗体(Cell Signaling Technology,USA);GAPDH抗体(康成生物工程有限公司,上海);Ki67抗体(Thermo,美国);EnVisionTM HRP二抗、二氨基联苯胺(diaminobenzidine,DAB)显色剂(Dako,丹麦);DAPI、荧光二抗(Invitrogen公司,美国);辣根过氧化物酶标记羊抗兔IgG/抗小鼠IgG(中杉金桥生物科技有限公司,北京);HE染色试剂盒、Masson三色染色试剂盒、天狼猩红染色试剂盒(贝索生物技术有限公司,珠海);凋亡试剂盒(Roche,瑞士)。
1.3 实验动物分组及给药方法采用随机数字表法将18只8周龄雄性Myh6-creERT/Dicerloxp/loxp小鼠分为3组:正常对照组、模型组、miR-1治疗组,每组6只。其中,对照组腹腔注射0.1 mL玉米油,模型组及治疗组均腹腔注射0.1 mL TMX(20 mg/mL,溶剂为玉米油),连续给药5 d;停药7 d待TMX被清除后,对照组尾静脉注射100 μL生理盐水,模型组尾静脉注射100 μL miRNA阴性对照试剂(0.1 nmol/μL,溶剂为生理盐水),治疗组尾静脉注射100 μL miR-1类似物,2次/周(图 1)。
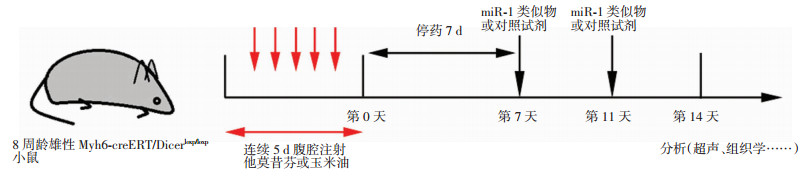
|
| 图 1 Myh6-creERT/Dicerloxp/loxp小鼠实验流程示意图 |
1.4 检测指标与方法 1.4.1 心脏超声检测
miR-1治疗1周后进行超声检测分析。通过腹腔注射1%戊巴比妥钠(50 mg/kg)全身麻醉小鼠,左侧卧位固定在温度恒定的操作台上,用线阵探头对小鼠进行超声检查。将舒张末期定义为左室容积最大时,收缩末期定义为左室容积最小时,测量左室长轴和左室短轴乳头肌水平M型曲线。测量舒张末期左室内径(LVIDd)、收缩末期左室内径(LVIDs)、舒张末期左室容积(EDV)、收缩末期左室容积(ESV)、射血分数(EF)及左室短轴缩短率(FS)等心功能指标。连续采集10个心动周期的动态图像,储存图像后进行脱机分析。超声检测后,断颈处死小鼠,迅速开胸取心脏,将对称性取材的一半心脏组织浸泡于中性福尔马林溶液中固定36 h左右,用于组织病理学检测分析,另一半心脏组织置于液氮保存用于提取蛋白和核酸。
1.4.2 Western blot法检测称取小鼠心脏组织,加入组织强裂解液进行组织匀浆,冰上静置1 h后离心取上清液,用BCA法测定蛋白浓度,取蛋白上清液加上样缓冲液(用之前加入β巯基乙醇)沸水浴5~10 min;蛋白上样量为40 μg,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、封闭,依次加一抗(1: 100稀释)、二抗(1: 5 000稀释),ECL显影,凝胶成像系统曝光。运用Image J软件分析灰度值,以待测蛋白与内参的灰度值比值表示蛋白含量。
1.4.3 组织学分析将固定好的小鼠心肌组织行石蜡包埋,切成厚度为4 μm的切片,后续进行HE染色、Masson三色染色及天狼猩红染色,严格按照各试剂盒说明书操作。采用EnVision二步法检测心脏组织石蜡切片中Dicer及Ki67的表达,一抗浓度均为1: 100。其中Ki67阳性细胞细胞核呈棕黄色,在高倍镜视野(×400) 下随机选取5个视野,计数每个视野下的阳性细胞数,以其均数代表该样本的阳性细胞数n,总细胞数为N,阳性细胞率=n/N×100%。在光学显微镜下观察染色效果,DP Controller图像采集系统采图。
1.4.4 TUNEL(TdT-mediated dUTP nick-end labeling)免疫荧光染色对心脏组织玻片进行TUNEL染色,选用Roche公司的In-Situ Cell Death Detection Kit,AP试剂盒,按说明书进行操作。用缓冲甘油封片后,在荧光显微镜下观察采图并计算凋亡阳性细胞数。
1.5 统计学处理采用GraphPad Prism 5.0及SPSS 20.0统计软件进行分析,计量数据用x±s表示,两组间数据比较采用t检验,多组间数据比较采用单因素方差分析。
2 结果 2.1 Dicer基因敲除效率检测Dicerloxp/loxp小鼠和Myh6-creERT小鼠杂交,获得可诱导性心肌特异性Myh6-creERT/Dicerloxp/loxp小鼠,基因型检测结果证实实验小鼠Cre/Loxp系统构建成功(图 2)。Western blot检测及免疫组化结果显示,TMX诱导小鼠心肌组织中Dicer蛋白的表达量(0.286± 0.094) 比玉米油诱导小鼠心肌组织中Dicer蛋白的表达量(1.064±0.166) 明显降低(P < 0.05,图 3),说明心肌细胞中Dicer基因在TMX的诱导下被有效敲除,TMX诱导心肌特异性Dicer基因敲除心衰模型构建成功(图 4)。
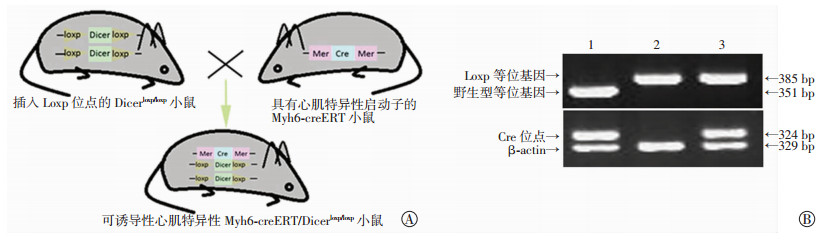
|
|
A:可诱导性心肌特异性Myh6-creERT/Dicerloxp/loxp小鼠的获取示意图;B:小鼠基因型检测电泳图(β-actin作为内参基因) 1:Myh6-creERT小鼠基因型,2:Dicerloxp/loxp小鼠基因型,3:Myh6-creERT/Dicerloxp/loxp小鼠基因型 图 2 可诱导性心肌特异性Myh6-creERT/Dicerloxp/loxp小鼠的获取及基因型鉴定 |
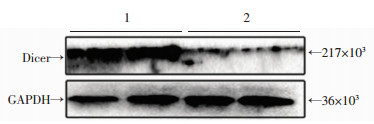
|
| 1:玉米油诱导小鼠;2:TMX诱导小鼠 图 3 Western blot检测玉米油和TMX诱导小鼠心肌组织中Dicer蛋白的表达 |
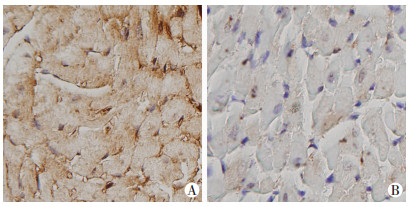
|
| A:玉米油诱导小鼠;B:TMX诱导小鼠 图 4 玉米油、TMX诱导小鼠心肌Dicer免疫组化染色观察(×400) |
2.2 超声心动图检测
miR-1治疗1周后,各组小鼠均进行超声心动图检测。结果显示:与对照组小鼠相比,模型组小鼠心功能显著下降,心腔扩张,室壁变薄,心功能指标LVIDs及ESV明显升高(P < 0.05),EF及FS显著降低(P < 0.05);而miR-1治疗组上述指标均较模型组明显改善(P < 0.05),EF及FS仍维持在正常心功能水平(表 1)。
| 组别 | 心率(/min) | 收缩末期左室内径(mm) | 收缩末期左室容积(mL) | 射血分数(%) | 左室短轴缩短率(%) |
| 对照组 | 630.43 ± 44.48 | 1.57 ± 0.12 | 0.0110 ± 0.0020 | 87.12 ± 3.48 | 50.77 ± 4.42 |
| 模型组 | 465.79 ± 81.34a | 2.03 ± 0.15a | 0.0267 ± 0.0064a | 69.00 ± 7.12a | 33.70 ± 5.30a |
| miR-1治疗组 | 629.70 ± 36.61b | 1.60 ± 0.20b | 0.0103 ± 0.0025b | 81.40 ± 0.77b | 43.83 ± 0.77b |
| a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 | |||||
2.3 组织病理学检测分析
心脏中特异性敲除心肌细胞Dicer基因会导致严重的心脏结构重构,出现明显的心衰组织病理学特征。HE、Masson及天狼猩红染色结果显示:与对照组相比,模型组小鼠心肌组织表现为显著的心肌细胞肥大、肌细胞排列紊乱和明显的炎性细胞浸润,存在严重的间质纤维化;miR-1治疗组小鼠与模型组相比,无显著的心肌结构重构表现,心肌细胞排列规则,未见明显的心肌细胞肥大或炎性浸润(图 5)。

|
| 图 5 miR-1对TMX诱导的心肌特异性Dicer基因缺失小鼠心肌结构重构的影响(×400) |
2.4 细胞凋亡检测
对心肌组织进行TUNEL染色,并对阳性细胞数进行统计。结果显示:模型组小鼠心肌组织中可见少数凋亡细胞,但与对照组比较无显著差异(P > 0.05),与模型组相比,miR-1治疗组小鼠心肌组织可见较大比例的细胞凋亡(P < 0.05)。对凋亡阳性细胞进行统计分析显示,在miR-1治疗组中约6%的细胞呈TUNEL阳性,而在模型组中呈凋亡阳性的细胞不到1%,提示miR-1的外源性输入促进了Dicer缺失小鼠心肌组织细胞凋亡(图 6)。
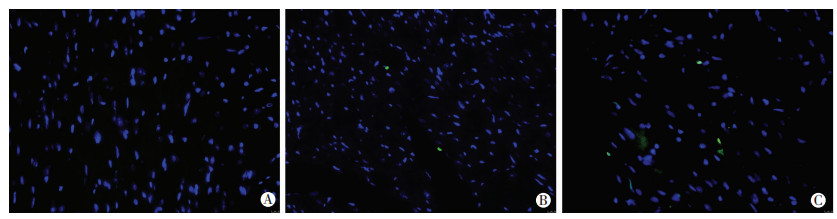
|
| A:对照组;B:模型组;C:miR-1治疗组 图 6 miR-1对TMX诱导的心肌特异性Dicer敲除小鼠细胞凋亡的影响(×400) |
2.5 细胞增殖检测
增殖指标Ki67免疫组化染色结果(图 7)显示:miR-1治疗组存在明显的细胞增殖反应,约6%的细胞Ki67染色呈阳性,显著高于模型组(P < 0.05),而模型组未见明显的增殖情况,与对照组比较无显著差异(P > 0.05),说明miR-1促进了心肌组织细胞增殖。
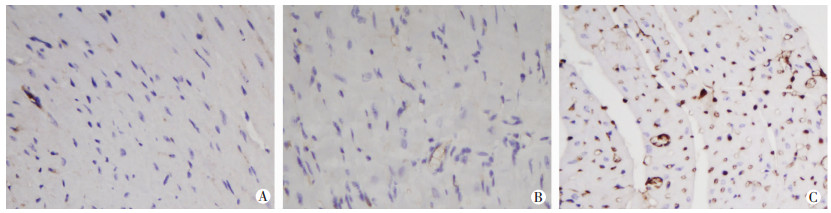
|
| A:对照组;B:模型组;C:miR-1治疗组 图 7 miR-1对TMX诱导的心肌特异性Dicer敲除小鼠细胞增殖的影响(×400) |
3 讨论
近年来越来越多的研究表明,miRNA的异常表达在心血管疾病中起了重要作用,特别是在病理生理学方面[3, 9]。因此,调控miRNA的表达活性成为心血管疾病防治的潜在靶标[10-11]。介于miRNA之间的特殊关系,我们通过特异性敲除心脏中miRNA的上游基因Dicer,应用心肌特异性Dicer缺失心衰模型替代普通动物心衰模型,在上百种miRNA不可逆性异常表达的情况下,单独研究某个miRNA对心衰进展的影响及其作用机制。在此研究中,我们观察到心肌特异性Dicer缺失能够引起严重的心脏结构重构和心功能不全。最重要的是,我们发现经miR-1治疗的Dicer缺失小鼠无明显的心功能和组织学异常,miR-1能够显著抑制心脏病理性结构重构。
miR-1具有肌细胞特异性,在骨骼肌和心肌细胞中特异表达,是心脏组织中表达丰度最高的miRNA,占总miRNA的40%,能够调节多个功能性蛋白的表达,如受体配体、凋亡相关蛋白等[6, 12-13]。本研究结果表明,miR-1在心肌特异性Dicer缺陷小鼠中确实扮演着“高丰度”的角色。miR-1的单独补入能够使心肌特异性Dicer敲除小鼠的心功能维持在正常水平,抑制心脏重构,预防心衰的发生。心脏重构是引起进行性心力衰竭和死亡的主导原因,其特点是心肌细胞的固有改变和细胞间质的改变,如心肌细胞坏死和凋亡、细胞肥大、心肌间质纤维化等[5]。miR-1在心脏中是一种保护性存在,正常情况下miR-1可通过降低心肌组织中肥大相关基因心房利钠因子(ANF)及β重链肌球蛋白(β-MHC)的表达水平抑制心肌细胞免于过度肥大,其低表达能够诱发心肌肥厚的发生[14-15]。同时,miR-1的低表达能够负性调控钠钙交换器(NCX1) 的表达和活性,后者的高表达能够引起心衰的发生[16]。miR-1的表达水平反映了心功能水平。在主动脉缩窄的慢性心肌梗死大鼠心衰模型中,miR-1表达水平显著降低,但是转染了携带心肌细胞肌浆网钙ATP酶(SERCA2a)基因表达序列的AAV9慢病毒载体后,miR-1能够通过Akt/FoxO3A途径恢复至正常表达水平,进而改善心功能[17]。本研究结果提示,在心肌特异性Dicer基因敲除心衰模型中,100多种miRNA异常表达的情况下,miR-1的单独输入能够显著抑制心肌细胞肥大和间质纤维化,进而使心脏维持正常的功能,起到明显的心肌保护作用。由于单个miRNA能够影响上百种蛋白的表达,miR-1抑制心脏结构重构维持正常心功能可能是多方面调控的综合结果。
KARAKIKES等[8]应用主动脉缩窄心肌肥大模型证实,通过转染携带miR-1基因表达序列的腺病毒载体能够逆转心肌肥大,抑制细胞凋亡,减轻间质纤维化,改善心肌已发生的不适应性结构重塑。本研究结果显示,miR-1治疗组Dicer缺失小鼠存在较高比例的细胞凋亡,且伴随着明显的细胞增殖。TANG等[18]的研究表明,miR-1能够负性调控抑凋亡基因Bcl-2,促进细胞凋亡。JAYAWARDENA等[19-20]通过体内及体外实验证实,在成年雄性成纤维细胞特异性蛋白1(FSP1) Cre转基因小鼠中,miR-1、miR-133、miR-208及miR-499复合体能够诱导心肌成纤维细胞转化为心肌细胞,进而改善心功能,具体机制尚未证实。虽然心肌细胞为永久性细胞,但最新研究显示,低氧环境可诱导成年小鼠心肌细胞再生[21]。本实验结果提示,miR-1可能在促进心肌细胞凋亡的同时增加心肌细胞的增殖,实现心肌细胞的固有改变进而抑制心脏结构重构。但是,miR-1的靶基因及所参与的信号通路极广,在心肌特异性miRNA广泛缺失的情况下,miR-1是否真的通过促进细胞凋亡而增加细胞增殖来实现心肌细胞的自我更新,进而抑制心脏结构重构维持心功能,还有待进一步的探究。
综上所述,在心肌特异性Dicer基因敲除心衰模型中,miR-1对维持心功能预防心衰的发生发展起着至关重要的作用。miR-1通过抑制心肌细胞肥大和心肌纤维化,促进细胞凋亡和增殖,抑制心脏结构重构,从而预防心衰的发生和发展。
| [1] | HU S S, KONG L Z, GAO R L, et al. Outline of the report on cardiovascular disease in China, 2010[J]. Biomed Environ Sci, 2012, 25(3): 251–256. DOI:10.3967/0895-3988.2012.03.001 |
| [2] |
黄峻. 中国心力衰竭流行病学特点和防治策略[J].
中华心脏与心律电子杂志, 2015, 3(2): 81–82.
HUANG J. The epidemiological characteristics and control strategy of China heart failure[J]. Chin J Heart & Heart Rhythm (Electronic Edition), 2015, 3(2): 81–82. DOI:10.3877/cma.j.issn.2095-6568.2015.2.002 |
| [3] | TOPKARA V K, MANN D L. Role of microRNAs in cardiac remodeling and heart failure[J]. Cardiovasc Drugs Ther, 2011, 25(2): 171–182. DOI:10.1007/s10557-011-6289-5 |
| [4] | KALOZOUMI G, YACOUB M, SANOUDOU D. MicroRNAs in heart failure: small molecules with major impact[J]. Glob Cardiol Sci Pract, 2014, 2014(2): 79–102. DOI:10.5339/gcsp.2014.30 |
| [5] | KATZ M G, FARGNOLI A S, WILLIAMS R D, et al. MiRNAs as potential molecular targets in heart failure[J]. Future Cardiol, 2014, 10(6): 789–800. DOI:10.2217/fca.14.64 |
| [6] | RAO P K, TOYAMA Y, CHIANG H R, et al. Loss of cardiac microRNA-mediated regulation leads to dilated cardiomyopathy and heart failure[J]. Circ Res, 2009, 105(6): 585–594. DOI:10.1161/CIRCRESAHA.109.200451 |
| [7] | TOWNLEY-TILSON W H, CALLIS T E, WANG D. MicroRNAs 1, 133, and 206: critical factors of skeletal and cardiac muscle development, function, and disease[J]. Int J Biochem Cell Biol, 2010, 42(8): 1252–1255. DOI:10.1016/j.biocel.2009.03.002 |
| [8] | KARAKIKES I, CHAANINE A H, KANG S, et al. Therapeutic cardiac-targeted delivery of miR-1 reverses pressure overload-induced cardiac hypertrophy and attenuates pathological remodeling[J]. J Am Heart Assoc, 2013, 2(2): e000078. DOI:10.1161/JAHA.113.000078 |
| [9] | DE ROSA S, CURCIO A, INDOLFI C. Emerging Role of MicroRNAs in Cardiovascular Diseases[J]. Circ J, 2014, 78(3): 567–575. DOI:10.1253/circj.CJ-14-0086 |
| [10] | SCOMPARIN A, POLYAK D, KRIVITSKY A, et al. Achieving successful delivery of oligonucleotides-From physico-chemical characterization to invivo evaluation[J]. Biotechnol Adv, 2015, 33(6 Pt 3): 1294–1309. DOI:10.1016/j.biotechadv.2015.04.008 |
| [11] | GIACCA M, ZACCHIGNA S. Harnessing the microRNA pathway for cardiac regeneration[J]. J Mol Cell Cardiol, 2015, 89(Pt A): 68–74. DOI:10.1016/j.yjmcc.2015.09.017 |
| [12] | KURA B, YIN C, FRIMMEL K, et al. Changes of microRNA-1, -15b and -21 levels in irradiated rat hearts after treatment with potentially radioprotective drugs[J]. Physiol Res, 2016, 65(Suppl 1): S129–137. |
| [13] | BIAN B, YU X F, WANG G Q, et al. Role of miRNA-1 in regulating connexin 43 in ischemia-reperfusion heart injury: a rat model[J]. Cardiovasc Pathol, 2017, 27: 37–42. DOI:10.1016/j.carpath.2016.12.006 |
| [14] | HE M, YANG Z, ABDELLATIF M, et al. GTPase Activating Protein (Sh3 Domain) Binding Protein 1 Regulates the Processing of MicroRNA-1 during Cardiac Hypertrophy[J]. PLoS One, 2015, 10(12): e0145112. DOI:10.1371/journal.pone.0145112 |
| [15] | YUAN W, TANG C, ZHU W, et al. CDK6 mediates the effect of attenuation of miR-1 on provoking cardiomyocyte hypertrophy[J]. Mol Cell Biochem, 2016, 412(1-2): 289–296. DOI:10.1007/s11010-015-2635-4 |
| [16] | TRITSCH E, MALLAT Y, LEFEBVRE F, et al. An SRF/miR-1 axis regulates NCX1 and annexin A5 protein levels in the normal and failing heart[J]. Cardiovasc Res, 2013, 98(3): 372–380. DOI:10.1093/cvr/cvt042 |
| [17] | KUMARSWAMY R, LYON A R, VOLKMANN I, et al. SERCA2a gene therapy restores microRNA-1 expression in heart failure via an Akt/FoxO3A-dependent pathway[J]. Eur Heart J, 2012, 33(9): 1067–1075. DOI:10.1093/eurheartj/ehs043 |
| [18] | TANG Y, ZHENG J, SUN Y, et al. MicroRNA-1 regulates cardiomyocyte apoptosis by targeting Bcl-2[J]. Int Heart J, 2009, 50(3): 377–387. DOI:10.1536/ihj.50.377 |
| [19] | JAYAWARDENA T M, EGEMNAZAROV B, FINCH E A, et al. MicroRNA-mediated in vitro and in vivo direct reprogramming of cardiac fibroblasts to cardiomyocytes[J]. Circ Res, 2012, 110(11): 1465–1473. DOI:10.1161/CIRCRESAHA.112.269035 |
| [20] | JAYAWARDENA T M, FINCH E A, ZHANG L, et al. MicroRNA induced cardiac reprogramming in vivo: evidence for mature cardiac myocytes and improved cardiac function[J]. Circ Res, 2015, 116(3): 418–424. DOI:10.1161/CIRCRESAHA.116.304510 |
| [21] | NAKADA Y, CANSECO D C, THET S, et al. Hypoxia induces heart regeneration in adult mice[J]. Nature, 2017, 541(7636): 222–227. DOI:10.1038/nature20173 |



