乳腺癌是女性最常见的恶性肿瘤之一,其发病率逐年上升。在我国,乳腺癌在城市中的发病率列女性恶性肿瘤的第2位,一些大城市中已经上升为第1位,在农村为第5位[1]。多柔比星是乳腺癌治疗的一线用药,能够抑制乳腺癌细胞系 (MCF7) 生长[2],是乳腺癌化疗的一线用药,但因剂量依赖性的心肌细胞毒性和耐药的问题[1],导致其临床应用受到限制。有研究者从联合用药[2]、小分子RNA干扰[3-6]等多种角度进行探索,希望解决多柔比星的心肌毒性和耐药问题。我们认为深入研究多柔比星的作用机制,寻找更为确切的作用靶点,有利于解决毒性和耐药问题,也能为乳腺癌化疗药物的研发提供新靶点、新思路。有研究者用蛋白质组学方法分析维生素C对多柔比星致乳腺癌细胞毒性的影响,发现差异蛋白集中在细胞骨架蛋白 (cytoskeleton) 和核糖体蛋白 (ribosome)[7]。本实验室前期研究中发现:多柔比星能够抑制MDA-MB-231细胞增殖,激光共聚焦检测观察到多柔比星使核区丝切蛋白 (cofilin) 表达增加。本研究主要检测多柔比星对cofilin核聚集及细胞核内cofilin相互作用蛋白的影响,建立cofilin核聚集与生物学功能间的联系,为后续进行深入的分子机理研究提供依据。
1 材料与方法 1.1 主要材料与仪器三阴性乳腺癌MDA-MB-231细胞购自美国典型培养物保存中心 (ATCC)。多柔比星、碘化丙啶 (propidium iodide, PI) 荧光染料等均购自美国Sigma公司。β-actin及cofilin抗体购于美国Santa Cruz公司, 羊抗兔IgG或羊抗鼠IgG为美国KPL公司产品。强效细胞裂解液 (P0013B), Protein A+G琼脂糖珠购自上海碧云天公司。Thermo LTQ Orbitrap Elite质谱系统,Thermo EASY-nlc1000液相系统,Thermo EASY-Spray Column Pepmap C18 3 μm 15 cm ×75 μm分析色谱柱,低温高速离心机,购自美国Thermo公司,Milli-Q超纯水机,购自美国Millipore公司。流式细胞仪 (Accuri C6) 购自美国BD公司。
1.2 方法 1.2.1 细胞培养与传代三阴性乳腺癌细胞MDA-MB-231,DMEM高糖培养基培养,加10%胎牛血清 (FBS),双抗100 IU/mL,37 ℃、5% CO2培养。待70%~80%融合,0.25%胰酶消化,接种或传代。
1.2.2 不同剂量多柔比星对cofilin核聚集的影响多柔比星 (0、0.1、0.2、0.5、1.0、2.5、5.0、7.5、10.0 μmol/L) 处理细胞24 h,分别刮取细胞约2×107个,加细胞质核蛋白分离液 (Hepes-KOH 20 mmol/L,KCl 10 mmol/L,MgCl2 1.5 mmol/L,EDTA-2Na 1 mmol/L,EGTA 1 mmol/L,DTT 1 mmol/L,PMSF 0.1 mmol/L,蔗糖250 mmol/L)200 μL混悬细胞,冰浴10 min,1 mL注射器吸打30次,冰浴15 min,1 000×g离心5 min,沉淀用细胞质核蛋白分离液洗涤200 μL× 5次,沉淀即为细胞核,取1 μL沉淀涂片,显微镜下观察,随机10个视野未见完整细胞。加适量强效细胞裂解液 (碧云天公司,P0013B) 混悬细胞,超声裂解,13 000 r/min离心10 min,取上清即为制备好的细胞核裂解液。BCA法测定蛋白浓度,添加细胞核裂解液、上样缓冲液,配置成3 μg/μL浓度的蛋白样品,96 ℃变性10 min,冷却至室温,离心、涡旋混匀后上样,12%丙烯酰胺凝胶电泳分离,恒流转膜 (PVDF)0.45 A,3 h,5%脱脂奶粉室温封闭30 min,4 ℃摇床结合一抗过夜,TBST洗膜,10 min×3次,5%脱脂奶粉稀释二抗 (1 :50 000),室温摇床孵育2 h,TBST洗膜,30 min×3次,加ECL发光底物,暗室中曝光。
1.2.3 多柔比星作用不同时间对cofilin核聚集的影响采用多柔比星5 μmol/L处理细胞0、1、3、6、9、12、24、36、48 h。按1.2.2项下方法检测细胞核内cofilin表达。
1.2.4 免疫共沉淀后质谱检测核内cofilin相互作用蛋白的表达 1.2.4.1 样品制备MDA-MB-231细胞 (1.2×106/100 mm直径培养皿) 培养过夜后,经多柔比星 (5 μmol/L) 处理24 h。分别刮取细胞,PBS洗涤细胞2次,吸弃上清。按1.2.2项下方法制备细胞核裂解液,测定蛋白浓度。
1.2.4.2 免疫共沉淀用细胞核裂解液调整蛋白浓度3 μg/μL,取400 μL,加IgG (Mouse) 2.4 μg,IgA+G琼脂糖珠混悬液20 μL,4 ℃轻轻摇动孵育2 h,1 000×g离心转移上清至新的离心管中,加入cofilin抗体2.4 μg,4 ℃轻轻摇动孵育14 h,加入Protein A+G琼脂糖珠混悬液30 μL,4 ℃轻轻摇动孵育2 h,1 000×g离心吸弃上清,沉淀用细胞质核蛋白分离液洗涤200 μL ×3次,含PMSF的PBS洗涤200 μL ×2次,冰浴保存,送检。
1.2.4.3 蛋白质的还原烷基化和溶液内酶切用50 mmol/L NH4HCO3分别配制1 mol/L二硫苏糖醇 (DTT) 和碘乙酰胺 (IAA),用前现配。蛋白质溶于6 mol/L盐酸胍 (含50 mmol/L NH4HCO3, pH=8),加入20 mmol/L DTT (终浓度),37 ℃温育1 h,取出放冷。加入50 mmol/L IAA (终浓度),室温避光反应1 h后,加入10 mmol/L DTT终止反应。用50 mmol/L NH4HCO3稀释8倍后,加入蛋白质量2%~5%的胰蛋白酶 (溶于50 mmol/L NH4HCO3),37 ℃温育10 h,加1% TFA终止酶切。
1.2.4.4 质谱检测质谱分析、数据处理及生物信息学分析参考文献[8]方法,用nano-LC-MS/MS液质联用系统作蛋白质组学研究。液相系统为Thermo EASY-nlc1000,质谱系统为Thermo LTQ Orbitrap Elite,分析柱采用为C18色谱柱 (3 μm,15 cm×75 μm)。样品进样量2 μL,流速300 nL/min;流动相A采用0.1%甲酸水溶液,B采用0.1%甲酸乙腈,梯度洗脱,分析时间为120 min。质谱条件:电喷雾 (ESI) 离子源,喷雾电压大约为2.2 kV,LTQ-Orbitrap质谱仪加热毛细管为250 ℃,35%碰撞能量,碰撞诱导解离,正离子模式;由Tune and Xcalibur控制软件根据数据依赖的自动模式实施一级和二级的切换,一级质谱使用全质量扫描,m/z从300到1 800。
1.2.4.5 数据处理及生物信息学分析使用Thermo Proteome discoverer 1.4搜索引擎对数据进行检索,检索数据库中人种属的ΜniProt数据库;参数如下:分子量范围为350~5 000,母离子分辨率10 ppm,子离子分子量为0.8,2个漏切位点的全酶切;固定修饰:半胱氨酸 (烷基化)+57.021 5,可变修饰:蛋氨酸 (氧化)+15.994 9;假阳性率 (FDR):0.01。采用SIEVE v2.1×64进行无标定量分析寻找相关差异蛋白,根据实验组与对照组均阳性和单独阳性分析差异蛋白。选用iProXpress (integrated Protein eXpression) 在线蛋白表达分析系统进行Gene Ontology (GO) 注释的索取及细胞组分、生物学功能、过程、信号通路聚类的统计分析;寻找细胞核内与cofilin相互作用的差异蛋白;利用STRING (version 10, http://string-db.org/) 数据库进行蛋白-蛋白相互作用和相关网络分析。
1.2.5 细胞周期的检测多柔比星 (0、1.0、2.5、5.0 μmol/L) 处理细胞24 h。胰酶消化收集细胞约5×105个,PBS洗涤2次,加细胞周期染液 (枸橼酸钠3.8 mmol/L,Triton X-100 0.1%,PI 50 mg/L,RNase A 500 mg/L)0.5 mL,混悬细胞,冰浴避光孵育2 h后上机检测。用FlowJo软件分析数据,进行Watson拟合。
2 结果 2.1 多柔比星可诱导乳腺癌细胞cofilin的核聚集多柔比星处理乳腺癌MDA-MB-231细胞后,全细胞和细胞质中cofilin表达没有明显变化,可引起细胞核中cofilin的表达显著增加,呈明显的量效和时效关系 (图 1)。
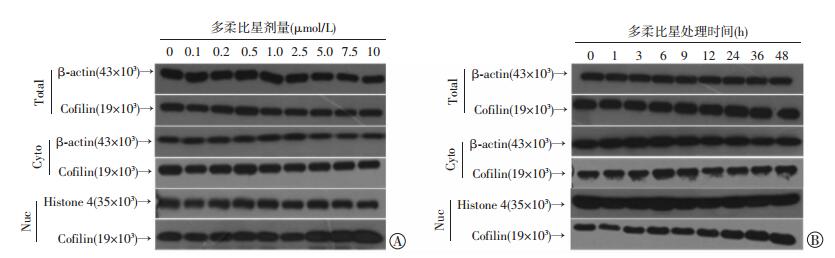
|
| A:不同剂量多柔比星处理细胞24 h;B:5.0 μmol/L多柔比星处理细胞不同时间 图 1 Western blot观察多柔比星对乳腺癌全细胞、细胞质和细胞核提取液中cofilin表达的影响 |
2.2 多柔比星明显减少细胞核内cofilin相互作用蛋白的种类
免疫共沉淀后蛋白质组学分析,cofilin1(COF1_HUMAN) 在对照与多柔比星组排名分别为13和6,Score/Coverage分别为312.57/34.94%和415.54/34.94%;与cofilin相互作用的actin (ACTB_HUMAN) 排名分别为3和4,Score/Coverage分别为1157.56/68.80%和459.75/43.20%。
多柔比星5 μmol/L处理MDA-MB-231细胞24 h,细胞核内cofilin相互作用蛋白的种类明显减少,依据iProXpress中Component、Function、Process、Pathway聚类,种类变化相对明显的列于表中 (表 1)。其中蛋白结合蛋白 (protein binding)、结构分子激活蛋白 (structural molecule activity)、细胞骨架蛋白、核酸结合蛋白 (nucleic acid binding)、核糖体蛋白的种类分别减少30、28、25、20、18种,变化最为明显。将iProXpress聚类的蛋白列表上传至STRING,分析核内与cofilin相互作用的蛋白间的网络关系,选择种类数量适中,功能集中的细胞骨架蛋白和核糖体蛋白展示网络关系 (图 2、3)。
聚类依据 |
对照组单 独阳性 |
对照组、 多柔比星 组均阳性 |
多柔比 星组单 独阳性 |
| Total | 77 | 59 | 38 |
| 聚类依据—Process | |||
| developmental process | 25 | 23 | 12 |
| cellular localization | 24 | 30 | 8 |
| protein transport | 23 | 26 | 7 |
| RNA processing | 18 | 26 | 4 |
| translation | 17 | 22 | 3 |
| RNA metabolic process | 14 | 22 | 6 |
| ribosome biogenesis | 13 | 20 | 2 |
| movement of cell or subcellular component | 12 | 23 | 1 |
| transport | 12 | 6 | 9 |
| macromolecule metabolic process | 11 | 10 | 1 |
| cell cycle | 10 | 5 | 3 |
| localization | 10 | 13 | 3 |
| vesicle-mediated transport | 8 | 14 | 5 |
| 聚类依据—Pathway | |||
| Metabolism of proteins | 23 | 24 | 9 |
| Gene Expression | 21 | 29 | 7 |
| 3′-UTR-mediated translational regulation | 14 | 21 | 4 |
| Metabolism of RNA | 14 | 22 | 5 |
| Ribosome | 14 | 20 | 2 |
| Regulation of actin cytoskeleton | 5 | 2 | 10 |
| Mitotic M-M/G1 phases | 4 | 1 | 4 |
| Signal Transduction | 4 | 3 | 4 |
| RNA transport | 2 | 2 | 3 |
| 聚类依据—component | |||
| cytoskeleton | 29 | 16 | 4 |
| protein complex | 27 | 11 | 14 |
| intracellular ribonucleoprotein complex | 26 | 18 | 8 |
| ribosome | 20 | 14 | 2 |
| cell projection | 16 | 4 | 1 |
| nucleolus | 13 | 13 | 5 |
| cell leading edge | 11 | 4 | 1 |
| Golgi apparatus | 4 | 3 | 1 |
| 聚类依据—Function | |||
| protein binding | 58 | 51 | 28 |
| nucleic acid binding | 36 | 40 | 16 |
| structural molecule activity | 32 | 28 | 4 |
| nucleotide binding | 17 | 16 | 14 |
| nucleoside binding | 14 | 13 | 10 |
| ion binding | 11 | 5 | 5 |
| hydrolase activity | 10 | 9 | 6 |
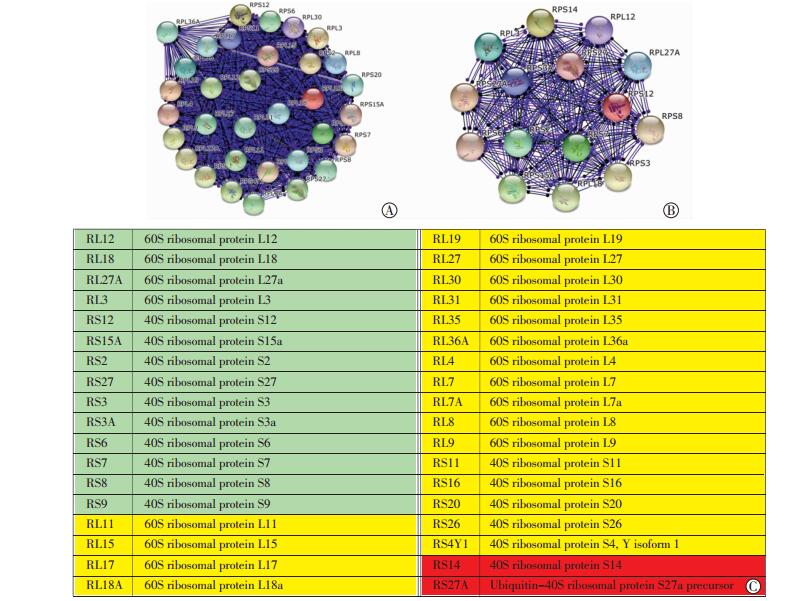
|
| A:对照组;B:5 μmol/L多柔比星处理24 h组;C:蛋白质缩写注释绿色填充为两组共表达,黄色填充为仅对照组表达,红色填充为仅多柔比星组表达 图 2 STRING分析检测核内与cofilin相互作用的核糖体蛋白间的网络关系 |
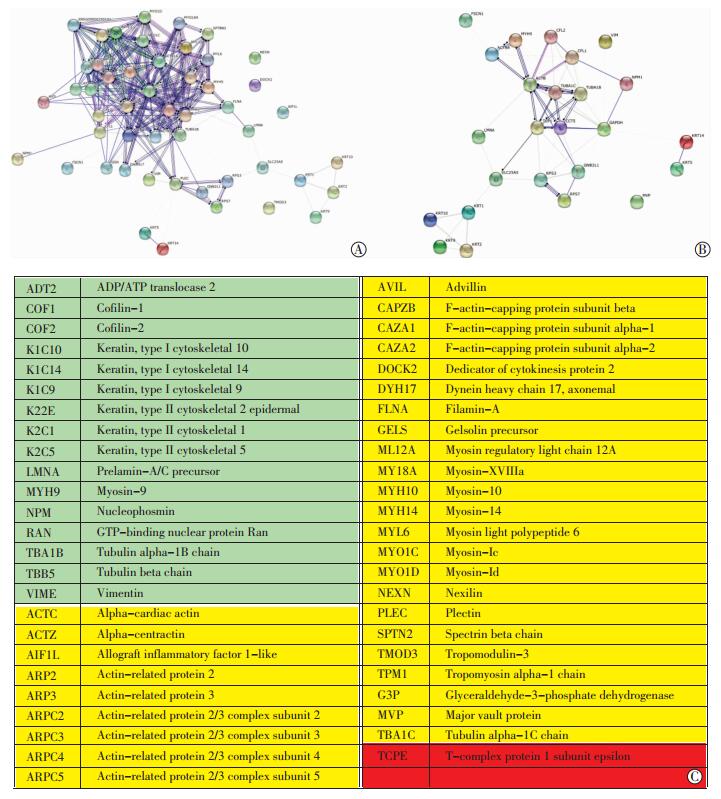
|
| A:对照组;B:5 μmol/L多柔比星处理24 h组; C:蛋白质缩写注释绿色填充为两组共表达,黄色填充为仅对照组表达,红色填充为仅多柔比星组表达 图 3 STRING分析检测核内与cofilin相互作用的细胞骨架蛋白间的网络关系 |
2.3 流式细胞仪检测多柔比星对细胞周期的影响
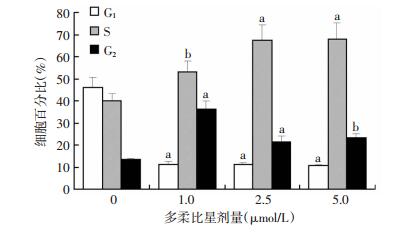
采用Watson拟合,RMS值小于5,G1cv与G2cv均小于10,表明拟合效果良好 (图 4)。低剂量时G2期阻滞明显,随剂量增高,S期阻滞明显。G1期细胞比例均较对照组显著减少 (P < 0.01,图 5)。
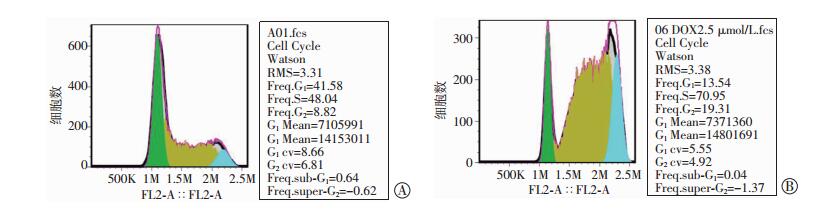
|
| A:对照组;B:多柔比星处理24 h组 图 4 特征性周期Watson拟合图 |
|
| a: P < 0.01,b: P < 0.05,与0 μmol/L比较 图 5 流式细胞仪检测多柔比星对细胞周期的影响 |
3 讨论
多柔比星是乳腺癌治疗的一线用药,深入研究多柔比星的作用机制,寻找更为确切的作用靶点,可以为解决其心肌毒性及耐药性问题提供参考,也能为乳腺癌化疗药物的研发提供新靶点、新思路。有研究表明多柔比星诱导有丝分裂突变和细胞凋亡后,CHO AA8细胞系中的超微结构发生变化,并且肌动蛋白细胞骨架重组与丝切蛋白核表达有关,提示多柔比星影响cofilin核表达[9]。本实验室前期研究发现:多柔比星能够抑制MDA-MB-231细胞增殖,激光共聚焦检测观察到多柔比星使核区cofilin聚集。本研究旨在探索cofilin核区聚集的生物学功能。
鉴于免疫共沉淀后无标记蛋白质组学检测方法易出现假阳性和定量不准的问题,本研究采用对照组与处理组完全平行操作的方法保证可比性,另搜库时设置信噪比阈值 (S/N Threshold) 1.5以去除背景。在研究目标方面,未锁定在具体寻找到哪一种与cofilin相互作用的关键蛋白,而是关注功能聚类和信号通路聚类后变化比较明显的蛋白类群,将其与细胞周期、凋亡、自噬等生物学功能联系,并佐以其他检测结果相互印证。所以本研究中并未选择特定蛋白进行免疫印迹验证。
多柔比星诱导cofilin核区聚集,核内cofilin表达增加,与cofilin相互作用的蛋白种类却减少,有可能是蛋白表达受到影响,也可能是蛋白与cofilin的相互作用改变,尚需进一步探索。在寻找差异蛋白的标准设定上,鉴于无标定量分析方法的局限性,本研究主要寻找阴性和阳性的差异蛋白,结果发现蛋白结合蛋白、结构分子激活蛋白、细胞骨架蛋白、核酸结合蛋白、核糖体蛋白减少最为明显,其中3种cofilin相互作用的F-actin加帽蛋白在多柔比星处理后均未检测到。鉴于蛋白数量过多时,网络关系图过于庞杂,在相互作用网络图中仅展示了细胞骨架蛋白和核糖体蛋白。另因iProXpress数据库与STRING数据库的差异,相互作用网络图中标示蛋白种类可能会比表格中罗列的种类少1或2种。所有细胞死亡过程都涉及F-actin重组,而cofilin核表达与F-actin核转位及F-actin核内动态重组有关[9]。鉴于核糖体蛋白与细胞S周期事件蛋白合成密切相关,本研究进一步检测了多柔比星对细胞周期的影响,结果显示多柔比星导致乳腺癌细胞周期阻滞在S/G2期。提示多柔比星导致乳腺癌细胞周期阻滞可能与其导致cofilin核聚集有关,干预cofilin核聚集可能是抑制乳腺癌细胞增殖的有效策略。我们参考文献[10]方法构建cofilin-WT质粒,在此基础上构建V20A、K22A点突变质粒分别增加和减少cofilin核聚集,发现cofilin核聚集增加,其S/G2期细胞比例增加,反之,其S/G2期细胞比例减少。提示增加cofilin核聚集可能是抑制乳腺癌细胞增殖。但因为该方法仅能使核内cofilin改变不多于20%的比例,对应的细胞周期变化比例也较小,尚需更有效和专一的干预措施证实增加cofilin核聚集能够导致细胞S/G2期阻滞,从而抑制乳腺癌细胞增殖,此过程中的关键通路和蛋白也仍需进一步探索。
| [1] |
李朵璐, 周玉冰, 韩超. 转录信号转导子与激活子3小分子干扰RNA增强乳腺癌对多柔比星的药物敏感性[J].
中国药学杂志, 2016, 51(11): 896–903.
Li D L, Zhou Y B, Han C, et al. Small interfering rna targeting stat3 enhances the drug susceptibility of adriamycin in breast cancer cells[J]. Chin Pharm J, 2016, 51(11): 896–903. DOI:10.11669/cpj.2016.11.007 |
| [2] | Ciftci K, Su J, Trovitch P B. Growth factors and chemotherapeutic modulation of breast cancer cells[J]. J Pharm Pharmacol, 2003, 55(8): 1135–1141. DOI:10.1211/002235703322277177 |
| [3] | Zhao M, Jiang B, Gao F H. Small molecule inhibitors of STAT3 for cancer therapy[J]. Curr Med Chem, 2011, 18(26): 4012–4018. DOI:10.2174/092986711796957284 |
| [4] |
李强, 王兴武, 宋宝. microRNA-21对乳腺癌MCF-7/ADR细胞株多柔比星耐药性影响的研究[J].
中华肿瘤防治杂志, 2012, 19(3): 188–191.
Li Q, Wang X W, Song B. Dysregulation effect of microRNA-21 gene on drug resistance in ADM-resistant MCF-7 breast cancer cells[J]. Chinese Journal of Cancer Prevention & Treatment, 2012, 19(3): 188–191. |
| [5] | Lacerda L, Pusztai L, Woodward W A. The role of tumor initiating cells in drug resistance of breast cancer: Implications for future therapeutic approaches[J]. Drug Resist Updat, 2010, 13(4/5): 99–108. DOI:10.1016/j.drup.2010.08.001 |
| [6] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1): 10–29. DOI:10.3322/caac.20138 |
| [7] | Bober P, Alexovic M, Talian I, et al. Proteomic analysis of the vitamin C effect on the doxorubicin cytotoxicity in the MCF-7 breast cancer cell line[J]. J Cancer Res Clin Oncol, 2017, 143(1): 35–42. DOI:10.1007/s00432-016-2259-4 |
| [8] |
章常华, 涂秀英, 熊淑平, 等. 基于蛋白质组学技术筛选葛根芩连汤防治胰岛素抵抗作用的血清差异表达蛋白[J].
中药新药与临床药理, 2016, 27(1): 81–85.
Zhang C H, Tu X Y, Xiong S P, et al. Screening for serum differentially-expressed proteins Gegen Qin Lian decoctionin treating insulin resistance with proteomics technology[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2016, 27(1): 81–85. DOI:10.3969/j.issn.1003-9783.2016.01.018 |
| [9] | Grzanka D, Marszalek A, Izdebska M, et al. Actin cytoskeleton reorganization correlates with cofilin nuclear expression and ultrastructural changes in cho aa8 cell line after apoptosis and mitotic catastrophe induction by doxorubicin[J]. Ultrastruct Pathol, 2011, 35(3): 130–138. DOI:10.3109/01913123.2010.548113 |
| [10] | Munsie L N, Desmond C R, Truant R. cofilin nuclear-cytoplasmic shuttling affects cofilin-actin rod formation during stress[J]. J Cell Sci, 2012, 125(Pt 17): 3977–3988. DOI:10.1242/jcs.097667 |



