2. 710032 西安,第四军医大学口腔医学院牙周科
2. Department of Periodontology, School of Stomatology, Fourth Military Medical University, Xi'an, Shaanxi Province, 710032, China
我国高原地域辽阔,各海拔高度均有人居住。研究报道,高原环境人群牙周炎患病率明显高于平原地区,而且随着移居时间的延长,其牙周炎患病率逐渐增高,说明高原低氧可能是引起牙周炎患病率增加的重要原因[1]。低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α) 作为低氧重要的转录因子,通过调节多个下游基因的表达,维持组织和细胞的氧稳态,对低氧应答过程有重要作用[2]。牙周炎症时,激活宿主免疫反应,产生的基质金属蛋白酶 (matrix metalloproteinases, MMPs),参与牙周组织破坏、降解过程,在牙周炎的发生、发展过程中起重要作用[3]。文献[4]报道,炎症条件下,细胞对氧的适应性调节主要通过调控HIF-1α进而影响MMP2和MMP9的表达,从而影响炎症的发展和转归。另有研究表明,低氧可以改变MMP及其抑制剂 (tissue inhibitor of metalloproteinase,TIMP) 的表达,引起MMP及TIMP表达失衡,在牙周炎的发展过程中起重要作用[5]。而目前关于低氧是如何调控MMP的表达尚不清楚。低氧是否可以通过调控HIF-1α进而影响MMP2的表达,对牙周炎的发生、发展产生影响是目前研究的难点。本研究在低氧条件下,检测牙周炎牙周组织中HIF-1α及MMP2的表达,探究牙周炎与HIF-1α和MMP2表达之间的关系,初步探索HIF-1α对MMP2表达的调控作用,为将来制定高原牙周病的防治策略奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 实验动物选择健康成年SD大鼠40只 (由第三军医大学大坪医院野战外科研究所实验动物中心提供),牙周健康、无龋齿,体质量 (200±20) g,雌雄各半,分笼饲养。
1.1.2 主要仪器及试剂低压氧舱 (中国贵航集团风雷军械厂),光学显微镜 (Olympus公司),体视显微镜 (Olympus公司),戊巴比妥钠 (中国医药上海化学试剂公司),醋酸泼尼松龙 (浙江仙琚制药股份有限公司),0.20号正畸结扎丝 (长沙市天天齿科器材有限公司),SDS-PAGE配制试剂盒 (碧云天生物技术研究所),PVDF膜 (Roche,美国),牛血清白蛋白 (碧云天生物技术研究所),5×蛋白上样缓冲液 (碧云天生物技术研究所),HIF-1α、MMP2一抗抗体 (Abcam,美国),山羊抗兔、山羊抗小鼠二抗抗体 (碧云天生物技术研究所)。
1.2 方法 1.2.1 牙周炎动物模型的建立将40只SD大鼠采用简单随机化分组法分为4组:常氧组 (A组)、常氧牙周炎组 (B组)、低氧组 (C组)、低氧牙周炎组 (D组),每组10只,雌雄分笼饲养。采用Fischer等[6]方法建立牙周炎动物模型:3%戊巴比妥钠 (40 mg/kg) 经腹腔注射麻醉,麻醉起效后采用0.20号正畸结扎丝结扎B、D组大鼠右上颌第一磨牙牙颈部,使结扎丝尽量下压于龈沟内,结扎后连续8 d使用醋酸泼尼松龙1.25 mg/(kg·d) 注射大鼠股四头肌,根据牙周炎高糖饮食喂养,对照组不处理。A、B组于平均海拔308 m饲养;C、D组于低压氧舱模拟海拔5 000 m饲养,23 h/d,1 h开舱予以补充饲料及更换垫料。在造模及饲养过程中各组大鼠状态良好,未发现明显异常。
1.2.2 牙周临床指标的检测建模8周后检测大鼠牙龈指数 (gingival index,GI):采用文献[7]的方法分为4度;菌斑指数 (plaque index,PLI):采用Sillness和Loe法1964[7]分为4度;牙周探诊深度 (probing depth,PD):采用Williama牙周探针测量牙周袋底至龈缘的距离;牙槽骨吸收度 (alveolar bone loss,ABL):采用文献[8]的方法测量釉牙骨质界到牙槽嵴顶的距离。
1.2.3 Western blot建模8周后采用Western blot检测大鼠右上颌第一磨牙牙周组织HIF-1α、MMP2蛋白表达。切取大鼠右上颌第一磨牙牙周组织,常规蛋白提取、SDS-PAGE电泳、转膜、封闭后孵育HIF-1α、MMP2一抗抗体,辣根过氧化物酶标记二抗,ECL化学显色,Bio-Rad凝胶成像系统成像。HIF-1α、MMP2图像经Quantity One软件计算灰度值,与内参灰度值比较后进行统计分析。
1.2.4 组织学表现和免疫组化建模8周后处死大鼠,截取右上颌第一磨牙区段,放入4%多聚甲醛中固定24 h,EDTA脱钙液脱钙后,常规脱水、包埋、切片,HE染色;免疫组化 (S-P) 法检测大鼠牙周组织中HIF-1α、MMP2的表达。
1.3 统计学分析采用SPSS 18.0统计软件进行统计分析,等级资料GI、PLI采用有序Logistic回归分析,计量资料PD、ABL及HIF-1α、MMP2蛋白表达水平进行两因素方差分析,数据以x±s表示,检验水准α=0.05。
2 结果 2.1 牙周临床指标情况 2.1.1 牙龈指数、菌斑指数频数分布比较4组大鼠的牙龈指数及菌斑指数,发现低氧牙周炎组其牙龈指数菌斑指数值最高,表明低氧牙周炎组大鼠的牙龈炎症程度最重,菌斑量最多,差异有统计学意义 (P < 0.05,表 1)。
| 指数分级 | 牙龈指数 | 菌斑指数 | |||||||
| 常氧组 | 常氧牙周炎组 | 低氧组 | 低氧牙周炎组 | 常氧组 | 常氧牙周炎组 | 低氧组 | 低氧牙周炎组 | ||
| 0 | 6 | 0 | 3 | 0 | 7 | 0 | 3 | 0 | |
| 1 | 4 | 2a | 6 | 0 | 3 | 2a | 5 | 1 | |
| 2 | 0 | 6 | 1 | 3 | 0 | 5 | 2 | 1 | |
| 3 | 0 | 2 | 0 | 7bc | 0 | 3 | 0 | 8bc | |
| a:P < 0.05,与常氧组比较;b:P < 0.05,与低氧组比较;c:P < 0.05,与常氧牙周炎组比较 | |||||||||
2.1.2 各组探诊深度和牙槽骨吸收度比较
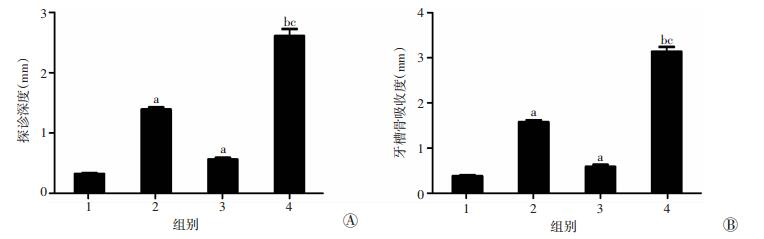
与其他组比较,低氧牙周炎组探诊深度和牙槽骨吸收度数值最高,差异有统计学意义 (P < 0.05,图 1)。
|
| 1:常氧组;2:常氧牙周炎组;3:低氧组;4:低氧牙周炎组a:P < 0.05,与常氧组比较;b:P < 0.05,与低氧组比较;c:P < 0.05,与常氧牙周炎组比较 图 1 4组大鼠牙周探诊深度 (A) 及牙槽骨吸收度 (B) 比较 |
2.2 牙周组织学特征 2.2.1 牙周组织肉眼观察
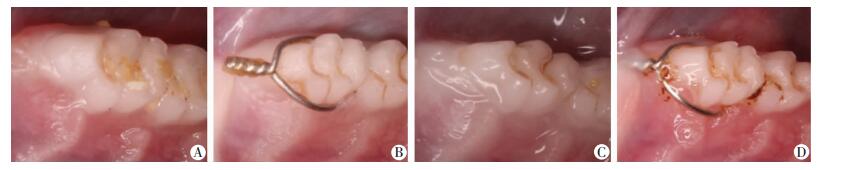
造模8周后肉眼观常氧组、低氧组大鼠牙周组织无明显改变,常氧牙周炎组、低氧牙周炎组大鼠牙周组织糜烂、大量食糜附着,触之明显出血、溢脓 (图 2)。
|
| A:常氧组;B:常氧牙周炎组;C:低氧组;D:低氧牙周炎组 图 2 各组大鼠牙周组织肉眼观察 |
2.2.2 牙周组织HE染色结果
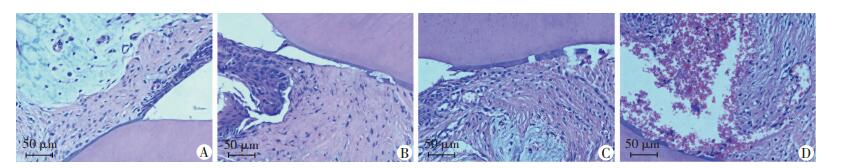
HE染色结果显示,常氧组牙周组织未见明显组织病理学改变;常氧牙周炎组可见沟内上皮糜烂,牙周纤维排列紊乱,牙槽骨轻度吸收;低氧组少量炎细胞浸润;低氧牙周炎组大量中性粒细胞、淋巴细胞浸润,胶原水肿、变性,牙周纤维紊乱、断裂 (图 3)。
|
| A:常氧组;B:常氧牙周炎组;C:低氧组;D:低氧牙周炎组 图 3 各组大鼠牙周组织HE染色观察 |
2.3 牙周组织中HIF-1α、MMP2的表达 2.3.1 免疫组化检测各组大鼠牙周组织HIF-1α、MMP2的表达
低氧条件下,HIF-1α、MMP2的表达明显增加;牙周炎症时, HIF-1α、MMP2的表达增加。显微镜下观察大鼠牙周组织中HIF-1α、MMP2的表达阳性染色呈棕黄色。低氧牙周炎组大鼠牙周组织中HIF-1α、MMP2表达量最高,切片组织中可观察到明显的棕黄色颗粒 (图 4)。

|
| 图 4 免疫组化检测各组大鼠牙周组织中HIF-1α、MMP2的表达 (S-P) |
2.3.2 Western blot检测各组大鼠牙周组织HIF-1α、MMP2蛋白的表达
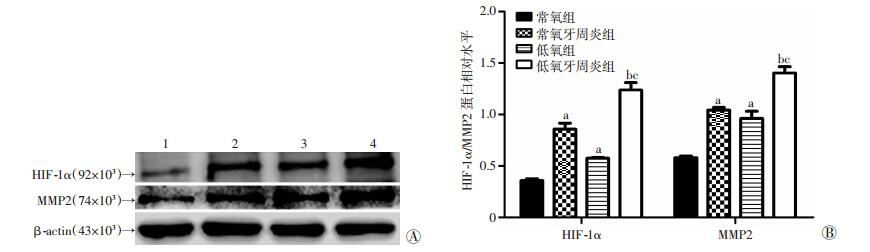
低氧条件下,HIF-1α、MMP2的表达明显增加;牙周炎症时, HIF-1α、MMP2的表达增加。低氧牙周炎组HIF-1α、MMP2表达量最高 (P < 0.05,图 5)。
|
| A:Western blot检测结果1:常氧组;2:常氧牙周炎组;3:低氧组;4:低氧牙周炎组; B:半定量分析结果a:P < 0.05,与常氧组比较;b:P < 0.05,与低氧组比较;c:P < 0.05,与常氧牙周炎组比较 图 5 HIF-1α、MMP2蛋白表达水平 |
3 讨论
牙周病是发生在牙周支持组织的一种复杂的炎症感染性疾病,主要由革兰阴性菌堆积在牙齿表面,激活宿主的促炎介质,导致牙周组织的破坏,最终导致失牙[9]。目前牙周炎的治疗方法局限,牙周炎失牙率高,促使我们探索新的治疗方法,为牙周炎的治疗提供新思路。研究表明,厌氧菌、牙合创伤、吸烟以及不良口腔卫生习惯均可加重牙周炎的发展进程,而牙周炎不仅对口腔健康有严重的影响,同时影响许多系统性疾病的发生和发展[10]。
本研究利用低氧Fisher等[6]的方法建立牙周炎动物模型,检测低氧及炎症条件下,牙周组织的病理改变及HIF-1α、MMP2的表达情况,发现低氧牙周炎组大鼠牙周炎症程度最重,牙周组织明显充血水肿,大量浆细胞、淋巴细胞浸润,牙周纤维变性、断裂;此外,低氧及炎症均促进了HIF-1α、MMP2的表达,且在低氧合并牙周炎条件下,HIF-1α、MMP2表达量最高,提示低氧可能通过HIF-1α通路调控MMP2的表达,从而加重牙周炎症程度;在常氧条件下,牙周炎组HIF-1α、MMP2表达量也增加,说明牙周炎症同时也可增加HIF-1α、MMP2表达。
HIF-1是低氧重要的转录调控因子,由α和β两个亚基组成,其中β亚基为结构亚基,在常氧及低氧条件下均稳定表达,而α亚基为功能亚基,在常氧条件下其通过泛素化,被蛋白酶水解;而在低氧条件下,这一进程被抑制,α亚基与β亚基结合,进而发挥功能作用[11-12]。Li等[13]研究发现,慢性牙周炎可能使牙周成纤维细胞中HIF-1α转录激活,进一步加重牙周炎的发展。此外,HIF-1α可诱导牙周膜细胞的凋亡和自噬性细胞死亡[14]。这提示通过调控HIF-1α的表达,可能对牙周炎发生、发展有重要作用,为牙周炎的治疗提供新的思路。
炎症细胞因子如MMP在维持细胞炎症状态有重要作用,对于炎症相关的增殖及组织破坏性疾病有重要意义[15]。MMP2作为基质金属蛋白酶家族的重要成员,是一种锌依赖的蛋白酶类,是胚胎发育、组织重建等过程的关键作用因子,其对于细胞外基质的合成和降解发挥重要作用。牙周炎症时,其合成和降解紊乱可能是导致牙周炎症程度加重的重要原因[3, 16]。文献[17]报道,MMP2的表达可能与牙周炎症程度呈正相关。研究发现,低氧时细胞可能通过HIF-1α调控MMP2表达,在血管生成、细胞迁移及伤口愈合等多种病理生理过程中发挥重要作用[18]。尽管目前对于HIF-1α、MMP2的研究较多,而对于低氧、炎症共同作用下牙周组织发生的病理改变仍不清楚,低氧是否通过HIF-1α影响MMP2的表达,炎症是否可以引起局部组织处于低氧状态,进而调控MMP2,加重牙周炎症程度,仍是目前研究的重点及难点。
本研究利用大鼠低氧牙周炎动物模型,研究低氧及炎症对牙周组织的影响,发现低氧及炎症均可促进HIF-1α、MMP2的表达,且HIF-1α与MMP2的表达呈一致性,说明低氧可能通过HIF-1α信号通路促进MMP2的表达,从而加重牙周炎症程度;另一方面,炎症可能使牙周组织局部处于低氧状态,并激活HIF-1α信号通路,影响下游靶基因的表达,进而加重牙周炎症程度。然而,目前关于HIF-1α及MMP2的关系仍不清楚,促使我们进一步探讨HIF-1α与MMP2之间的关系,为将来制定高原牙周病的防治策略奠定理论基础。
| [1] |
冯秀娟. 高海拔地区牙周疾病就诊原因分析[J].
高原医学杂志, 2002, 12(2): 26–27.
Feng X J. Analysis of the causes of periodontal diseases in high altitude area[J]. Journal of High Altitude Medicine, 2002, 12(2): 26–27. DOI:10.3969/j.issn.1007-3809.2002.02.011 |
| [2] | Abdollahi H, Harris L J, Zhang P, et al. The role of hypoxia in stem cell differentiation and therapeutics[J]. J Surg Res, 2011, 165(1): 112–117. DOI:10.1016/j.jss.2009.09.057 |
| [3] | Campos K, Gomes C C, Farias L C, et al. DNA Methylation of MMP9 Is Associated with High Levels of MMP-9 Messenger RNA in Periapical Inflammatory Lesions[J]. J Endod, 2016, 42(1): 127–130. DOI:10.1016/j.joen.2015.10.002 |
| [4] | Bae W J, Shin M R, Kang S K, et al. HIF-2 Inhibition Supresses Inflammatory Responses and Osteoclastic Differentiation in Human Periodontal Ligament Cells[J]. J Cell Biochem, 2015, 116(7): 1241–1255. DOI:10.1002/jcb.25078 |
| [5] | Yu X J, Xiao C J, Du Y M, et al. Effect of hypoxia on the expression of RANKL/OPG in human periodontal ligament cells in vitro[J]. Int J Clin Exp Pathol, 2015, 8(10): 12929–12935. |
| [6] | Fischer R G, Klinge B. Clinical and histological evaluation of ligature-induced periodontitis in the domestic ferret[J]. J Clin Periodontol, 1994, 21(4): 230–239. DOI:10.1111/j.1600-051x.1994.tb00311.x |
| [7] | Loe H, Silness J. Periodontal Disease in Pregnancy: Prevalence and severity[J]. Acta Odontol Scand, 1963, 21: 533–551. DOI:10.3109/00016356309011240 |
| [8] | Llavaneras A, Ramamurthy N S, Heikkil P, et al. A combination of a chemically modified doxycycline and a bisphosphonate synergistically inhibits endotoxin-induced periodontal breakdown in rats[J]. J Periodontol, 2001, 72(8): 1069–1077. DOI:10.1902/jop.2001.72.8.1069 |
| [9] | Gölz L, Memmert S, Rath-Deschner B, et al. Hypoxia and P. gingivalis synergistically induce HIF-1 and NF-κB activation in PDL cells and periodontal diseases[J]. Mediators Inflamm, 2015, 2015: 438085. DOI:10.1155/2015/438085 |
| [10] | Li K, Dong S G, Zhang H X, et al. Expression of RUNX2 and MDM21 in rats with periodontitis under chronic intermittent hypoxia[J]. Asian Pac J Trop Med, 2016, 9(8): 781–785. DOI:10.1016/j.apjtm.2016.06.002 |
| [11] | Schipani E, Maes C, Carmeliet G, et al. Regulation of osteogenesis-angiogenesis coupling by HIFs and VEGF[J]. J Bone Miner Res, 2009, 24(8): 1347–1353. DOI:10.1359/jbmr.090602 |
| [12] | Bullen J W, Tchernyshyov I, Holewinski R J, et al. Protein kinase A-dependent phosphorylation stimulates the transcriptional activity of hypoxia-inducible factor 1[J]. Sci Signal, 2016, 9(430): ra56. DOI:10.1126/scisignal.aaf0583 |
| [13] | Li J P, Li F Y, Xu A, et al. Lipopolysaccharide and hypoxia-induced HIF-1 activation in human gingival fibroblasts[J]. J Periodontol, 2012, 83(6): 816–824. DOI:10.1902/jop.2011.110458 |
| [14] | Song Z C, Zhou W, Shu R, et al. Hypoxia induces apoptosis and autophagic cell death in human periodontal ligament cells through HIF-1α pathway[J]. Cell Prolif, 2012, 45(3): 239–248. DOI:10.1111/j.1365-2184.2012.00810.x |
| [15] | Thornton R D, Lane P, Borghaei R C, et al. Interleukin 1 induces hypoxia-inducible factor 1 in human gingival and synovial fibroblasts[J]. Biochem J, 2000, 350(Pt1): 307–312. DOI:10.1042/0264-6021:3500307 |
| [16] | Tang L, Pei H, Yang Y, et al. The inhibition of calpains ameliorates vascular restenosis through MMP2/TGF-β1 pathway[J]. Sci Rep, 2016, 6: 29975. DOI:10.1038/srep29975 |
| [17] | Ebersole J L, Kirakodu S S, Novak M J, et al. Transcriptome Analysis of B Cell Immune Functions in Periodontitis: Mucosal Tissue Responses to the Oral Microbiome in Aging[J]. Front Immunol, 2016, 7: 272. DOI:10.3389/fimmu.2016.00272 |
| [18] | Deppe J, Popp T, Egea V, et al. Impairment of hypoxia-induced HIF-1α signaling in keratinocytes and fibroblasts by sulfur mustard is counteracted by a selective PHD-2 inhibitor[J]. Arch Toxicol, 2016, 90(5): 1141–1150. DOI:10.1007/s00204-015-1549-y |



