2. 511500 广东 清远,清远市中医院药剂科;
3. 410013 长沙,中南大学:湘雅三医院药剂科
2. Department of Pharmacy, Qingyuan Hospital of Traditional Chinese Medicine, Qingyuan, Guangdong Province, 511500, China;
3. Department of Pharmacy, Third Xiangya Hospital, Central South University, Changsha, Hunan Province, 410013
骨质疏松症 (osteoporosis) 是一种骨量下降和骨微细结构破坏而表现为骨脆性增加的骨退行性疾病。破骨细胞主导的骨吸收与成骨细胞主导的骨形成之间的平衡对于维持骨代谢平衡具有重要作用,当骨吸收大于骨形成时,骨质疏松也就随之发生。
破骨细胞 (osteoclast,OC) 是造血干细胞在单核细胞集落刺激因子、肿瘤坏死因子和白细胞介素17(interleukin 17,IL-17) 等作用下,逐步发育、分化和融合形成的多核巨细胞[1]。破骨细胞是骨组织内到目前为止认识的唯一溶骨细胞,因此,抑制破骨细胞分化和溶骨活性是研究抗骨质疏松药物作用的重要途径。
补骨脂素 (psoralen) 是中药补骨脂的重要化学成分,具有抗癌、增强免疫功能、促进骨骼的再生与重建、抑菌活性等药理活性[2]。本课题组已利用去卵巢骨质疏松大鼠模型证实补骨脂素具有良好的抗绝经后骨质疏松作用,其他学者研究了补骨脂素对成骨细胞功能活动的影响[3-5],补骨脂素对破骨细胞功能活动影响的研究报道很少。因此,研究补骨脂素对破骨细胞分化和功能活动的影响,对于阐明补骨脂素抗骨质疏松作用机制具有重要意义。
1 材料与方法 1.1 材料补骨脂素 (成都曼斯特生物科技有限公司,纯度98%),雌二醇 (Sigma公司),DMEM培养基 (Gibco),α-培养基 (HyClone),胎牛血清FBS (Gibco),核因子κβ受体活化因子配体 (receptor activator for nuclear factor-κB ligand,RANKL,Peprotech公司),抗酒石酸酸性磷酸酶 (tartrate resistant acid phosphatase,TRAP) 染色试剂盒 (Sigma),倒置荧光显微镜 (Nikon Corp),CO2培养箱 (Heal Force),骨片 (自制),甲苯胺蓝染色液 (Solarbio),RT-PCR试剂盒 (Thermo),Cathepsin K、TRAP、基质金属蛋白酶9(matrix metallopeptidase 9,MMP-9)、雌激素受体α(estrogen receptor-alpha,ER-α)、IL-17R ELISA试剂盒 (上海邦奕生物科技有限公司),RAW264.7细胞 (中南大学湘雅医院细胞库),引物由上海生工生物工程股份有限公司设计并合成。
1.2 骨片的制备取新鲜牛股骨头纵切成200 μm厚,面积约为1 cm×1 cm的骨片,用磨刀石磨至厚约50 μm,超声波清洗3次,每次10 min,浸入含75%的酒精中,4 ℃保存备用,种板之前放进DMEM完全培养基中过夜,使用前用无菌双蒸水清洗2次,然后将骨片放在超净工作台上,两面用紫外线各照30 min。
1.3 RAW264.7体外诱导破骨细胞及分组取对数生长期的RAW264.7细胞,以2×104个/mL接种于12孔细胞培养板,DMEM完全培养基培养12 h后,加入含不同药物的α-MEM完全培养基,分别为对照组 (50 ng/mL RANKL)、雌二醇组 (10-6mol/L雌二醇+50 ng/mL RANKL)、补骨脂素高剂量组 (10 μmol/L补骨脂素+50 ng/mL RANKL)、补骨脂素中剂量组 (5 μmol/L补骨脂素+50 ng/mL RANKL)、补骨脂素低剂量组 (2.5 μmol/L补骨脂素+50 ng/mL RANKL),每组3个复孔,每2天换1次培养液。
1.4 破骨细胞TRAP染色于加药培养后的第5天,按照TRAP染色说明书对细胞进行TRAP染色,倒置荧光显微镜下 (×100) 观察,以TRAP (+) 多核细胞 (3个或3个以上) 为破骨细胞,每个处理组随机取6个视野进行破骨细胞计数,取平均值。
1.5 骨吸收陷窝染色于加药培养后的第7天,取出骨片,骨片经4%多聚甲醛固定10 min,在0.25 mol/L氢氧化铵中以80 kHz超声10 min,然后经系列梯度乙醇 (40%、75%、95%、100%) 脱水,每次5 min,自然晾干后经1%甲苯胺蓝染色5 min,自来水冲洗后在光学显微镜 (×100) 下观察骨吸收陷窝。
1.6 RT-PCR检测于加药培养第5天收集各组细胞,加1 mL TRIzol提取总RNA,两步法扩增检测MMP-9、Cathepsin K、TRAP、ER-α、IL-17R的基因表达。PCR扩增程序:预变性:94 ℃,5 min;变性:94 ℃,30 s;退火温度见表 1,30 s;延伸:72 ℃,45 s;35个循环;最后72 ℃,7 min。同时以GAPDH为内参,1.5%的琼脂糖凝胶电泳后用凝胶分析软件Gel-pro analyzer分析条带的光密度值,用目的基因与对应内参光密度的比值作为统计值。
| 基因名称 | 引物序列 | 片段长 度 (bp) |
退火温 度 (℃) |
| Cathepsin K | 正义链:5′-GACCACTGCCTTCCAATACG-3′ 反义链:5′-CATAGCCCACCACCAACACT-3′ |
305 | 53 |
| MMP-9 | 正义链:5′-TGTCATCCAGTTTGGTGTCG-3′ 反义链:5′-TGCCGTCCTTATCGTAGTCAG-3′ |
302 | 53 |
| TRAP | 正义链:5′-GCTGGAAACCATGATCCT-3′ 反义链:5′-TTGAGCCAGGACAGCTGAGT-3′ |
240 | 58 |
| IL-17R | 正义链:5′-CCTCTTCAACATCACCTCCAG-3′ 反义链:5′-CAGCAGTGGGTCTTCAAACA-3′ |
289 | 58 |
| ER-α | 正义链:5′-TCCCGCCTTCTACAGGTCTA-3′ 反义链:5′-TGCCCACTTCGTAACACTTG-3′ |
311 | 55 |
| GAPDH | 正义链:5′-GGTTGTCTCCTGCGACTTCA-3′ 反义链:5′-TGGTCCAGGGTTTCTTACTCC-3′ |
183 | 58 |
1.7 ELISA检测
于加药培养后第5天,收集细胞及上清液,分别按照Cathepsin K、MMP-9、TRAP、ER-α、IL-17R的ELISA试剂盒说明书操作,于450 nm波长检测各孔的光密度值并代入标准曲线计算蛋白表达水平。
1.8 统计学分析所有数据采用SPSS 17.0统计软件进行处理,计量资料以x±s表示,对破骨细胞形成数、骨吸收陷窝形成数、破骨细胞溶骨活性相关基因及蛋白表达量先进行正态性检验和方差齐性检验,方差齐用多个独立样本的单因素方差分析,不齐则采用多个独立样本的非参数检验。检验水准α= 0.05。
2 结果 2.1 补骨脂素对破骨细胞形成数的影响加入RANKL处理3 d后在显微镜下即可看到细胞间隙模糊,细胞互相融合形成破骨细胞的轮廓,第5天融合现象特别明显,经TRAP染液染色之后,细胞胞浆变成酒红色,有的呈圆形或椭圆形,有的呈长条形,细胞核清晰可见,有很多细胞含有至少3个细胞核,多的可达30个,同时可见细胞伸出很多长的伪足,对照组的细胞比较大。与对照组 (33±4) 比较,补骨脂素高 (22±3)、中 (21±2)、低剂量 (25±1) 的破骨细胞数量均明显下降 (P < 0.01,图 1)。
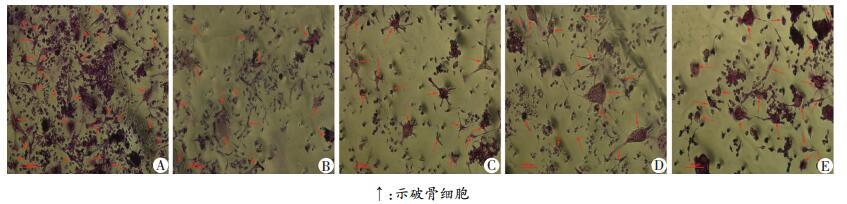
|
| A:对照组;B:雌二醇组;C:补骨脂素高剂量组;D:补骨脂素中剂量组;E:补骨脂素低剂量组 图 1 TRAP染色观察补骨脂素对破骨细胞形成数的影响 |
2.2 补骨脂素对骨吸收陷窝形成数的影响
甲苯胺蓝染色结果显示,骨陷窝染成蓝色或蓝紫色,呈多角形不规则的破骨细胞形状。对照组的骨陷窝数量最多,雌二醇组 (9±4) 的骨吸收陷窝数目最少,补骨脂素高 (13±2)、中 (13±2) 以及低 (16±1) 剂量组与对照组 (20±2) 对比,骨吸收陷窝的数量显著减少 (P < 0.05,P < 0.01,图 2)。

|
| A:对照组;B:雌二醇组;C:补骨脂素高剂量组;D:补骨脂素中剂量组;E:补骨脂素低剂量组 图 2 甲苯胺蓝染色观察补骨脂素对破骨细胞骨吸收陷窝形成数的影响 |
2.3 补骨脂素对破骨细胞溶骨活性相关基因表达的影响
与对照组比较,不同剂量的补骨脂素对Cathepsin K、TRAP、MMP-9、IL-17R基因表达均有显著的抑制作用 (P < 0.05,P < 0.01)。不同剂量的补骨脂素均显著促进作用ER-α基因表达 (P < 0.01),并呈现剂量依赖性 (图 3)。
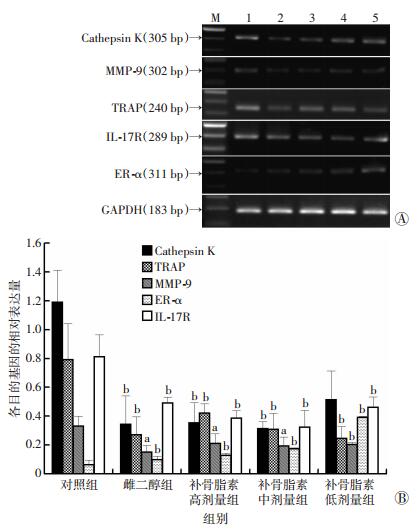
|
| A:RT-PCR检测结果M:标准;1:对照组;2:雌二醇组;3:补骨脂素高剂量;4:补骨脂素中剂量;5:补骨脂素低剂量;B:Cathepsin K、MMP-9、TRAP、ER-α、IL-17R基因表达定量分析结果a:P < 0.05,b:P < 0.01,与对照组比较 图 3 RT-PCR检测补骨脂素对破骨细胞Cathepsin K、MMP-9、TRAP、ER-α、IL-17R基因表达的影响 |
2.4 补骨脂素对破骨细胞溶骨活性相关蛋白含量的影响
与对照组比较,高、中剂量的补骨脂素对Cathepsin K蛋白含量有显著的抑制作用 (P < 0.01);高、中、低剂量的补骨脂素对TRAP、MMP-9、IL-17R的蛋白含量有显著的抑制作用 (P < 0.05,P < 0.01),高、中、低剂量的补骨脂素均显著促进ER-α的蛋白表达 (P < 0.01,表 2)。
| 组别 | Cathepsin K (ng/L) | MMP-9 (μg/L) | TRAP (μg/mL) | ER-α(ng/mL) | IL-17R (ng/L) |
| 对照组 | 102.72±7.84 | 25.04±1.88 | 15.05±1.64 | 20.33±2.65 | 1.45±0.19 |
| 雌二醇组 | 59.86±12.33b | 15.43±3.45b | 9.04±1.52b | 26.31±1.70b | 0.77±0.14b |
| 补骨脂素高剂量组 | 60.06±6.07b | 17.25±1.01b | 11.01±1.16b | 26.63±1.57b | 1.02±0.19b |
| 补骨脂素中剂量组 | 70.94±7.16b | 19.61±2.93a | 12.31±1.01a | 25.97±1.53b | 1.15±0.11a |
| 补骨脂素低剂量组 | 79.57±9.35a | 19.58±2.26a | 12.64±1.12a | 28.35±2.65b | 1.17±0.07a |
| a: P < 0.05, b: P < 0.01,与对照组比较 | |||||
3 讨论
补骨脂素是补骨脂抗骨质疏松作用的重要活性成分,能显著改善去卵巢骨质疏松大鼠模型的骨代谢[5]。有学者从成骨细胞角度研究了补骨脂素抗骨质疏松的机制,但是其对破骨细胞功能活动影响尚不清楚。本实验系统地研究了补骨脂素对破骨细胞的数目、溶骨活性和标志基因TRAP、Cathepsin K、MMP-9以及相关受体ER-α、IL-17R的影响。RAW264.7细胞是一种小鼠单核/巨噬细胞,可以在RANKL诱导下分化成破骨细胞,是研究破骨细胞发育、功能和药物作用的模式细胞[6-7]。本研究结果表明,补骨脂素能显著抑制RANKL诱导RAW264.7细胞发育成破骨细胞,抑制骨陷窝形成,体现了良好的抑制破骨细胞功能活动作用。
破骨细胞附着在骨基质表面,通过破骨细胞波状缘分泌的酸和蛋白酶在破骨细胞和骨基质之间形成一个空隙。其中TRAP与其他酶一起参与骨基质中固体钙磷矿化物的降解,Cathepsin K、MMP-9参与降解骨基质中的有机基质 (如胶原和弹性蛋白)[8-9]。骨质疏松过程既包括无机骨基质的丢失,也包括有机骨基质的丢失。本实验结果表明,补骨脂素显著降低TRAP、Cathepsin K、MMP-9基因和蛋白的表达,与抑制骨陷窝形成数密切相关,显示补骨脂素对破骨细胞的溶骨活性具有显著抑制作用。
雌激素信号传导途径在调节破骨细胞功能活动中具有重要作用,雌激素通过与雌激素受体结合抑制破骨细胞的分化和溶骨活性[10]。本课题组已经在去卵巢骨质疏松大鼠模型表明补骨脂素可升高骨组织的雌激素受体表达,但尚不能确定是否能增强破骨细胞的雌激素受体表达[5]。本研究表明,补骨脂素可以显著增强破骨细胞的雌激素受体表达,已有学者研究表明补骨脂素可以直接与雌激素受体结合[11]。因此,补骨脂素通过增强破骨细胞雌激素受体表达,增强雌激素信号传导而抑制破骨细胞的分化和功能。IL-17是由Th17细胞分泌的一种炎性细胞因子,可直接促进破骨细胞分化[12], 与破骨细胞膜IL-17R结合能激活下游NF-κB信号通路,从而提高RANK的表达而诱导破骨细胞分化和溶骨活性[13-14]。本实验结果表明,补骨脂素能显著降低破骨细胞IL-17R的表达,提示补骨脂素通过降低IL-17R的表达而抑制IL-17信号传导途径。
综上所述,补骨脂素能抑制RANKL诱导RAW264.7向破骨细胞分化,抑制破骨细胞的溶骨活性。该抑制作用机制一方面通过增强破骨细胞雌激素受体表达,另一方面通过抑制破骨细胞IL-17R的表达而实现。至于是否还有其他作用途径,有待进一步研究。
| [1] |
王链链, 郭晓英. 破骨细胞分化过程中的信号通路及信号因子的研究进展[J].
中国骨质疏松杂志, 2015, 21(6): 742–748.
Wang L L, Guo X Y. Research advance in signal pathways and signal factors during the process of osteoclast differentiation[J]. Chin J Osteopor, 2015, 21(6): 742–748. DOI:10.3969/j.issn.1006-7108.2015.06.025 |
| [2] |
柴丽娟, 张晗, 王少峡, 等. 中药补骨脂的药理作用研究进展[J].
海峡药学, 2013, 25(7): 12–14.
Chai L J, Zhang H, Wang S X, et al. Research Progress on pharmacological effects of psoralen[J]. Strait Pharmaceutical Journal, 2013, 25(7): 12–14. DOI:10.3969/j.issn.1006-3765.2013.07.004 |
| [3] |
张润荃, 史凤芹, 庞淑珍, 等. 补骨脂对分离破骨细胞作用研究[J].
现代口腔医学杂志, 1995, 9(3): 136–138.
Zhang R Q, Shi F Q, Pang S Z, et al. Study on the effect of psoralen on osteoclast separation[J]. Journal of Modern Stomatology, 1995, 9(3): 136–138. |
| [4] |
柴丽娟, 樊娜, 王虹, 等. 补骨脂单体成分对体外培养成骨细胞和破骨细胞分化的影响[J].
天津中医药, 2015, 32(5): 299–303.
Chai L J, Fan N, Wang H, et al. The effects of psoralen components on mice osteoblast and osteoclast differentiation in vitro[J]. Tianjin Journal of Traditional Chinese Medicine, 2015, 32(5): 299–303. DOI:10.11656/j.issn.1672-1519.2015.05.12 |
| [5] |
杨琳, 曾英, 李劲平, 等. 补骨脂素对去势雌鼠E2、ERβ、TNF-α、IL-17的影响[J].
中国骨质疏松杂志, 2016, 22(4): 387–392.
Yang L, Zeng Y, Li J P, et al. Effects of psoralen on E2, ER beta, TNF-alpha, IL-17 of ovariectomized rats[J]. Chin J Osteopor, 2016, 22(4): 387–392. DOI:10.3969/j.issn.1006-7108.2016.04.001 |
| [6] | Yamamoto A, Miyazaki T, Kadono Y, et al. Possible involvement of IkappaB kinase 2 and MKK7 in osteoclastogenesis induced by receptor activator of nuclear factor kappaB ligand[J]. J Bone Miner Res, 2002, 17(4): 612–621. DOI:10.1359/jbmr.2002.17.4.612 |
| [7] | Mizukami J, Takaesu G, Akatsuka H, et al. Receptor activator of Nf kappaB ligand (RANKL) activates TAK1 mitogen-activated protein kinase kinase through a signaling complex containing RANK. TAB2, and TRAF6[J]. Mol Cell Biol, 2002, 22(4): 992–1000. DOI:10.1128/MCB.22.4.992-1000.2002 |
| [8] |
何伟涛, 刘康, 孙金谞, 等. 组织蛋白酶k与骨质疏松症治疗的研究进展[J].
中国骨质疏松杂志, 2008, 14(9): 670–673.
He W T, Liu K, Sun J X, et al. Research advance of cathepsin K and the treatment of osteoporosis[J]. Chin J Osteopor, 2008, 14(9): 670–673. DOI:10.3969/j.issn.1006-7108.2008.09.016 |
| [9] | He B, Hu M, Li S D, et al. Effects of geraniin on osteoclastic bone resorption and matrix metalloproteinase-9 expression[J]. Bioorg Med Chem Lett, 2013, 23(3): 630–634. DOI:10.1016/j.bmcl.2012.12.005 |
| [10] | Imai Y, Youn M Y, Kondoh S, et al. Estrogens maintain bone mass by regulating expression of genes controlling function and life span in mature osteoclasts[J]. Ann N Y Acad Sci, 2009, 1173(Suppl 1): E31–E39. DOI:10.1111/j.1749-6632.2009.04954.x |
| [11] |
赵丕文, 牛建昭, 王继峰, 等. 补骨脂素的植物雌激素作用及其机制探讨[J].
中国中药杂志, 2008, 33(1): 59–63.
Zhao P W, Niu J Z, Wang J F, et al. Study of the phytoestrogenic effect of psoralen and its mechanism[J]. Chin J Chin Mater Med, 2008, 33(1): 59–63. DOI:10.3321/j.issn:1001-5302.2008.01.015 |
| [12] | Hayashi N, Yamaguchi M, Nakajima R, et al. T-helper 17 cells mediate the osteo/odontoclastogenesis induced by excessive orthodontic forces[J]. Oral Dis, 2012, 18(4): 375–388. DOI:10.1111/j.1601-0825.2011.01886.x |
| [13] | DeSelm C J, Takahata Y, Warren J, et al. IL-17 mediates estrogen-deficient osteoporosis in an Act1-dependent manner[J]. J Cell Biochem, 2012, 113(9): 2895–2902. DOI:10.1002/jcb.24165 |
| [14] |
施沛青, 朱书, 钱友存. IL-17的信号传导及功能研究[J].
中国细胞生物学学报, 2011, 33(4): 345–357.
Shi P Q, Zhu S, Qian Y C. Study of the signal transduction and function of IL-17[J]. Chinese Journal of Cell Biology, 2011, 33(4): 345–357. |



