2. 400042 重庆,第三军医大学大坪医院野战外科研究所:第四研究室,创伤、烧伤与复合伤国家重点实验室;
3. 400014 重庆,重庆医科大学附属儿童医院重症医学科,儿童发育疾病研究教育部重点实验室
2. State Key Laboratory of Trauma, Burns and Combined Injury, Department 4, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042;
3. Department of Critical Medicine, Key Laboratory of Child Development and Disorders of Ministry of Education, Children's Hospital of Chongqing Medical University, Chongqing, 400014, China
骨代谢是一个动态的过程,骨形成和骨吸收的动态平衡是维持正常骨代谢的关键点。成骨细胞所引起的骨形成与破骨细胞所致骨吸收之间的平衡是维持骨代谢稳态的前提,如骨形成少于骨吸收时,将导致骨质疏松、牙周病、骨关节炎、风湿性关节炎等骨疾病[1];反之则导致骨硬化疾病[2]。其中,成骨细胞是骨代谢平衡的关键环节之一,其活性可以被多种因素调节,如维生素D3、激素、局部生长因子和细胞因子[3-5]。
肠富集Krüppel样因子 (Krüppel like factor 4,KLF4) 属于KLFs家族的一员,其主要在消化道表达[6]。KLF4在多种组织及细胞中大量表达,通过调节靶基因的转录从而调控多种细胞的周期、增殖分化、凋亡以及胚胎发育和肿瘤发生[7-8]。已有研究表明KLF4在骨组织中大量表达[9],我们前期实验发现在成骨细胞成骨分化过程中KLF4持续高表达,但其在成骨分化中发挥的作用却不清楚。本实验通过将构建成功的腺病毒介导的KLF4基因转染小鼠成骨细胞,观察其对成骨细胞成骨分化的影响,探讨KLF4对成骨细胞成骨分化的可能作用机制,旨在为骨代谢疾病的治疗研究进一步奠定基础。
1 材料与方法 1.1 实验材料α-MEM培养基 (HyClone,美国);胎牛血清 (Gibco,美国);Ⅱ型胶原酶 (Sigma,美国);胰蛋白酶 (Gibco,美国);DPBS (HyClone,美国);兔来源单克隆KLF4抗体 (Abcam,美国);山羊抗兔IgG二抗 (博奥森,中国);TRIzol Reagent (Life,美国);超净工作台 (Airtech,日本);CO2恒温培养箱 (Thermo Life sciences,美国);倒置相差显微镜 (Olympus CKX41,日本)。
1.2 实验方法 1.2.1 成骨细胞的培养及鉴定 1.2.1.1 小鼠原代成骨细胞的分离培养取出生96 h内的C57新生小鼠 (雌雄不限,购自第三军医大学大坪医院实验动物中心),75%乙醇浸泡5 min,无菌条件下取新生小鼠颅骨盖,小心去除颅盖骨内外骨膜及结缔组织,DPBS反复冲洗,于0.25%胰蛋白酶消化20 min,剪成小碎片,在0.1%Ⅱ型胶原酶消化液中消化2 h。小心收集细胞悬液,离心,于10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的α-MEM培养液中重悬。5% CO2、37 ℃培养箱中培养。24 h第1次换液,之后每2天换液1次,待细胞长满培养皿,消化传代培养。
1.2.1.2 成骨细胞鉴定取第2代细胞,接种于6孔板内,将成骨细胞随机分为诱导组及对照组,2组细胞均于常规培养基中培养48 h后,诱导组更换矿化诱导培养基 (含抗坏血酸50 mg/L, β-甘油磷酸钠10 mmol/L),对照组继续常规培养基培养,每3天换液1次。第21天时行茜素红染色 (Sigma公司),4%多聚甲醛固定30 min,1%茜素红染色液染色15 min,DPBS冲洗,显微镜下观察,扫描留像。
1.2.2 重组腺病毒构建及鉴定Ad-GFP及Ad-KLF4为汉恒生物协助完成携带KLF4基因重组腺病毒的构建及包装。参照小鼠KLF4基因全长序列相关信息 (NM 010637.3) 合成目的基因,EcoR Ⅰ、Mlu双酶切后琼脂糖电泳并回收,连入pHBAd-EF1-MCS-GFP腺病毒载体 (上海汉恒生物),转化大肠杆菌菌株,PCR鉴定阳性得到阳性重组子并进行测序鉴定。经包装及多次扩增获得高滴度重组腺病毒。
1.2.3 最佳感染复数 (multiplicity of infection,MOI) 值测定取生长状态良好的第2代细胞,接种于6孔板中,细胞覆盖率约70%时,按感染复数 (MOI值)0、80、100、200、300 PFU/mL分别加入Ad-GFP病毒液,1/2体积的无血清无双抗培养液,6 h后换常规培养基,36 h后用荧光显微镜观察荧光表达情况,流式细胞仪测定细胞转染效率。
1.2.4 Western blot检测蛋白表达重组腺病毒转染成骨细胞,36 h后在冰上操作,DPBS洗3次,用RIPA裂解液裂解细胞,快速收集蛋白裂解液,4 ℃离心收集上清 (12 000 r/min,15 min)。BCA测定蛋白浓度,将定量后的蛋白裂解液加上样缓冲液处理,样品经10% SDS-PAGE电泳后,转移至PVDF膜。TBST配置的3%BSA封闭1 h,加入兔来源KLF4单克隆抗体稀释液,4 ℃孵育过夜。加入二抗稀释液 (1 :1 000),TBST荡洗3次,采用化学发光法对条带进行曝光扫描。
1.2.5 MTT检测成骨细胞增殖取生长状态良好的第2代成骨细胞,以每孔5×103接种至96孔板,每孔各6个复孔,培养箱培养过夜。将细胞随机分为对照组、KLF4组 (Ad-KLF4转染) 和GFP组 (Ad-GFP转染),分别于0、1、2、3、4、5 d每孔加入5 mg/mL MTT工作液100 μL,4 h后去上清,加入二甲基亚砜,震荡10 min充分溶解结晶物,酶联免疫仪在490 nm处检测光密度值[D(490)]。绘制生长曲线,观察Ad-GFP及Ad-KLF4转染后对成骨细胞增殖的影响。
1.2.6 成骨细胞成骨分化基因检测成骨细胞以每孔2×105接种到6孔板中,随机分为对照组 (未转染组)、KLF4组 (Ad-KLF4转染) 和GFP组 (Ad-GFP转染),以MOI=100 PFU/mL,分别转染Ad-GFP、Ad-KLF4。感染36 h后采用TRIzol提取细胞总RNA,超微量分光光度计在波长260 nm和280 nm处测定光密度值,计算RNA的纯度。按照cDNA反转录试剂盒 (Roche公司) 说明书操作,将RNA反转录为cDNA,于-20 ℃保存。根据GenBank中相关基因序列,用Primer Premier 5.0设计引物,上海生工合成引物。采用Real-time PCR检测相关基因的变化。
| 基因 | 引物序列 (5′→3′) | 产物大小 (bp) |
| KLF4 | 上游:AAAGAACAGCCACCCACACT 下游:TGGTAAGGTTTCTCGCCTGT |
109 |
| RUNX2 | 上游:CCTCTGACTTCTGCCTCTGG 下游:ATGAAATGCTTGGGAACTGC |
105 |
| ALP | 上游:CGTGGGCATTGTGACTACC 下游:CTGGTGGCATCTCGTTATCC |
104 |
| BSP | 上游:AATGGAGACGGCGATAGTTC 下游:CCCGAGAGTGTGGAAAGTGT |
137 |
| GAPDH | 上游:AGGCCGGTGCTGAGTATGTC 下游:TGCCTGCTTCACCACCTTCT |
233 |
1.3 统计学分析
采用SPSS 15.0统计软件,计量资料均经正态性及方差齐性检验,数据以x±s表示,采用方差分析,组间两两比较采用LSD检验,检验水准:α=0.05。
2 结果 2.1 成骨细胞形态及鉴定经酶消化法获得小鼠成骨细胞原代,倒置显微镜观察可见24 h后原代细胞呈不规则的细胞突起,有伪足,呈多边形、立方形等,细胞核仁呈圆形或者椭圆形位于细胞核一侧或居中;4~5 d后,细胞排列紧密呈多层生长,呈铺路石样 (图 1)。经成骨培养液诱导培养21 d后,与对照组相比,诱导组镜下可见大量大小、形态不一的钙化结节,茜素红染色可见大量橘红色的钙化结节 (图 2)。

|
| A、B:原代培养1 d;C、D:原代培养4 d 图 1 原代培养不同时间成骨细胞形态 |

|
| A、C:对照组;B、D:诱导组 图 2 成骨细胞鉴定 |
2.2 重组腺病毒Ad-KLF4的构建
经限制性酶切成功构建出携带KLF4基因的腺病毒表达载体质粒 (图 3A);对腺病毒KLF4表达质粒、包装质粒分别进行高纯度无内毒素质粒抽提;大量扩增病毒并纯化,经琼脂糖凝胶电泳,可见扩增的目的基因片段大小为1 425 bp (图 3B),表明过表达KLF4腺病毒构建成功。

|
| A:重组腺病毒载体KLF4的酶切鉴定1:DNA标准;2:KLF4酶切产物 (目的条带位于1 500 bp);B:PCR扩增产物电泳结果1:DNA标准;2~8: KLF4单克隆PCR产物 图 3 重组KLF4腺病毒的构建 |
2.3 过表达KLF4腺病毒感染成骨细胞确定最适感染复数
采用不同MOI值 (0、80、100、200、300 PFU/mL) 将Ad-GFP与Ad-KLF4分别转染成骨细胞。荧光显微镜下观察转染效率,发现当MOI=0 PFU/mL时,未见明显绿色荧光细胞;MOI=80 PFU/mL时,转染效率约为80%;当MOI值=100 PFU/mL时,转染效率可到达85%且细胞形态呈立方形或长梭形;随着MOI值不断升高,转染效率越高;当MOI=300 PFU/mL时,可见大量荧光细胞,细胞转染率约为90%以上,但细胞形态不规则,呈扁平样或者圆形,细胞活力降低,可见大量死亡细胞悬浮于培养基中 (图 4)。因此本实验将MOI= 100 PFU/mL作为最适宜MOI。
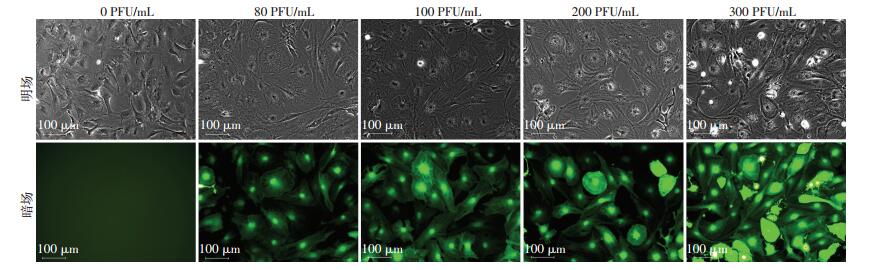
|
| 图 4 检测过表达KLF4腺病毒对成骨细胞的转染效率 |
2.4 腺病毒转染后KLF4蛋白的表达
按MOI=100 PFU/mL的重组腺病毒Ad-KLF4转染成骨细胞,以GFP组以及对照组作为阴性对照,感染36 h后收集蛋白,Western blot检测结果显示,KLF4组中KLF4蛋白表达明显高于GFP组 (P < 0.01) 以及对照组 (P < 0.01),而GFP组与对照组相比差异无统计学意义 (P > 0.05,图 5)。
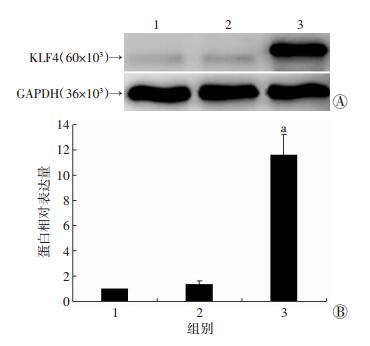
|
| 1:对照组;2:GFP组;3:KLF4组A:Western blot检测结果;B:半定量分析结果a:P < 0.01,与对照组及GFP组比较 图 5 Western blot检测成骨细胞经Ad-GFP、Ad-KLF4转染36 h后KLF4蛋白的表达 |
2.5 过表达KLF4腺病毒对成骨细胞增殖的影响
按MOI=100 PFU/mL转染成骨细胞,Ad-GFP与Ad-KLF4均表达绿色荧光,采用MTT检测在1、2、3、4、5、6 d成骨细胞的增殖情况,KLF4组与GFP组、对照组相比,各时间点生长曲线明显高于对照组与GFP组 (P < 0.05,P < 0.01),而GFP组与对照组相比差异无统计学意义 (P > 0.05,图 6)。
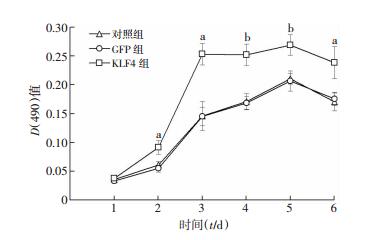
|
| a:P < 0.05,b:P < 0.01,与对照组及GFP组比较 图 6 MTT检测过表达KLF4腺病毒对成骨细胞增殖的影响 |
2.6 Real-time PCR检测过表达KLF4对成骨分化基因的影响
为了探讨KLF4上调对成骨细胞成骨分化的影响,Ad-KLF4处理36 h后,提取细胞总RNA,采用Real-time PCR检测成骨分化相关基因的表达。结果显示:与对照组及GFP组相比,KLF4组中KLF4 mRNA水平显著上升 (P < 0.01);KLF4组ALP、BSP、RUNX2的mRNA表达显著下降 (P < 0.05,P < 0.01,图 7)。
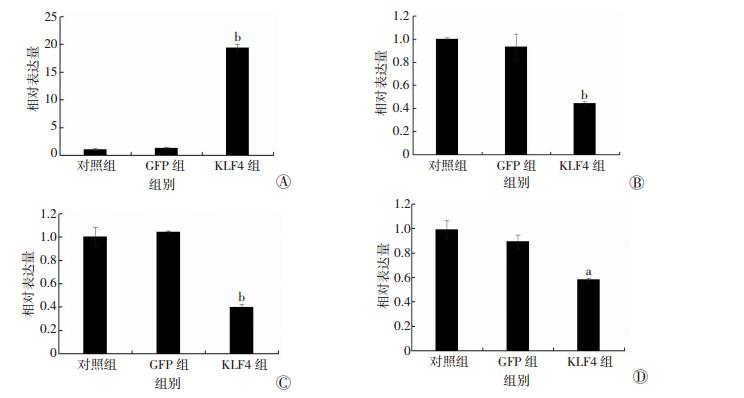
|
| a:P < 0.05,b:P < 0.01,与对照组及GFP组比较A:KLF4;B:ALP;C:BSP;D:RUNX2 图 7 Real-time PCR检测过表达KLF4对成骨分化基因的影响 |
3 讨论
骨代谢中成骨细胞所造成的骨形成与破骨细胞所致的骨吸收相互耦联,维持着骨动态平衡。成骨细胞与破骨细胞之间的失衡会导致大量骨代谢疾病的发生。成骨细胞的主要功能是合成和分泌骨胶原,形成骨基质,促进骨形成,其与骨骼的正常生长发育密切相关。因此,在骨代谢疾病中对成骨细胞功能的研究就显得尤为重要。
KLF4是真核生物中广泛存在的一类转录元件结合蛋白,通过羧基端3个连续C2H2结构域结合靶基因启动子内GC富含序列调节下游靶基因的转录表达[6]。作为核转录因子,KLF4具有激活和抑制的双重调节功能,在不同的组织中起着相似或截然相反的转录调节作用[10-11]。在高磷条件下,KLF4表达上升可抑制血管平滑肌分化相关基因表达,同时促进成骨样分化[12]。而在中枢神经细胞轴突延伸过程中,过表达KLF4可抑制神经细胞轴突分化及再生[13]。KLF4在骨组织中大量表达[9],先前的研究发现在过表达KLF4的转基因小鼠中,新生小鼠出现围产期的大量死亡,其中小鼠颅骨形成出现明显发育延迟同时伴有全身骨骼发育障碍尤为明显[14-15]。因此,结合前期的实验我们推测KLF4在成骨细胞成骨分化过程中发挥了不可或缺的作用。
ALP是成骨细胞早期分化的标志分子,增加细胞外基质的磷酸含量,促使细胞外基质矿化[16]。BSP主要在成骨细胞分化的晚期表达,是成骨细胞矿化所必需的[17]。RUNX2是成骨细胞发生与分化的关键特异性转录因子,可上调Ⅰ型胶原酶 (COL1)、骨钙素、骨桥蛋白及骨连接蛋白等的转录,进而促进成骨细胞的分化与成熟[18]。RUNX2基因敲除小鼠在出生后即刻死亡,新生小鼠由于成骨分化能力受限,出现骨骼发育障碍及异常。本实验通过成功构建过表达KLF4的腺病毒,并将其转染至成骨细胞,发现KLF4可促进成骨细胞增殖,抑制成骨细胞成骨分化相关基因ALP、BSP、RUNX2的表达。
骨代谢过程中成骨细胞分化是一个动态的过程,需要经历细胞增殖、基质成熟、基质矿化和凋亡,在整个分化过程中,成骨细胞特异性地合成一些蛋白质,参与调控成骨细胞分化。当成骨细胞作为骨形成的主要功能细胞时,成骨细胞需要增殖到一定数量,而后经过骨基质成熟及矿化,最终形成骨组织。因此,本研究表明在成骨细胞的增殖期,过表达KLF4对骨组织形成是有利的。但是,过表达KLF4可抑制成骨细胞成骨分化相关基因ALP、BSP、RUNX2的表达,表明持续的KLF4上调可抑制成骨细胞的成熟以及矿化。有研究报道KLF4与OCT4、SOX2、C-MYC可以将小鼠成纤维细胞编程为诱导多能干细胞[19],同时KLF4可以促进干细胞更新,抑制骨髓间充质干细胞分化[20]。在小鼠扁骨以及长骨发育过程中,KLF4在未成熟的成骨细胞中大量表达,而在成熟成骨细胞中其表达却显著减少[15]。这些结果推测在成骨细胞成骨分化过程中,KLF4将成骨细胞祖细胞维持在相对未成熟状态,从而抑制成骨细胞分化。因此,过表达的KLF4在成骨分化的不同阶段发挥不同的作用。
本研究表明,KLF4在成骨细胞成骨分化过程中发挥了不可或缺的作用。在本实验体系中,KLF4可以促进成骨细胞增殖,抑制成骨细胞成骨分化标志基因ALP、BSP、RUNX2表达,从而抑制成骨细胞分化,为临床上骨代谢相关疾病的治疗提供了新靶点。今后我们将进一步探讨KLF4对成骨细胞成骨分化不同阶段的影响以及其潜在的分子机制。
| [1] | Khosla S, Oursler M J, Monroe D G. Estrogen and the skeleton[J]. Trends Endocrinol Metab, 2012, 23(11): 576–581. DOI:10.1016/j.tem.2012.03.008 |
| [2] | Sobacchi C, Schulz A, Coxon F P, et al. Osteopetrosis: genetics, treatment and new insights into osteoclast function[J]. Nat Rev Endocrinol, 2013, 9(9): 522–536. DOI:10.1038/nrendo.2013.137 |
| [3] | Vestergaard P, Rejnmark L, Mosekilde L. Selective serotonin reuptake inhibitors and other antidepressants and risk of fracture[J]. Calcif Tissue Int, 2008, 82(2): 92–101. DOI:10.1007/s00223-007-9099-9 |
| [4] | Gothard D, Smith E L, Kanczler J M, et al. In Vivo Assessment of Bone Regeneration in Alginate/Bone ECM Hydrogels with Incorporated Skeletal Stem Cells and Single Growth Factors[J]. PLoS ONE, 2015, 10(12): e0145080. DOI:10.1371/journal.pone.0145080 |
| [5] | Bouvard B, Abed E, Yéléhé-Okouma M, et al. Hypoxia and vitamin D differently contribute to leptin and dickkopf-related protein 2 production in human osteoarthritic subchondral bone osteoblasts[J]. Arthritis Res Ther, 2014, 16(5): 459. DOI:10.1186/s13075-014-0459-3 |
| [6] | McConnell B B, Yang V W. Mammalian Krüppel-like factors in health and diseases[J]. Physiol Rev, 2010, 90(4): 1337–1381. DOI:10.1152/physrev.00058.2009 |
| [7] | Evans P M, Liu C. Roles of Krüpel-like factor 4 in normal homeostasis, cancer and stem cells[J]. Acta Biochim Biophys Sin (Shanghai), 2008, 40(7): 554–564. DOI:10.1111/j.1745-7270.2008.00439.x |
| [8] | Sung M T, Hsu H T, Lee C C, et al. Krüppel-like factor 4 modulates the migration and invasion of hepatoma cells by suppressing TIMP-1 and TIMP-2[J]. Oncol Rep, 2015, 34(1): 439–446. DOI:10.3892/or.2015.3964 |
| [9] | Kim J H, Kim K, Youn B U, et al. Krüppel-like factor 4 attenuates osteoblast formation, function, and cross talk with osteoclasts[J]. J Cell Biol, 2014, 204(6): 1063–1074. DOI:10.1083/jcb.201308102 |
| [10] | Song C Z, Keller K, Murata K, et al. Functional interaction between coactivators CBP/p300, PCAF, and transcription factor FKLF2[J]. J Biol Chem, 2002, 277(9): 7029–7036. DOI:10.1074/jbc.M108826200 |
| [11] | Tien Y T, Chang M H, Chu P Y, et al. Downregulation of the KLF4 transcription factor inhibits the proliferation and migration of canine mammary tumor cells[J]. Vet J, 2015, 205(2): 244–253. DOI:10.1016/j.tvjl.2014.12.031 |
| [12] | Yoshida T, Yamashita M, Hayashi M. Krüppel-like factor 4 contributes to high phosphate-induced phenotypic switching of vascular smooth muscle cells into osteogenic cells[J]. J Biol Chem, 2012, 287(31): 25706–25714. DOI:10.1074/jbc.M112.361360 |
| [13] | Moore D L, Blackmore M G, Hu Y, et al. KLF family members regulate intrinsic axon regeneration ability[J]. Science, 2009, 326(5950): 298–301. DOI:10.1126/science.1175737 |
| [14] | Yoshida T, Gan Q, Owens G K. Krüppel-like factor 4, Elk-1, and histone deacetylases cooperatively suppress smooth muscle cell differentiation markers in response to oxidized phospholipids[J]. Am J Physiol Cell Physiol, 2008, 295(5): C1175–C1182. DOI:10.1152/ajpcell.00288.2008 |
| [15] | Michikami L, Fukushi T, Tanaka M, et al. Krüppel-like factor 4 regulates membranous and endochondral ossification[J]. Exp Cell Res, 2012, 318(4): 311–325. DOI:10.1016/j.yexcr.2011.12.013 |
| [16] | Komori T. Regulation of osteoblast differentiation by Runx2[J]. Adv Exp Med Biol, 2010, 658: 43–49. DOI:10.1007/978-1-4419-1050-9_5 |
| [17] | Marinovich R, Soenjaya Y, Wallace G Q, et al. The role of bone sialoprotein in the tendon-bone insertion[J]. Matrix Biol, 2016: 52–54. DOI:10.1016/j.matbio.2016.01.016 |
| [18] | Fakhry M, Hamade E, Badran B, et al. Molecular mechanisms of mesenchymal stem cell differentiation towards osteoblasts[J]. World J Stem Cells, 2013, 5(4): 136–148. DOI:10.4252/wjsc.v5.i4.136 |
| [19] | Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4): 663–676. DOI:10.1016/j.cell.2006.07.024 |
| [20] | Saulnier N, Puglisi M A, Lattanzi W, et al. Gene profiling of bone marrow-and adipose tissue-derived stromal cells: a key role of Krüppel-like factor 4 in cell fate regulation[J]. Cytotherapy, 2011, 13(3): 329–340. DOI:10.3109/14653249.2010.515576 |



