近年来,作为心血管疾病之一的脑卒中,发病率呈上升趋势,并且具有高病死率和高致残率,严重影响生活质量[1-2]。然而针对脑卒中出现的神经缺血性损伤仍没有非常有效可靠的治疗方法和药物,因此探讨神经缺血性损伤保护具有非常重要的意义。
脾酪氨酸激酶(spleen tyrosine kinase,SYK)是一种非受体型蛋白酪氨酸激酶,广泛表达于各种细胞包括纤维母细胞,上皮细胞,神经细胞等[3-5]。文献报道SYK参与了神经生长的过程[6]以及调控胚胎性癌神经样细胞的分化[7]。有研究表明SYK与多种细胞的凋亡有密切关系,如人类嗜酸性粒细胞、慢性淋巴细胞白血病细胞、乳腺癌细胞等[8-10],然而迄今为止还没有SYK与缺氧诱导的大脑皮质神经元凋亡关系的相关报道。原癌基因Fra-1(Fos related antigen-1) 与细胞凋亡有关,但是它在缺氧诱导的大脑皮质神经元凋亡中有何作用同样不清楚。因此本研究通过单独或联合抑制SYK以及Fra-1探讨二者对缺氧诱导的大脑皮质神经元凋亡的影响及可能机制,为脑卒中出现的神经缺血性死亡的治疗寻找的新的靶点。
1 材料与方法 1.1 材料 1.1.1 实验动物10只SD怀孕大鼠, 190~230 g, 胎龄16 d,由中国医学科学院实验动物中心提供。这项研究严格按照国家卫生和医学研究委员会对实验用动物护理和使用的指导方针。
1.1.2 实验材料青霉素、链霉素、DMEM培养基和胎牛血清购自美国Gibco公司;兔抗鼠MAP2多抗、SYK鼠单抗、PE标记的羊抗兔二抗和Fra-1鼠单抗购自英国Abcam公司;GAPDH鼠单抗和辣根过氧化物酶标记的羊抗鼠二抗购自北京博奥森生物技术有限公司;Trizol和SYBR Premix Ex Taq Ⅱ购自大连宝生物工程有限公司;BCA试剂盒购自美国Pierce公司;Earle’s液购自森贝伽(南京)生物公司;Turbofect购自赛默飞世尔科技公司;siRNA购自上海吉玛制药技术有限公司。
1.2 方法 1.2.1 大脑皮层神经细胞的培养和鉴定无菌条件下,将怀孕16 d大鼠胎鼠的大脑皮层分离,快速置于含有0.25%胰蛋白酶的DMEM培养基中,于37 ℃消化50 min,后反复吹打使细胞尽可能分散。将含有5.0×108/L细胞的悬液移至涂有多聚-D-赖氨酸的24孔板上,加含有10 %马血清,10%小牛血清,100×103U/L青霉素,100×103 U/L链霉素的DMEM,于37 ℃含5%CO2的细胞培养箱中培养36 h,然后换新鲜的培养基去除未贴壁的细胞。第5 d后,加入阿糖胞苷(10 μmol/L)作用24 h抑制非神经细胞的生长。继续培养4 d后,相继加入4%多聚甲醛,室温下作用30 min;后加入0.2%Triton X-100室温作用20 min,2.5%脱脂奶粉封闭作用30 min。兔抗鼠MAP2多抗4 ℃孵育过夜,后加PE标记的羊抗兔二抗,37 ℃孵育1.5 h,荧光显微镜下观察。
1.2.2 神经细胞缺氧/缺糖处理原培养基换为无糖Earle’s液,置于95%N2和5 % CO2的环境下培养8 h。然后用无血清的DMEM换掉Earle’s液,置于细胞培养箱中培养15 h。另外,不进行缺氧/缺糖处理的Normal组细胞换成含糖的Earle’s液,置于37 ℃含5% CO2的细胞培养箱中孵育8 h后换掉Earle’s液,加入无血清的DMEM,于培养箱中培养15 h。
1.2.3 Caspase-3活性检测收获细胞,经PBS洗涤后对Caspase-3进行活性检测,操作步骤按照试剂盒(BD ApoAlert Caspase-3 Fluorescent Assay Kit)说明书进行,记录结果。
1.2.4 Annexin-Ⅴ FITC/PI检测利用Annexin-Ⅴ fluorescein isothiocyanate conjugate and propidium iodide(Annexin-Ⅴ FITC/PI)方法检测细胞凋亡情况。操作步骤参照Annexin-Ⅴ FITC/PI试剂盒说明书进行。首先PBS预冷细胞,后用13 μL浓度为1 μL/mL的Annexin-Ⅴ FITC于4 ℃孵育预冷的细胞35 min,而后洗细胞,8 μL PI孵育7 min,利用流式细胞仪检测,统计细胞的凋亡情况。
1.2.5 细胞转染将经过缺氧/缺糖处理的神经细胞接种在6孔板上,将6 μg (5′-GGAUGCUGGUUAUGGAGAU-3′),6 μg non-specific siRNA和Fra-1 siRNA(5′-AUCUGUUCACAAGGCCUUCGACGUA-3′,3 μg)+ SYK siRNA(3 μg)分别与7 μL Turbofect混匀,然后分别加入到200 μL不含血清的DMEM培养基,充分混合加入6孔板不同的细胞培养孔中,37℃,含5% CO2的细胞培养箱中孵育24 h。control组:缺氧/缺糖处理24 h的神经细胞(n=3);SYK siRNA组:缺氧/缺糖处理24 h,再转染SYK siRNA的神经细胞(n=3);SYK-Fra-1 siRNA组:缺氧/缺糖处理24 h,再同时转染SYK siRNA和Fra-1 siRNA的神经细胞(n=3);non-specific siRNA组:缺氧/缺糖处理24 h,再转染non-specific siRNA的神经细胞(n=3)。
1.2.6 实时荧光定量PCR(qRT-PCR)检测Trizol法收集细胞总RNA,利用反转录试剂盒以总RNA为模板合成cDNA,方法步骤按照说明书进行。以合成的cDNA为模板,进行qRT-PCR反应。引物:SYK:上游引物:5′-TGTCAAGGATAAGAACATCATAG-3′,下游引物:5′-CACCACGTCATAGTAGTAATTG-3′;GAPDH:上游引物:5′-GGAAGATGGTGATGGGATT -3′,下游引物:5′-GGATTTGGTCGTATTGGG -3′;Fra-1:上游引物:5′-GAGTAAGGCGCGAGCGGAACAA -3′,下游引物:5′-TGGAACATAGAGGGAAAGGGGTCC-3′。GAPDH为内参基因。反应程序为:预变性94 ℃ 5 min;94 ℃ 20 s,58 ℃ 30 s,共40个循环;后延伸72 ℃ 10 min。20 μL反应体系包含10 μ L SYBR Premix Ex Taq Ⅱ,利用2-ΔΔCt方法计算基因相对表达量。
1.2.7 蛋白免疫印记(Western Blot)裂解需要检测的细胞,离心收集蛋白质,用BCA试剂盒测定蛋白质浓度后取20 μg于12%SDS-PAGE中电泳,而后利用半干转法将分离开的蛋白质电转移至PVDF膜上。5%脱脂奶粉溶液室温封闭膜2 h,一抗(SYK鼠单抗、Fra-1鼠单抗和GAPDH鼠单抗,1:800)4 ℃孵育过夜。辣根过氧化物酶标记的羊抗鼠二抗(1:1 000) 室温孵育2 h,利用凝胶成像系统观察结果。GAPDH为内参对照蛋白,实验重复3次取平均值。
1.3 统计学分析采用SPSS 16.0统计软件进行统计学分析,数值均采用x±s表示。两组均数间比较采用t检验,多组之间采用单因素方差分析。
2 结果 2.1 皮质神经元的鉴定MAP2的免疫荧光鉴定原代培养的细胞是否为大鼠皮质神经元细胞,结果显示细胞的胞体、树突有着色,说明为皮质神经元细胞,并且随机的200个细胞中,纯度达到92%。
2.2 缺氧/缺糖损伤诱导SYK表达为了探究缺氧/缺糖损伤对皮质神经元细胞SYK表达量的影响,我们通过qRT-PCR和Western Blot方法检测了SYK mRNA和蛋白表达情况。结果显示缺氧/缺糖处理的anoxia/hypoglycemia组的SYK mRNA表达量(2.40±0.33) 较对照组(0.37±0.23) 显著上调(P<0.01),缺氧/缺糖处理的anoxia/hypoglycemia组的SYK蛋白表达量(2.30±0.69) 较对照组(0.29±0.19) 显著上调(P<0.01)(图 1)。

|
| 1:正常细胞组;2:anoxia/hypoglycemia组 图 1 缺氧/缺糖损伤皮质神经元中SYK的蛋白电泳图 |
2.3 抑制细胞中SYK的表达
利用细胞转染技术抑制经缺氧/缺糖处理的神经元细胞的SYK表达量,为了检验转染效率,我们检测了SYK mRNA和蛋白表达情况。结果显示,SYK siRNA组mRNA表达量(1.27±0.34) 相对无转染处理组(2.82±0.27) 和转染non-specific siRNA的细胞组(2.95±0.79) 明显下调(P<0.05),SYK siRNA组SYK蛋白表达量(1.27±0.34) 相对无转染处理组(2.54±0.56) 和转染non-specific siRNA的细胞组(2.83±0.71) 明显下调(P<0.05)(图 2)。
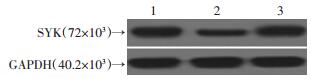
|
| 1:无转染处理;2:转染SYK siRNA的细胞;3:转染non-specific siRNA的细胞 图 2 转染后神经元中SYK的蛋白电泳图 |
2.4 抑制SYK表达降低缺氧/缺糖损伤诱导的皮质神经元细胞的凋亡
为了检测抑制SYK对缺氧/缺糖损伤诱导的皮质神经元细胞凋亡的影响,我们采用了caspase-3活性检测和Annexin-Ⅴ FITC/PI方法测定细胞凋亡情况。结果显示,SYK siRNA组中caspase-3活性(0.16±0.04) 较无转染处理组(0.42±0.02) 和转染non-specific siRNA的细胞组(0.46±0.11) 显著降低(P<0.01)。SYK siRNA组细胞凋亡率(20.00±5.57)%较无转染处理组(51.00±3.90)%和转染non-specific siRNA的细胞组(57.70±8.08)%显著降低(P<0.05)(图 3)。
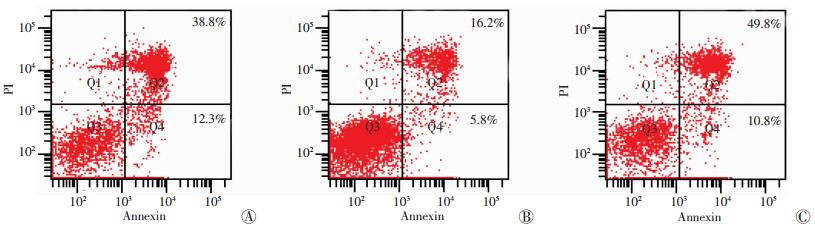
|
| 1:Control;2:SYK siRNA组;3:non-specific siRNA 图 3 细胞流式检测抑制SYK对神经元凋亡的影响 |
2.5 抑制SYK表达使Fra-1表达量上调
为了探究抑制SYK对皮质神经元缺氧/缺糖损伤起保护作用的可能机制,我们检测了SYK受到抑制后经缺氧/缺糖处理的神经元细胞中Fra-1的表达情况。结果显示,与对照组(0.93±0.11) 和non-specific siRNA组(1.18± 0.41) 相比,SYK siRNA组(2.79±0.37) 中Fra-1 mRNA表达量明显上调(P<0.01);与对照组(1.03±0.05) 和non-specific siRNA组(1.27±0.49) 相比,SYK siRNA组(2.49±0.42) Fra-1蛋白表达量也明显上调(P<0.05)(图 4)。

|
| 1:Control;2:SYK siRNA组;3:non-specific siRNA组 图 4 Western Blot检测抑制SYK对Fra-1表达量的影响 |
2.6 同时抑制SYK和Fra-1促进缺氧/缺糖对皮质神经元细胞的损伤
为了进一步探究可能的机制,我们利用细胞转染技术同时抑制SYK和Fra-1的表达量,为了检测转染效率,我们检测了SYK和Fra-1的蛋白表达量。结果显示,SYK-Fra-1-siRNA组中SYK和Fra-1的蛋白表达量较non-specific siRNA组中均显著下降(图 5)。然后,我们将两者表达量同时收到抑制的细胞进行缺氧/缺糖处理,检测caspase-3活性和Bcl-2蛋白表达量。结果显示SYK-Fra-1-siRNA组中caspase-3活性(0.530± 0.045) 相对于SYK siRNA组(0.240±0.085) 显著上升(P<0.01),与non-specific siRNA组(0.590±0.003) 接近。SYK-Fra-1-siRNA组中Bcl-2蛋白表达量(1.31±0.25) 相对于SYK siRNA组(4.47±0.43) 显著下降(P<0.01),与non-specific siRNA组(1.68±0.07) 接近(图 6)。

|
| 1:non-specific siRNA组;2:SYK siRNA组;3:SYK-Fra-1-siRNA组A:同时抑制SYK和Fra-1后两者的蛋白电泳图;B:同时抑制SYK和Fra-1后两者的蛋白变化量(n=3,x±s);SYK-Fra-1-siRNA:同时转染SYK siRNA和Fra-1 siRNA的细胞a:P<0.01,与non-specific siRNA组比较;b:P<0.05,与SYK siRNA组比较 图 5 Western Blot方法检测同时抑制SYK和Fra-1后两者蛋白表达量的变化 |
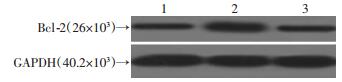
|
| 图 6 Western Blot检测同时抑制SYK和Fra-1后对Bcl-2的蛋白表达的影响 |
3 讨论
中国脑卒中新发病例达到每年200万,且70%~80%的患者预后不良,出现程度不一的残疾影响正常生活[11]。作为神经系统的重要组成部分,神经元在脑卒中中出现缺血性损伤和凋亡进而影响神经系统的正常机能[12]。据报道,SYK可以调控多种细胞的凋亡过程,其在造血细胞中广泛表达,可以调控B细胞的克隆扩增、增殖和凋亡[13]。抑制SYK表达可以降低帕纳替尼诱导的K562细胞系的凋亡,促进多发性骨髓瘤细胞的凋亡,诱导人类的前体B细胞白血病细胞凋亡等[14-15]。另外,SYK在神经组织的生长发育和病变中扮演重要的角色,在Nasu-Hakola(NHD)疾病中,磷酸化的SYK表达量在脑部显著升高,参与调控胚胎性癌神经样细胞的分化[7, 16]。然而,还没有相关SYK与皮质神经元细胞缺血损伤关系的报道。本研究中,我们构建了大脑皮质神经元细胞缺血性损伤的模型,并发现在缺血/缺糖损伤的皮质神经元细胞中SYK的表达量显著上升。抑制SYK表达,显著减少缺血/缺糖损伤引发的神经元的凋亡,且caspase-3的活性明显下降,表明抑制SYK表达量对缺血/缺糖引发的神经元损伤有保护作用。
原癌基因Fra-1(Fos related antigen-1) 是核转录因子Activator protein-1家族中Fos亚家族的成员[17]。Fra-1调控细胞分化、增殖、凋亡、血管生成,肿瘤侵袭和抗氧化反应有关的基因,从而起到调控这些生命过程的作用[18]。有研究表明,Fra-1具有抑制肺癌细胞凋亡的作用,Fra-1过表达抑制C6胶质瘤细胞的增殖且诱导其凋亡[19]。SYK具有调控PI3K活性的作用,同时PI3K可调节Fra-1的表达量[20-21],因此SYK可以调控Fra-1的表达量。在本研究中,抑制SYK显著上调Fra-1表达量。我们为了进一步研究SYK是否可以通过调控Fra-1对缺氧/缺糖损伤的皮质神经元细胞起到保护作用,同时抑制SYK及Fra-1表达量。结果表明,细胞caspas-3活性显著升高且Bcl-2蛋白表达量升高,细胞损伤加重。Caspase-3又称半胱氨酸蛋白酶,细胞凋亡的关键性蛋白酶[22]。另外Bcl-2也参与细胞凋亡,它的作用与caspase-3相反,抑制细胞凋亡过程[23-25]。因此,抑制SYK可以通过上调Fra-1表达量起到降低缺氧/缺糖损伤引起的皮质神经元细胞的凋亡。
综上所述,本研究通过构建大脑皮质神经元缺氧/缺糖损伤模型,发现缺氧/缺糖损伤可以诱导SYK的表达量,并且抑制SYK表达量可显著降低caspase-3活性和缺氧/缺糖损伤引起的神经元凋亡。另外抑制SYK可以通过上调Fra-1起到减少缺氧/缺糖引起神经元损伤的作用。
| [1] | ROLFS A, FAZEKAS F, GRITTNER U, et al. Acute cerebrovascular disease in the young: the Stroke in Young Fabry Patients study[J]. Stroke, 2013, 44(2): 340–9. DOI:10.1161/STROKEAHA.112.663708 |
| [2] | TOYODA K, NINOMIYA T. Stroke and cerebrovascular diseases in patients with chronic kidney disease[J]. Lancet Neurol, 2014, 13(8): 823–33. DOI:10.1016/S1474-4422(14)70026-2 |
| [3] | CHEN K H, HSU H H, YANG H Y, et al. Inhibition of spleen tyrosine kinase (syk) suppresses renal fibrosis through anti-inflammatory effects and down regulation of the MAPK-p38 pathway[J]. IntJBiochem Cell Biol, 2016, 74: 135–44. DOI:10.1016/j.biocel.2016.03.001 |
| [4] | ROY S, KARMAKAR M, PEARLMAN E. CD14 mediates Toll-like receptor 4 (TLR4) endocytosis and spleen tyrosine kinase (Syk) and interferon regulatory transcription factor 3 (IRF3) activation in epithelial cells and impairs neutrophil infiltration and Pseudomonas aeruginosa killing in vivo[J]. JBiol Chem, 2014, 289(2): 1174–82. DOI:10.1074/jbc.M113.523167 |
| [5] | SCHEIB J L, SULLIVAN C S, CARTER B D. Jedi-1 and MEGF10 signal engulfment of apoptotic neurons through the tyrosine kinase Syk[J]. JNeurosci, 2012, 32(38): 13022–31. DOI:10.1523/JNEUROSCI.6350-11.2012 |
| [6] | GALLAGHER D, GUTIERREZ H, GAVALDA N, et al. Nuclear factor-kappaB activation via tyrosine phosphorylation of inhibitor kappaB-alpha is crucial for ciliary neurotrophic factor-promoted neurite growth from developing neurons[J]. JNeurosci, 2007, 27(36): 9664–9. DOI:10.1523/JNEUROSCI.0608-07.2007 |
| [7] | TSUJIMURA T, YANAGI S, INATOME R, et al. Syk protein-tyrosine kinase is involved in neuron-like differentiation of embryonal carcinoma P19 cells[J]. FEBS Lett, 2001, 489(2-3): 129–33. DOI:10.1016/S0014-5793(01)02097-X |
| [8] | HOELLENRIEGEL J, COFFEYGP, SINHA U, et al. Selective, novel spleen tyrosine kinase (Syk) inhibitors suppress chronic lymphocytic leukemia B-cell activation and migration[J]. Leukemia, 2012, 26(7): 1576–1583. DOI:10.1038/leu.2012.24 |
| [9] | GOBESSI S, LAURENTI L, LONGO P G, et al. Inhibition of constitutive and BCR-induced Syk activation downregulates Mcl-1 and induces apoptosis in chronic lymphocytic leukemia B cells[J]. Leukemia, 2009, 23(4): 686–97. DOI:10.1038/leu.2008.346 |
| [10] | COOPMAN P J, DO M T, BARTH M, et al. The Syk tyrosine kinase suppresses malignant growth of human breast cancer cells[J]. Nature, 2000, 406(6797): 742–7. DOI:10.1038/35021086 |
| [11] |
张通. 中国脑卒中康复治疗指南(2011完全版)[J].
中国医学前沿杂志(电子版), 2012, 4(6): 55–6.
ZHANG T. Chinese stroke rehabilitation guidelines (2011 full version)[J]. ChinJFront Med Sci(Elect Ver), 2012, 4(6): 55–6. DOI:10.3969/j.issn.1006-9771.2012.04.001 |
| [12] | MANZANERO S, SANTRO T, ARUMUGAM T V. Neuronal oxidative stress in acute ischemic stroke: sources and contribution to cell injury[J]. Neurochem Int, 2013, 62(5): 712–8. DOI:10.1016/j.neuint.2012.11.009 |
| [13] | MUKHERJEE S, ZHU J, ZIKHERMAN J, et al. Monovalent and multivalent ligation of theBcell receptor exhibit differential dependence upon Syk and Src family kinases[J]. Sci Signal, 2013, 6(256): ra1. DOI:10.1126/scisignal.2003220 |
| [14] | KOERBER R M, HELD S A, HEINE A, et al. Analysis of the anti-proliferative and the pro-apoptotic efficacy of Syk inhibition in multiple myeloma[J]. Exp Hematol Oncol, 2015, 4: 21. DOI:10.1186/s40164-015-0016-z |
| [15] | MYERS D E, YIV S, QAZI S, et al. CD19-antigen specific nanoscale liposomal formulation ofaSYK P-site inhibitor causes apoptotic destruction of human B-precursor leukemia cells[J]. Integr Biol (Camb), 2014, 6(8): 766–80. DOI:10.1039/c4ib00095a |
| [16] | SATOH J, TABUNOKI H, ISHIDA T, et al. Phosphorylated Syk expression is enhanced in Nasu-Hakola disease brains[J]. Neuropathology, 2012, 32(2): 149–57. DOI:10.1111/j.1440-1789.2011.01256.x |
| [17] | ISKIT S, SCHLICKER A, WESSELS L, et al. Fra-1 isakey driver of colon cancer metastasis andaFra-1 classifier predicts disease-free survival[J]. Oncotarget, 2015, 6(41): 43146–61. DOI:10.18632/oncotarget.6454 |
| [18] | VAZ M, MACHIREDDY N, IRVING A, et al. Oxidant-induced cell death and Nrf2-dependent antioxidative response are controlled by Fra-1/AP-1[J]. Mol Cell Biol, 2012, 32(9): 1694–709. DOI:10.1128/MCB.06390-11 |
| [19] | SHIRSAT N V, SHAIKH S A. Overexpression of the immediate early gene fra-1 inhibits proliferation, induces apoptosis, and reduces tumourigenicity of c6 glioma cells[J]. Exp Cell Res, 2003, 291(1): 91–100. DOI:10.1016/S0014-4827(03)00346-X |
| [20] | LIN J H, LIN J Y, CHOU Y C, et al. Epstein-Barr virus LMP2A suppresses MHC class Ⅱ expression by regulating the B-cell transcription factors E47 and PU.1[J]. Blood, 2015, 125(14): 2228–38. DOI:10.1182/blood-2014-08-594689 |
| [21] | RAMOS-NINO M E, BLUMEN S R, PASS H, et al. Fra-1 governs cell migration via modulation of CD44 expression in human mesotheliomas[J]. Mol Cancer, 2007, 6: 81. DOI:10.1186/1476-4598-6-81 |
| [22] | KHALIL H, BERTRAND M J, VANDENABEELE P, et al. Caspase-3 and RasGAP:astress-sensing survival/demise switch[J]. Trends Cell Biol, 2014, 24(2): 83–9. DOI:10.1016/j.tcb.2013.08.002 |
| [23] | VOLKMANN N, MARASSI F M, NEWMEYER D D, et al. The rheostat in the membrane: BCL-2 family proteins and apoptosis[J]. Cell Death Differ, 2014, 21(2): 206–15. DOI:10.1038/cdd.2013.153 |
| [24] | LLAMBI F, WANG Y M, VICTOR B, et al. BOK isanon-canonical BCL-2 family effector of apoptosis regulated by ER-associated degradation[J]. Cell, 2016, 165(2): 421–433. DOI:10.1016/j.cell.2016.02.026 |
| [25] | ZHU Y, TCHKONIA T, FUHRMANN-STROISSNIGG H, et al. Identification ofanovel senolytic agent, navitoclax, targeting the Bcl-2 family of anti-apoptotic factors[J]. Aging Cell, 2016, 15(3): 428–435. DOI:10.1111/acel.12445 |



