丝氨酸羟甲基转移酶2(serine hydroxymethyl transferase 2,SHMT2) 能将丝氨酸转化为甘氨酸,是增殖细胞的线粒体中甘氨酸的重要来源[1]。SHMT2被证明了能够增强快速增殖肿瘤细胞对缺血、缺氧环境的耐受[2]。在人的结肠癌和小鼠的肉瘤中均发现了SHMT2的高表达[3]。肝脏的再生与肿瘤发展中均有细胞的快速增殖过程,小鼠的2/3肝切除 (partial hepatectomy,PH) 是研究肝再生的经典模型,在切除小鼠肝脏的左右橫膈叶和左侧叶3叶后,肝内的胆管上皮细胞、肝细胞、肝血窦内皮细胞多种细胞迅速增殖,恢复正常的体积和功能[4],在肝脏再生的过程中可能存在SHMT2的高表达。本研究检测了SHMT2在肝脏再生过程中的表达规律,以及干扰SHMT2表达后对肝再生度及肝功能的影响,旨在揭示肝脏再生相关分子机制。
1 材料与方法 1.1 动物实验SPF级雄性C57BL/6小鼠120只,5~6周龄,体质量18~21 g,由重庆医科大学动物中心提供。本动物实验经重庆医科大学伦理委员会批准进行 (批准日期2016年5月10日,批准编号:10065473)。
1.2 试剂及仪器增殖细胞核抗原 (proliferating cell nuclear antigen,PCNA,ab29) 抗体、SHMT2(Cat:ab180786)、甘氨酸脱羧酶 (glycine dehydrogenase,GLDC,Cat:ab97625)、GAPDH (Cat:ab8245) 抗体均购自Abcam公司。SHMT2基因引物:上游:5′-TGGCAAGAGATACTACGGAGG-3′,下游:5′-GCAGGTCCAACCCCATGAT-3′。β-actin基因上游引物:5′-CCTGGCACCCAGCACAAT-3′,下游引物:5′-GCCGATCCACACGGAGTACT-3′。使用TRIzol提取小鼠肝组织总RNA,并将mRNA逆转为cDNA,qPCR试剂盒购自德国DBI公司。Western blot仪器购自美国Bio-Rad公司,PCR仪器购自美国Thermo公司,逆转录试剂盒和SYBR Green PCR Master MIX PCR试剂盒购自宝生物工程 (大连) 有限公司,含有针对SHMT2 siRNA的纯化滴度为1×1012PFU腺病毒购自加拿大ABM公司。
1.3 实验方法和步骤 1.3.1 动物模型120只小鼠按接受2/3肝脏部分切除术手术后的时间分为肝切除 (PH) 组,假手术组,腺病毒干扰组 (siSHMT2) 及注射生理盐水对照组 (Control),每组30只。肝切除组下设1、3、5、7、9 d 5个时相点,每个时相点6只。小鼠术前禁食8 h,不禁饮。乙醚麻醉。采用仰卧位固定小鼠四肢,皮肤剃毛消毒,剑突下腹部正中切开,切口约0.5 cm。依次切口各层进入腹腔,用棉签挤出肝脏,充分暴露肝脏,用4-0线结扎肝左右橫膈叶根部及左侧叶,并切除肝叶,约为肝质量的2/3。siSHMT2组:肝部分切除当天尾静脉注射100 μL稀释100倍的1×1012PFU腺病毒,切除后第5天取再生肝组织。最后各组处死小鼠,眼球取血600 μL检测相关指标。
1.3.2 指标检测 1.3.2.1 丙氨酸转氨酶 (alanine transaminase,ALT) 和谷草转氨酶 (aspartate transaminase,AST)各组取血800 μL,半径20 cm,5 000 r/min离心10 min,分离上层血清,交于重庆医科大学附二院检验科检测ALT和AST。
1.3.2.2 肝脏再生度[5]小鼠肝脏切除后称量 (B),计算初始肝质量 (A=B/0.7)。处死小鼠后,初始肝质量切下全部肝组织并称质量 (C)。肝脏再生度= [(C-0.3×A)/A]×100%,肝指数=肝脏质量/体质量。
1.3.3 qPCR检测采用TRIzol分别提取PH 1、3、5、7、9 d组总RNA,反转录制备cDNA,按照说明书步骤操作。取样本cDNA,加入SYBR Green Ⅰ进行定量qPCR反应。反应条件:预变性95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s循环40次。95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。
1.3.4 Western blot检测收集5组小鼠再生肝组织,超声破碎,加入RIPA裂解液提取蛋白。加入样本进行SDS-PAGE电泳,转膜,封闭,再加入一抗过夜。洗膜后加入二抗孵育。TBS清洗后,加入显影液拍照。
1.3.5 免疫组化检测免疫组织化学检测SHMT2、GLDC、PCNA。石蜡切片常规脱水。3%双氧水孵育15 min,加入血清封闭孵育20 min,与一抗封闭过夜,PBS洗3次,加入辣根过氧化物酶孵育15 min,DAB显色。随机观察5个镜下视野 (×400)。
1.4 统计学方法采用SPSS 13.0统计软件进行检验,若组间方差齐, 则组间两两比较采用LSD-t检验, 并行药物处理和时间交互作用检验;若组间方差不齐,则采用非参数检验。检验水准:α=0.05。
2 结果 2.1 Western blot和qPCR检测再生肝脏SHMT2的表达分别用Western blot测定第1、3、5、7、9天残余肝脏中SHMT2的表达 (图 1)。发现SHMT2在肝切除后明显升高,并在5 d达到峰值。其中SHMT2水平在手术后第1天也明显升高,很可能是小鼠接受肝大部切除术后的应激反应。在肝切除后的1、3、5、7、9 d用qPCR检测SHMT2的表达,发现同样的变化,第5天SHMT2的mRNA表达量是第1天的1.63倍 (P < 0.05,图 1)。
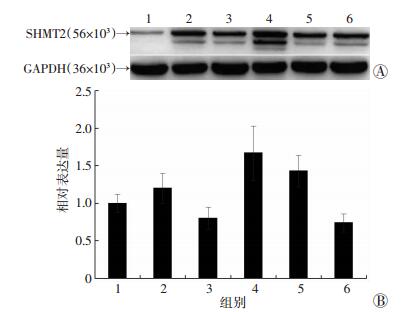
|
| 1:假手术组;2:PH 1 d组;3:PH 3 d组;4:PH 5 d组;5:PH 7 d组;6:PH 9 d组 图 1 SHMT2在各组小鼠再生肝组织中的表达 |
2.2 Western blot和免疫组化检测再生肝脏SHMT2和GLDC的表达
为了进一步验证,采用Western blot检测了SHMT2下游分子GLDC的表达变化,表面GLDC的变化与SHMT2表达一致,都是在5、7 d到达峰值 (图 2)。我们再取假手术组和肝切除5 d后的肝组织进行SHMT2和GLDC的免疫组化染色,进一步验证之前的实验结果,发现肝切除5 d后的再生组织均明显高于假手术组 (图 3)。

|
| 1:假手术组;2:PH 1 d组;3:PH 3 d组; 4:PH 5 d组; 5:PH 7 d组;6:PH 9 d组 图 2 Western blot检测SHMT2下游的GLDC的表达规律 |
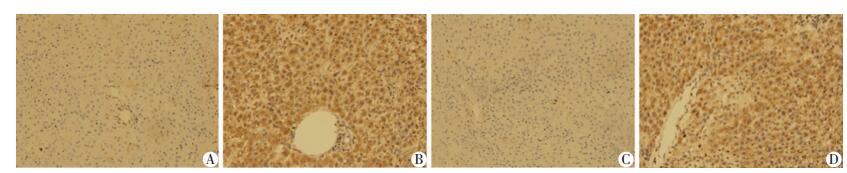
|
| A、C:假手术组;B、D:PH 5 d组;A、B:SHMT2;C、D:GLDC 图 3 免疫组化检测假手术组和PH 5 d组的SHMT2和GLDC的表达 (SABC ×400) |
2.3 注射腺病毒干扰SHMT2表达后SHMT2及其GFP的表达
小鼠尾静脉注射腺病毒后第5天,取肝组织,通过Western blot验证病毒干扰的效果。发现通过腺病毒干扰后SHMT2在肝组织内表达明显降低 (图 4)。腺病毒携带的绿色荧光在siSHMT2组中表达明显 (图 5)。这说明腺病毒干扰成功,效果明显。

|
| 1:Control组; 2:siSHMT2组 图 4 Western blot检测siSHMT2组与Control组SHMT2蛋白的表达 |
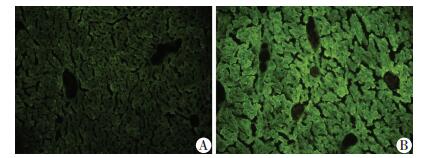
|
| A:Control组;B:siSHMT2组 图 5 荧光显微镜观察siSHMT2组与Control组GFP的表达 (×400) |
2.4 注射腺病毒干扰SHMT2表达后相关肝功能指标的检测及肝脏质量的测量
在注射腺病毒和生理盐水后,我们对小鼠进行了2/3的肝切除。在SHMT2表达最高的第5天,我们取600 μL小鼠血液进行了相关肝功能的检测。与注射生理盐水第5天的小鼠进行了对比,发现干扰SHMT2后,再生肝脏的功能比之前有明显下降,即ALT、AST明显升高 (P < 0.05,表 1)。
| 组别 | ALT | AST |
| PH 5 d组 | 64.23±7.43 | 136.42±23.80 |
| Control组 | 70.00±9.52 | 140.09±32.85 |
| siSHMT2组 | 154.15±16.49ab | 403.41±68.63ab |
| a:P < 0.05,与Control组比较;b:P < 0.05,与PH 5 d组比较 | ||
我们称量肝脏质量发现,siSHMT2组的肝脏质量、肝再生度、肝指数与PH 5 d组及其Control组比较,明显下降 (P < 0.05,表 2)。
| 组别 | 肝脏质量 (g) | 肝再生度 (%) | 肝指数 (%) |
| PH 5 d组 | 0.81±0.17 | 37.65±2.68 | 3.65±0.37 |
| Control组 | 0.79±0.13 | 36.37±2.21 | 3.76±0.44 |
| siSHMT2组 | 0.63±0.11ab | 31.33±1.92ab | 3.13±0.29ab |
| a:P < 0.05,与Control组比较;b:P < 0.05,与PH 5 d组比较 | |||
2.5 注射腺病毒干扰SHMT2表达后再生肝脏PCNA的表达
免疫组化检测PH后第5天的siSHMT2组与Control组肝PCNA的表达 (图 6)。结果表明在腺病毒干扰SHMT2后[(39.0±3.2)%],与Control组[(53.6± 2.3)%]、PH5 d组[(55.2±4.6)%]比较,肝脏PCNA表达阳性率明显降低 (P < 0.05)。
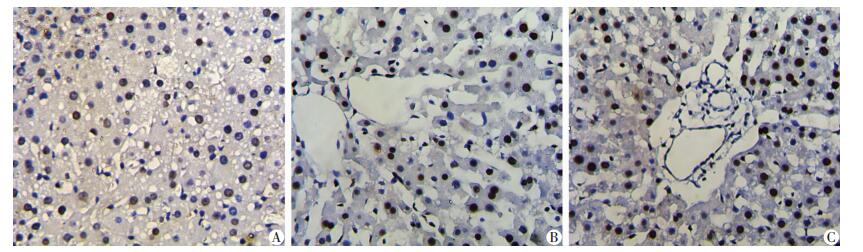
|
| A:siSHMT2组;B:Control组;C:PH 5 d组 图 6 免疫组化测各组小鼠肝脏PNCA的表达情况 (SABC ×400) |
3 讨论
肝脏的再生能力十分强大,即使肝脏质量的75%被切除也能恢复肝脏正常的功能,其强大的再生能力让部分肝切除成为了治疗多种肝脏疾病有效的治疗手段[6]。年龄、饮食、miRNA的调节都会影响肝脏的再生能力[7-9]。SHMT2被证明在快速增殖的肿瘤细胞内会高表达,Kim等[2]证明SHMT2在脑胶质瘤中高表达;Yin等[10]、Zhang等[11]的研究也发现SHMT2在乳腺癌中也表达增高,SHMT2能增强快速增殖的细胞对缺血、缺氧的耐受。而肝脏的再生过程也存在着肝内各种细胞的快速增殖。
本研究表明,肝脏切除后迅速增长的肝脏组织中SHMT2明显高于假手术组,并且在干扰SHMT2表达的小鼠肝再生模型中发现血清ALT和AST明显高于Control组,2/3的肝切除5 d后的肝脏质量也低于Control组,表明SHMT2被干扰后,再生的肝脏的功能受到了损害。这说明SHMT2对肝脏再生确实有促进作用。
SHMT2会从丝氨酸中转移1个甲基到四氢叶酸,产生甘氨酸和甲基四氢叶酸。甘氨酸和一碳单位有助于核酸合成和细胞增殖所必需的嘌呤和胸苷的合成[12-13]。在肝脏再生的过程中,低氧程度会随着再生速率的加快而超过形成的脉管系统给再生细胞提供氧气和营养的能力[14]。本研究证实了在肝脏再生过程中SHMT2会上调,并对肝脏再生有促进作用。低氧环境诱导的SHMT2有利于线粒体中的丝氨酸代谢。SHMT2可能是肝脏再生中连接丝氨酸代谢和线粒体氧化还原反应的关键酶。肝脏再生过程可能受很多因子的调节,并且会消耗大量的能量。有研究发现肝脏切除后能通过组织释放三磷酸腺苷调节肝脏再生[15]。线粒体受损后使三磷酸腺苷产生不足,而造成肝脏功能的衰竭[16]。本研究指出SHMT2在肝脏再生的缺血、缺氧最严重的后期会高表达,并且在SHMT2被干扰后,肝脏功能在再生的后期会受到损害。这说明SHMT2在肝脏再生后期的高表达对肝脏再生有促进作用,维持能量代谢。
综上所述,本研究证明SHMT2会在肝脏再生的后期高表达,促进残肝的再生。其机制可能与增强肝脏对缺血、缺氧的耐受,提高三磷酸腺苷水平有关。因此,SHMT2可能会成为临床上肝脏大部切除后,提升患者预后的重要靶点。
| [1] | Jain M, Nilsson R, Sharma S, et al. Metabolite profiling identifies a key role for glycine in rapid cancer cell proliferation[J]. Science, 2012, 336(6084): 1040–1044. DOI:10.1126/science.1218595 |
| [2] | Kim D, Fiske B P, Birsoy K, et al. SHMT2 drives glioma cell survival in ischaemia but imposes a dependence on glycine clearance[J]. Nature, 2015, 520(7547): 363–367. DOI:10.1038/nature14363 |
| [3] | Snell K, Natsumeda Y, Eble J N, et al. Enzymic imbalance in serine metabolism in human colon carcinoma and rat sarcoma[J]. Br J Cancer, 1988, 57(1): 87–90. DOI:10.1038/bjc.1988.15 |
| [4] | Kedarisetty C K, Anand L, Khanam A, et al. Growth factors enhance liver regeneration in acute-on-chronic liver failure[J]. Hepatol Int, 2014, 8(S2): 514–525. DOI:10.1007/s12072-014-9538-4 |
| [5] | Shergill U, Das A, Langer D, et al. Inhibition of VEGF-and NO-dependent angiogenesis does not impair liver regeneration[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298(5): R1279–R1287. DOI:10.1152/ajpregu.00836.2009 |
| [6] | Cook D, Ogunnaike B A, Vadigepalli R. Systems analysis of non-parenchymal cell modulation of liver repair across multiple regeneration modes[J]. BMC Syst Biol, 2015, 9: 71. DOI:10.1186/s12918-015-0220-9 |
| [7] | Bucher N L, Glinos A D. The effect of age on regeneration of rat liver[J]. Cancer Res, 1950, 10(5): 324–332. |
| [8] | DeAngelis R A, Markiewski M M, Taub R, et al. A high-fat diet impairs liver regeneration in C57BL/6 mice through overexpression of the NF-kappaB inhibitor, IkappaBalpha[J]. Hepatology, 2005, 42(5): 1148–1157. DOI:10.1002/hep.20879 |
| [9] | Salehi S, Brereton H C, Arno M J, et al. Human liver regeneration is characterized by the coordinated expression of distinct microRNA governing cell cycle fate[J]. Am J Transplant, 2013, 13(5): 1282–1295. DOI:10.1111/ajt.12183 |
| [10] | Yin K. Positive correlation between expression level of mitochondrial serine hydroxymethyltransferase and breast cancer grade[J]. Onco Targets Ther, 2015, 8: 1069–1074. DOI:10.2147/OTT.S82433 |
| [11] | Zhang L, Chen Z, Xue D, et al. Prognostic and therapeutic value of mitochondrial serine hydroxyl-methyltransferase 2 as a breast cancer biomarker[J]. Oncol Rep, 2016, 36(5): 2489–2500. DOI:10.3892/or.2016.5112 |
| [12] | Zhang W C, Shyh-Chang N, Yang H, et al. Glycine decarboxylase activity drives non-small cell lung cancer tumor-initiating cells and tumorigenesis[J]. Cell, 2012, 148(1/2): 259–272. DOI:10.1016/j.cell.2011.11.050 |
| [13] | Labuschagne C F, van den Broek N J, Mackay G M, et al. Serine, but not glycine, supports one-carbon metabolism and proliferation of cancer cells[J]. Cell Rep, 2014, 7(4): 1248–1258. DOI:10.1016/j.celrep.2014.04.045 |
| [14] | Ye J, Fan J, Venneti S, et al. Serine catabolism regulates mitochondrial redox control during hypoxia[J]. Cancer Discov, 2014, 4(12): 1406–1417. DOI:10.1158/2159-8290.CD-14-0250 |
| [15] | Gonzales E, Julien B, Serri re-Lanneau V, et al. ATP release after partial hepatectomy regulates liver regeneration in the rat[J]. J Hepatol, 2010, 52(1): 54–62. DOI:10.1016/j.jhep.2009.10.005 |
| [16] | Honda H M, Korge P, Weiss J N. Mitochondria and ischemia/reperfusion injury[J]. Ann N Y Acad Sci, 2005, 1047: 248–258. DOI:10.1196/annals.1341.022 |



