肝细胞癌 (hepatocellular carcinoma,HCC) 是全世界最常见肿瘤之一,HCC的形成可由一小群肿瘤来源的具有异质性的肿瘤干细胞 (cancer stem cells, CSCs) 或肿瘤起始细胞催化[1]。化疗在肝癌综合治疗中有重要地位,但肝癌细胞对化疗药物多药耐药 (multidrug resistance, MDR) 成为肝癌患者化疗失败的主要原因。
肝癌耐药与多种因素密切相关,肝癌对铂类耐药主要与药物在细胞内累积降低、药物灭活作用增强以及DNA损伤修复增加有关[2]。而其中药物在细胞内累积降低主要与耐药细胞中两种膜转运蛋白ABC转运蛋白超家族及溶质运载蛋白家族对药物输出及吸收控制作用有关[3]。此外,肿瘤细胞中一小群CSCs也是肿瘤化疗耐药的关键。CSCs具有自我更新、无限增殖及催化肿瘤形成的能力[4],文献[5-6]报道几种类型的CSCs中ABC转运蛋白家族表达上调进而抵抗不同化疗药物治疗。此外,肿瘤细胞中端粒酶逆转录酶 (human telomerase reverse enzyme,hTERT) 表达水平与多种肿瘤细胞化疗耐药密切相关[7]。
端粒酶是一种核糖核蛋白酶复合物,主要由RNA模板 (hTR或hTERC) 和hTERT组成[8]。端粒酶活性对肿瘤细胞必不可少,它可以维持端粒长度,提供细胞无限增殖和永生化潜能[9],也参与肿瘤侵袭转移过程[10]。研究发现,端粒酶具有非端粒依赖功能,如参与细胞生长和增殖相关基因表达、DNA损伤应激反应以及细胞凋亡途径的调控等[11]。除了细胞核端粒酶的非端粒相关功能,越来越多的研究表明hTERT可定位于线粒体发挥功能。hTERT的N-端包含一个由20个氨基酸 (MPRAPRCRAVR SLLRSHYRE) 组成的线粒体靶向序列 (MTS) 可引导hTERT穿过线粒体外膜和内膜, 从而定位在线粒体基质,且纯化的线粒体提取物中可检测到端粒酶的活性[12]。进一步研究发现,线粒体hTERT可与线粒体DNA (mtDNA) 的不同区域结合,包括编码ND1、2、4、5, COXⅠ和Ⅲ,tRNA和ATP合酶的6和8亚基的基因,可增强线粒体呼吸链功能,降低活性氧 (ROS) 产生,升高线粒体膜电位[13-15]。氧化应激和药物诱导可促使hTERT从细胞核向线粒体转位,从而减少DNA (mtDNA和核DNA) 损伤,降低线粒体ROS生成,阻止细胞凋亡[14, 16]。本课题组前期研究发现肝癌细胞SK-Hep1在静息状态下,hTERT在线粒体中低表达,经顺铂 (CDDP) 诱导后细胞线粒体hTERT表达增加,线粒体膜电位升高,细胞凋亡减少,细胞耐药能力显著增强[17-18]。近年研究表明虽然化疗药物可杀死大多数肿瘤细胞,但幸存的CSCs细胞被认为是肝癌对化疗不敏感及复发转移的重要原因。目前关于线粒体hTERT与肿瘤干细胞的关系少有报道,本研究拟观察线粒体hTERT与肝癌干细胞干性相关特征之间的关系,探讨线粒体hTERT与肝癌化疗耐药的关系,以深入研究肝癌细胞获得干性样表型的分子机制,为肝癌治疗提供新的策略。
1 材料与方法 1.1 主要试剂人肝癌细胞株HepG2、Huh7由本实验室保存。高糖DMEM培养基 (美国HyClone公司),胎牛血清 (美国Gibco公司),PE-抗人CD326(EpCAM) 抗体 (BioLegend公司),PE-抗人CD133抗体 (Militenyi Biotec公司),一抗兔hTERT抗体、抗兔OCT-4抗体购于Abcam公司,山羊抗兔、山羊抗鼠二抗购于碧云天公司,线粒体蛋白提取试剂盒购自QIAGEN公司,核蛋白提取试剂盒购自碧云天公司,活细胞线粒体膜电位探针 (TMRE) 购自Invitrogene公司,CCK-8试剂盒购自碧云天公司。
1.2 方法 1.2.1 细胞培养人肝癌HepG2细胞、Huh7细胞以及肝癌耐药细胞HepG2/CDDP、Huh7/CDDP细胞采用DMEM高糖 (含10%胎牛血清) 于37 ℃、5% CO2培养箱中培养。
1.2.2 耐药细胞诱导采用大剂量顺铂 (CDDP) 冲击,间歇诱导的方法构建耐药细胞株:将对数生长期的细胞接种于96孔板,每孔约2 000个细胞,待细胞贴壁, 加入含不同浓度化疗药顺铂 (CDDP) 的培养液, 每个浓度梯度设6个复孔, 空白对照组加入等体积的PBS (6个复孔), 阴性对照组不加药 (6个复孔);置37 ℃,5% CO2培养箱继续培养。24 h后,每孔加入含10% CCK-8溶液的无血清培养基,置培养箱继续培养2 h,酶联免疫检测仪测定各孔的光密度值D(450),实验独立重复3次,计算细胞相对抑制率:相对抑制率 (%)=(1-加药孔D(450)/对照孔D(450)×100%,计算细胞IC50(50%细胞生长抑制时的药物浓度)。以细胞IC50分别处理对数生长期的HepG2、Huh7细胞,24 h后换液,洗去死亡细胞,加入不含药物的新鲜培养基继续培养。待细胞恢复对数生长后再加入顺铂 (CDDP) 诱导培养,共诱导6次,3个月后获得耐药细胞株,CCK-8法计算耐药细胞株IC50。
1.2.3 提取细胞线粒体蛋白使用QIGENE线粒体提取试剂盒,收集1×107细胞,加入2 mL预冷Lysis Buffer, 1mL注射器抽吸数次后4 ℃摇床反应10 min,裂解液4 ℃,1 000×g,10 min,去上清,加入1.5 mL预冷的Disruption Buffer重悬沉淀,1 mL注射器抽吸数次,裂解液4 ℃,1 000×g,10 min,取上清,4 ℃,6 000×g,10 min,去上清,加入Mitochondria Purification Buffer重悬沉淀,高速离心进一步提取纯化的线粒体。BCA法测线粒体蛋白浓度。
1.2.4 提取细胞核蛋白收集>1×107个细胞每20 μL细胞沉淀加入200 μL试剂A,最高速剧烈Vortex5s,使沉淀完全分散,加入试剂B,冰浴1 min,4℃ 1 2 000×g离心5 min,完全吸净上清后加入核蛋白提取试剂,最高速剧烈Vortex 15 s后冰浴1~2 min,反复进行30 min, 4 ℃ 12 000×g离心10 min, 吸取上清即为所提取的核蛋白。
1.2.5 Western blot检测SDS裂解液提取细胞蛋白,100 ℃ 5 min使蛋白变性,RCDC法测蛋白浓度,蛋白上样量为30μg,以10% SDS-PAGE凝胶电泳分离。湿转法转移蛋白至NC膜,5%脱脂奶粉封闭2 h,加入一抗4 ℃过夜 (hTERT 1:1 000、HSP60 1:1 000、OCT-4 1:1 000、GAPDH 1:10 000),二抗室温孵育2 h (山羊抗鼠1:5 000,山羊抗兔1:10 000),ECL化学发光法显示结果。
1.2.6 细胞线粒体膜电位检测使用TMRE活细胞探针染色检测线粒体膜电位。分别将HepG2、Huh7及HepG2/CDDP、Huh7/CDDP细胞消化后接种于激光共聚焦培养皿中,细胞培养箱培养,待细胞长至60%~70%,加入线粒体膜电位探针TMRE 37℃避光孵育30 min,激光共聚焦显微镜扫描采集图像,ImageJ软件计算线粒体MMP水平为胞质信号与细胞质总面积的比例。
1.2.7 肿瘤干细胞干性相关蛋白CD133、EpCAM表达检测取对数生长期的HepG2、HepG2/CDDP细胞,消化、离心,制备2.5×106/mL细胞悬液,分别加入PE-抗人CD133抗体、PE-抗人CD326(EpCAM) 抗体,室温孵育15 min,离心,PBS洗2遍,流式细胞仪检测CD133阳性和EpCAM阳性细胞的比例。
1.2.8 细胞克隆形成实验分别取HepG2、HepG2/CDDP细胞,消化、离心、重悬,以500个/孔接种于6孔板中,每组3孔,细胞培养箱中培养14 d,待培养板底部有肉眼可见的克隆形成即可终止培养,PBS清洗2遍,每孔加入4%多聚甲醛1 mL室温固定20 min,PBS清洗2遍,0.1%结晶紫染色20 min,PBS清洗3遍,干燥后拍照计数。
1.3 统计学分析应用SPSS 13.0统计软件分析,计量资料以x±s表示,两组间比较采用t检验。检验水准:α=0.01。
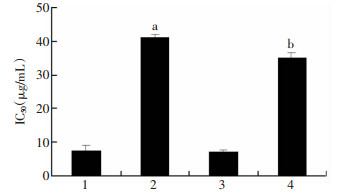
2 结果 2.1 顺铂 (CDDP) 诱导后的肝癌细胞耐药能力变化采用顺铂 (CDDP) 大剂量间歇诱导法建立人肝癌耐药细胞系HepG2/CDDP、Huh7/CDDP,CCK-8法检测亲本细胞株和耐药细胞株对不同浓度化疗药物顺铂 (CDDP) 的药物敏感性,计算IC50。如图 1所示,HepG2细胞IC50为7.687 μg/mL,HepG2/CDDP细胞IC50为41.16 μg/mL,Huh7细胞IC50为7.181 μg/mL,Huh7/CDDP细胞IC50为33.48 μg/mL,说明与亲本细胞相比诱导细胞株药物抵抗能力明显增强,且差异有统计学意义 (P < 0.01)。
|
| 1:HepG2;2:HepG2/CDDP;3:Huh7;4:Huh7/CDDP a:P < 0.01,与亲本细胞 (HepG2) 比较;b:P < 0.01,与 (亲本细胞、Huh7) 比较 图 1 比较两种细胞株亲本细胞与耐药细胞对顺铂 (CDDP) 的耐药指数 |
2.2 肝癌耐药细胞株中线粒体hTERT的表达
我们提取细胞核及细胞线粒体蛋白,Western blot检测hTERT表达水平。如图 2所示,与亲本细胞株相比,耐药细胞株线粒体hTERT表达显著升高。

|
| 1: HepG2; 2: HepG2/CODP; 3: Huh7; 4: Huh7/CODPA:线粒体hTERT表达;B:细胞核hTERT表达 图 2 Western blot检测细胞中hTERT表达 |
2.3 顺铂耐药的肝癌细胞线粒体膜电位 (Δψm) 变化
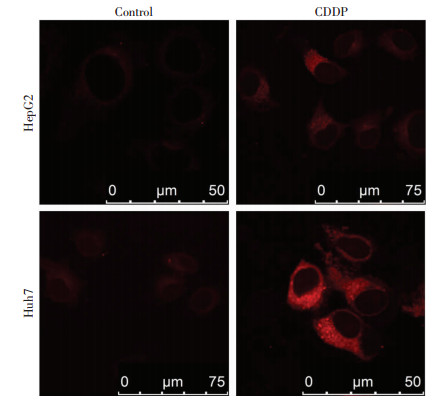
四甲基罗丹明乙酯可选择性定位于线粒体,可用于活细胞线粒体膜电位测定。如图 3所示,TMRE处理细胞后,激光共聚焦显微镜下观察细胞线粒体膜电位发现,与亲本细胞株相比,耐药细胞荧光强度明显增强,线粒体膜电位 (Δψm) 明显升高,进一步提示对顺铂耐药的肝癌细胞具有CSCs特征。
|
| 图 3 激光共聚焦显微镜观察细胞线粒体膜电位 (Δψm) 情况 |
2.4 肝癌耐药细胞株中干细胞干性相关蛋白CD133、EpCAM的表达
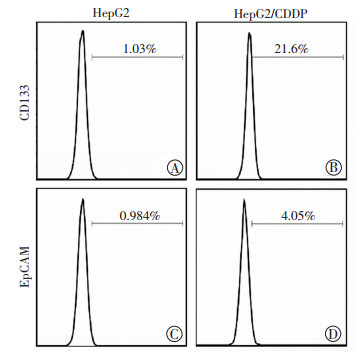
实验结果表明,肝癌耐药细胞HepG2/CDDP中CD133+细胞比例为21.6%,与亲本细胞 (1.03%) 相比CD133+细胞比例明显增多,差异有统计学意义 (P < 0.01),EpCAM阳性细胞的比例为4.05%,与亲本细胞 (0.984%) 相比比例升高,差异有统计学意义 (P < 0.01)。如图 4所示,表明肝癌耐药细胞干性相关特征表达增强。
|
| A:HepG2亲本细胞CD133+表达比例;B:耐药细胞CD133+表达比例;C:HepG2亲本细胞EpCAM表达比例;D:耐药细胞EpCAM表达比例 图 4 流式细胞术检测细胞中CD133、EpCAM表达比例 |
2.5 CDDP耐药的肝癌细胞克隆形成的能力
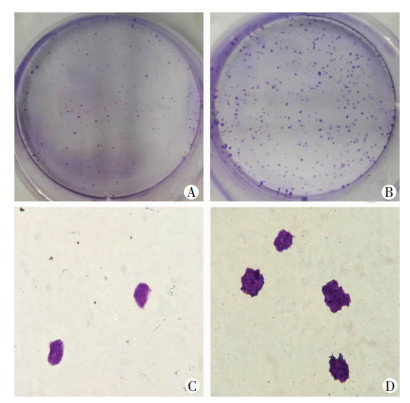
平板克隆形成实验检测细胞克隆形成能力,如图 5所示,与亲本细胞相比,对CDDP耐药的肝癌细胞克隆形成能力明显增强。
|
| A-B:HepG2亲本细胞与耐药细胞大体观 (结晶紫);C-D:HepG2亲本细胞与耐药细胞的形态学观察 (×40) 图 5 克隆形成实验检测细胞克隆形成能力 |
2.6 经CDDP诱导后的肝癌细胞干性相关因子OCT-4蛋白的表达水平
分别提取亲本细胞和耐药细胞的蛋白,Western blot检测细胞中OCT-4蛋白表达水平变化,如图 6所示,与亲本细胞相比,耐药细胞中OCT-4表达明显升高。

|
| 1:HepG2; 2: HepG2/COPD; 3: Huh7; 4: Huh7/COPD 图 6 Western blot检测细胞中OCT-4蛋白表达水平变化 |
3 讨论
化疗耐药是肿瘤治疗的难题,本实验我们模拟了肝癌化疗耐药模型,构建肝癌耐药细胞株,观察耐药细胞与亲本细胞相比,肝癌耐药细胞株中线粒体hTERT表达显著升高,与线粒体功能密切相关的线粒体膜电位 (Δψm) 增强,肿瘤干细胞干性相关标志增强,干性相关蛋白CD133、EpCAM表达比例增加,细胞克隆形成能力增强,干性相关因子OCT-4蛋白表达水平增加。表明经顺铂诱导的肝癌耐药细胞可以促进线粒体功能,使细胞获得肿瘤干细胞样特征,从而导致肝癌化疗耐药。本研究在课题组前期研究基础上,进一步深入探讨肝癌细胞化疗耐药的根本原因,发现耐药细胞hTERT线粒体转位增加,促进线粒体功能,进而获得干性样表型。
本课题组前期研究表明,线粒体hTERT转位增加后,导致线粒体活性氧 (ROS) 生成减少,mtDNA损伤降低,COXⅡ表达增加,保护线粒体呼吸链功能,从而导致化疗抵抗[19]。文献[20-22]报道,氧化应激条件下线粒体hTERT可降低ROS产生,抑制mtDNA损伤和细胞凋亡。Santos等[23]研究发现抑制hTERT出核可阻止细胞永生化,增加细胞对毒性药物的敏感性。hTERT以线粒体膜电位依赖的方式进入线粒体,定位于线粒体基质,可以增强线粒体功能,减轻氧化损伤,维持细胞永生化[24]。线粒体hTERT也可与ND1、ND2结合,保护线粒体呼吸链复合物Ⅰ功能,降低ROS产生,减少氧化应激诱导的损伤[13-14, 24]。上述研究表明,线粒体hTERT转位后所引起的ROS变化是耐药的关键。
众所周知,细胞内ROS主要来源于线粒体,线粒体呼吸链是产生自由基和ROS的主要场所[25]。虽然过量的ROS对细胞是有害的,但适度水平的ROS作为细胞内重要的信号分子,参与多个信号通路的激活,如调节细胞质应激酶、缺氧信号等。线粒体通过释放ROS反馈作用于细胞核、调节下游分子的表达。当ROS水平增加,CSCs自我更新受到抑制、细胞分化开始[26]。然而,线粒体hTERT是如何引起细胞内ROS水平的变化呢?我们知道,在电子传递的过程中,在呼吸链的底物端和氧端有电子漏出现象,呼吸链漏出的电子与分子氧进行单电子还原反应生成超氧阴离子,超氧阴离子是体内活性氧的主要来源,线粒体内生成的超氧阴离子很快转变为过氧化氢,过氧化氢通过Fenton反应转变为高活性的羟自由基,超氧阴离子、过氧化氢、羟自由基统称为活性氧。活性氧主要由线粒体进行呼吸作用时,由少量电子从线粒体电子传递链复合体Ⅰ和Ⅲ中漏出并与O结合而产生。现在普遍认为,肿瘤组织中由于电子传递链复合物Ⅰ以及Ⅲ的活性受损,导致电子传递链中泄漏的电子增加,从而导致肿瘤组织中的ROS水平要高于正常组织,而这种变化也是肿瘤细胞代谢的另一特征[27]。据此我们有理由推测线粒体hTETR可能与上述线粒体呼吸链复合物相互作用进而影响线粒体功能、干性的发生,最终导致细胞耐药。本研究不足之处在于没有排除核hTERT对细胞干性及耐药可能产生的影响,我们拟进一步构建线粒体定位序列MTS缺失或突变的hTERT过表达系统,从而进一步佐证线粒体hTERT在维持肝癌细胞干性及耐药中的重要作用。
综上所述,经药物诱导的耐药细胞可能通过增强hTERT线粒体转位,在线粒体发挥非端粒依赖作用,改变线粒体功能,从而诱导细胞从肿瘤细胞向CSCs转化,获得肿瘤干细胞相关特征,进一步导致肿瘤复发、转移及化疗抵抗。然而线粒体hTERT如何引起ROS及线粒体功能改变有待后续进一步研究。本研究为靶向hTERT线粒体转位逆转肝癌细胞的耐药研究提供了新策略。
| [1] | Miyajima A, Tanaka M, Itoh T. Stem/progenitor cells in liver development, homeostasis, regeneration, and reprogram-ming[J]. Cell Stem Cell, 2014, 14(5): 561–574. DOI:10.1016/j.stem.2014.04.010 |
| [2] | Siddik Z H. Cisplatin: mode of cytotoxic action and molecular basis of resistance[J]. Oncogene, 2003, 22(47): 7265–7279. DOI:10.1038/sj.onc.1206933 |
| [3] | Liu F S. Mechanisms of chemotherapeutic drug resistance in cancer therapy--a quick review[J]. Taiwan J Obstet Gynecol, 2009, 48(3): 239–244. DOI:10.1016/S1028-4559(09)60296-5 |
| [4] | Kuo K K, Lee K T, Chen K K, et al. Positive Feedback Loop of OCT4 and c-JUN Expedites Cancer Stemness in Liver Cancer[J]. Stem Cells, 2016, 34(11): 2613–2624. DOI:10.1002/stem.2447 |
| [5] | Bram E E, Stark M, Raz S, et al. Chemotherapeutic drug-induced ABCG2 promoter demethylation as a novel mechanism of acquired multidrug resistance[J]. Neoplasia, 2009, 11(12): 1359–1370. DOI:10.1593/neo.91314 |
| [6] | McIntosh K, Balch C, Tiwari A K. Tackling multidrug resistance mediated by efflux transporters in tumor-initiating cells[J]. Expert Opin Drug Metab Toxicol, 2016, 12(6): 633–644. DOI:10.1080/17425255.2016.1179280 |
| [7] | Deville L, Hillion J, Pendino F, et al. hTERT promotes imatinib resistance in chronic myeloid leukemia cells: therapeutic implications[J]. Mol Cancer Ther, 2011, 10(5): 711–719. DOI:10.1158/1535-7163.MCT-10-0979 |
| [8] | Liu N, Ding D, Hao W, et al. hTERT promotes tumor angiogenesis by activating VEGF via interactions with the Sp1 transcription factor[J]. Nucleic Acids Res, 2016, 44(18): 8693–8703. DOI:10.1093/nar/gkw549 |
| [9] | Jafri M A, Ansari S A, Alqahtani M H, et al. Roles of telomeres and telomerase in cancer, and advances in telomerase-targeted therapies[J]. Genome Med, 2016, 8(1): 69. DOI:10.1186/s13073-016-0324-x |
| [10] |
张丹, 郝宁波, 唐波, 等. miR-1182调控胃癌细胞人端粒酶反转录酶的分子机制及其对迁移能力的影响[J].
第三军医大学学报, 2014, 36(10): 1074–1077.
Zhang Dan, Hao Ningbo, Tang Bo, et al. Mechanism of miR-1182 regulating human telomerase reverse transcriptase in gastric cancer cells and its effect on cell migration capability[J]. J Third Mil Med Univ, 2014, 36(10): 1074–1077. DOI:10.16016/j.1000-5404.2014.10.033 |
| [11] | Saretzki G. Extra-telomeric functions of human telomerase: cancer, mitochondria and oxidative stress[J]. Curr Pharm Des, 2014, 20(41): 6386–6403. DOI:10.2174/1381612820666140630095606 |
| [12] | Santos J H, Meyer J N, Skorvaga M, et al. Mitochondrial hTERT exacerbates free-radical-mediated mtDNA damage[J]. Aging Cell, 2004, 3(6): 399–411. DOI:10.1111/j.1474-9728.2004.00124.x |
| [13] | Sharma N K, Reyes A, Green P, et al. Human telomerase acts as a hTR-independent reverse transcriptase in mitochondria[J]. Nucleic Acids Res, 2012, 40(2): 712–725. DOI:10.1093/nar/gkr758 |
| [14] | Haendeler J, Drose S, Buchner N, et al. Mitochondrial telomerase reverse transcriptase binds to and protects mitochondrial DNA and function from damage[J]. Arterioscler Thromb Vasc Biol, 2009, 29(6): 929–935. DOI:10.1161/atvbaha.109.185546 |
| [15] | Indran I R, Hande M P, Pervaiz S. hTERT overexpression alleviates intracellular ROS production, improves mitochondrial function, and inhibits ROS-mediated apoptosis in cancer cells[J]. Cancer Res, 2010, 71(1): 266–276. DOI:10.1158/0008-5472.can-10-1588 |
| [16] | Singhapol C, Pal D, Czapiewski R, et al. Mitochondrial telomerase protects cancer cells from nuclear DNA damage and apoptosis[J]. PLoS ONE, 2013, 8(1): e52989. DOI:10.1371/journal.pone.0052989 |
| [17] | Ling X, Zhou Y, Li S W, et al. Modulation of mitochondrial permeability transition pore affects multidrug resistance in human hepatocellular carcinoma cells[J]. Int J Biol Sci, 2010, 6(7): 773–783. DOI:10.7150/ijbs.6.773 |
| [18] | Ling X, Wen L, Zhou Y. Role of mitochondrial translocation of telomerase in hepatocellular carcinoma cells with multidrug resistance[J]. Int J Med Sci, 2012, 9(7): 545–554. DOI:10.7150/ijms.4648 |
| [19] | Yan J, Zhou Y, Chen D, et al. Effects of mitochondrial translocation of telomerase on drug resistance in hepatocellular carcinoma cells[J]. J Cancer, 2015, 6(2): 151–159. DOI:10.7150/jca.10419 |
| [20] | Santos J H, Meyer J N, Van Houten B. Mitochondrial localization of telomerase as a determinant for hydrogen peroxide-induced mitochondrial DNA damage and apoptosis[J]. Hum Mol Genet, 2006, 15(11): 1757–1768. DOI:10.1093/hmg/ddl098 |
| [21] | Haendeler J, Drose S, Buchner N, et al. Mitochondrial telomerase reverse transcriptase binds to and protects mitochondrial DNA and function from damage[J]. Arterioscler Thromb Vasc Biol, 2009, 29(6): 929–935. DOI:10.1161/atvbaha.109.185546 |
| [22] | Indran I R, Hande M P, Pervaiz S. hTERT overexpression alleviates intracellular ROS production, improves mitochondrial function, and inhibits ROS-mediated apoptosis in cancer cells[J]. Cancer Res, 2011, 71(1): 266–276. DOI:10.1158/0008-5472.can-10-1588 |
| [23] | Kovalenko OA, Kaplunov J, Herbig U, et al. Expression of (NES-) hTERT in cancer cells delays cell cycle progression and increases sensitivity to genotoxic stress[J]. PLoS ONE, 2010, 5(5): e10812. DOI:10.1371/journal.pone.0010812 |
| [24] | Kovalenko O A, Caron M J, Ulema P, et al. A mutant telomerase defective in nuclear-cytoplasmic shuttling fails to immortalize cells and is associated with mitochondrial dysfunction[J]. Aging Cell, 2010, 9(2): 203–219. DOI:10.1111/j.1474-9726.2010.00551.x |
| [25] | Balaban R S, Nemoto S, Finkel T. Mitochondria, oxidants, and aging[J]. Cell, 2005, 120(4): 483–495. DOI:10.1016/j.cell.2005.02.001 |
| [26] | Zhou D, Shao L, Spitz D R. Reactive oxygen species in normal and tumor stem cells[J]. Adv Cancer Res, 2014, 122: 1–67. DOI:10.1016/B978-0-12-420117-0.00001-3 |
| [27] | Madungwe N B, Zilberstein N F, Feng Y, et al. Critical role of mitochondrial ROS is dependent on their site of production on the electron transport chain in ischemic heart[J]. Am J Cardiovasc Dis, 2016, 6(3): 93–108. |



