2.400016 重庆,重庆市生物化学与分子药理学重点实验室;
3.400016 重庆,重庆医科大学药学院药理学教研室
2. Chongqing Key Laboratory of Biochemistry and Molecular Pharmacology, Chongqing, 400016;
3. Department of Pharmacology, Pharmacy School of Chongqing Medical University, Chongqing, 400016, China
骨肉瘤是最常见的骨原发恶性肿瘤,主要影响儿童和青少年,最常发生在股骨远端、近端胫骨或肱骨。其疾病进展的特征在于侵袭性的肿瘤生长、频繁复发、肺转移的高风险[1]。目前的主要治疗方法为:手术治疗和化疗、放疗、生物治疗等综合治疗。有研究报告指出,在辅助和新辅助化疗引进之后,5年无病生存率仅提高到了60%[2]。此外,与传统的化疗药物有关的严重的副作用大大降低了患者的生活质量,同时降低了治疗骨肉瘤的效力[3]。越来越多的证据表明,骨肉瘤可以被认为是由成骨细胞的终末分化的遗传和表观遗传被干扰引起的分化缺陷性疾病[4]。因此,诱导分化和(或)绕过分化缺陷可能作为治疗骨肉瘤的一种有效的辅助治疗。
全反式维甲酸(all-trans-retinoic acid,ATRA)是一种高度有效的维生素A的衍生物,并参与几乎所有重要的生理过程和功能[5]。大量的基础实验和临床试验已经表明,全反式维甲酸可以诱导急性早幼粒细胞白血病(APL)和其他类型的肿瘤的分化,包括神经母细胞瘤、乳腺癌和黑色素瘤等[6-9]。此外,本课题组前期研究及其他研究者发现全反式维甲酸在体内和体外均能诱导骨肉瘤细胞的成骨细胞分化,并且能够抑制骨肉瘤细胞增殖[10-11]。骨形态发生蛋白(bone morphogenetic protein,BMP)是属于TGF-β超家族的一种多功能生长因子,其在发育和细胞生理学中起着重要作用,比如增殖、分化、黏附、迁移和凋亡[12]。到目前为止已发现有20余个成员。BMP9是迄今最有效的诱导间充质干细胞成骨分化的BMP成员。本课题组前期研究已发现,ATRA与BMP9联用能够协同促进间充质干细胞成骨分化[13-14],但是二者在骨肉瘤细胞中是否有相同的效应,尚还未得到相关报道。因此,本研究将探明ATRA与BMP9对人骨肉瘤细胞增殖及成骨分化的影响,为骨肉瘤的分化治疗提供相应的理论及实验基础。
1 材料与方法 1.1 试剂和细胞培养全反式维甲酸(ATRA)购自Sigma-Aldrich公司。二甲基亚砜(DMSO)作为溶剂,溶解ATRA,购自北京索莱宝科技有限公司。四甲基偶氮唑蓝(MTT)购自Amersco公司,抗体购自Santa Cruz公司。所有其他试剂,除非另有说明,均购自Sigma-Aldrich公司或Fisher Scientific公司。143B、HEK293细胞株均购自American Type Culture Collection(ATCC)。细胞培养条件为:DMEM培养基(高糖,含10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素)、5%CO2饱和湿度、37 ℃恒温培养箱。
1.2 重组腺病毒构建重组腺病毒表达BMP9(AdBMP9) 生成使用Ad-Easy技术[15],由美国芝加哥大学何通川教授提供。重组腺病毒只表达GFP(AdGFP)用作对照。用HEK293细胞对AdBMP9及AdGFP进行扩增。
1.3 实验设计及分组将143B细胞按实验设计分为对照组和实验组。其中,在研究ATRA对143B细胞的影响时分为ATRA组和对照组,以DMSO处理作为对照组;在研究ATRA联合BMP9对143B细胞的影响时分为对照组、BMP9组、ATRA组及BMP9合并ATRA组,以DMSO合并AdGFP处理作为对照组。重组腺病毒感染率为30%(检测时间点为感染后24 h)。
1.4 MTT检测细胞增殖情况将生长状态良好的细胞消化,然后种于96孔板中。待细胞贴壁后用不同浓度ATRA(10、20、40、60 μmol/L和80 μmol/L)或DMSO处理,分别于24、48 h和72 h用MTT检测,检测ATRA对143B细胞株增殖的影响。方法简述如下:检测前4 h每孔加入0.5%的MTT溶液20 μL,4 h后吸弃上清,每孔加入二甲亚砜150 μL,振荡10 min使沉淀充分溶解后,选择490 nm波长,在酶联免疫检测仪上测定各孔的光密度值。每组实验至少重复3次。然后根据光密度值,以对照组为参照,计算各组相对生长百分数,并绘制成柱状图。
1.5 流式细胞仪周期分析实验用不含EDTA的胰酶将处于指数生长期的143B细胞消化,然后均匀种于6孔板中,待细胞贴壁后(4~6 h)用不同浓度RES(20、40 μmol/L和60 μmol/L)或DMSO进行处理。48 h后收集细胞,用冷的PBS(4 ℃)重悬并离心(800 r/min,5 min×2次)。然后用预冷的70%、50%以及30%乙醇进行固定并用PBS洗涤。加入1 mL PI(20 mg/mL)溶液(含RNA酶,1 mg/mL)孵育30 min。最后流式细胞仪进行周期分析。每组实验至少重复3次。最好整理数据绘制成图。
1.6 半定量PCR逆转录和聚合酶链反应分析(RT-PCR)将处于指数生长期的143B细胞种于T25培养瓶中,并用ATRA的指定浓度处理48 h。使用TRIzol试剂(Invitrogen公司,美国)提取总RNA,并用于通过RT反应以获得的cDNA模板。然后,将cDNA用作模板,用于通过半定量PCR确定靶基因的表达。各基因引物如下:GAPDH, 上游:5′-CAACGAATTTGGCTACAGCA-3′, 下游:5′-AGGGGAGATTCAGTGTGGTG-3′, 170 bp; BMP9, 上游:5′-GCTCCGACTCTATGTCTCCTGT-3′, 下游:5′-CCAGCTTATTTTTGCTCTTGGT-3′, 1 290 bp。每组实验至少重复3次,最后采用Image Lab软件分析灰度值,以靶基因与GAPDH的灰度值比值表示靶基因mRNA含量。
1.7 蛋白质免疫印迹(Western blot)实验将处于指数生长期的143B细胞种于6孔板中,按实验设计采用不同浓度ATR(20、40 μmol/L和60 μmol/L)和(或)AdBMP9处理,用DMSO和(或)AdGFP作为对照。各处理组于相应时间点提取总蛋白,并采用BCA法测定样品总蛋白浓度。按常规Western blot实验方法进行电泳、转膜和抗体孵育,最后利用化学发光试剂盒显影并采集图像。每组实验至少重复3次。最后采用Image Lab软件分析灰度值,以待测蛋白与内参的灰度值比值表示蛋白含量。
1.8 统计学分析采用GraphPad 5.0软件对实验结果进行统计分析,采用t-test进行组间比较,实验数据以x±s表示,检验水准α=0.05。
2 结果 2.1 ATRA对143B细胞增殖的影响MTT检测结果显示:ATRA呈浓度依赖性抑制143B细胞增殖,并且抑制作用随药物作用时间延长而增强(图 1A);ATRA在40 μmol/L时已能明显抑制143B细胞生长(P < 0.01)。ATRA处理143B细胞48 h后,周期分析结果显示:ATRA明显诱导143B细胞发生G1期阻滞(P < 0.05,图 1B)。Western blot实验结果显示:TRA明显降低143B细胞PCNA表达(图 1C),进一步证实ATRA可诱导143B细胞发生G1期阻滞。以上结果提示,ATRA对143B细胞的增殖具有明显抑制作用。
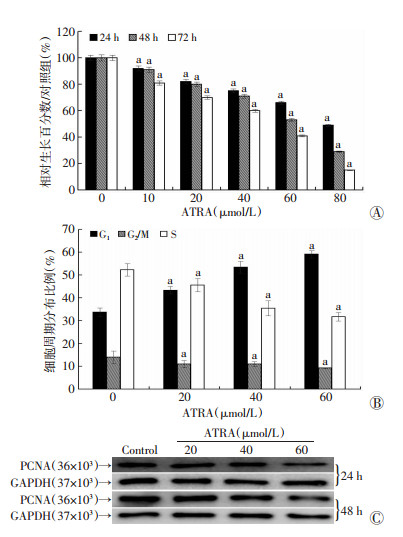
|
| A:MTT检测结果;B:流式细胞仪检测周期结果;C:Western blot 结果;a:P < 0.01,与对照组比较 图 1 ATRA对143B细胞增殖的影响 |
2.2 ATRA对143B细胞成骨分化的影响
ATRA处理143B细胞7 d后,Western blot实验结果显示:ATRA能够上调晚期成骨相关指标(OPN和OCN)表达,并呈浓度依耐性(P < 0.05,图 2)。结果提示,ATRA能够诱导143B细胞向成骨方向分化。

|
| A:Western blot 结果;B:半定量分析OPN、OCN蛋白相对表达水平;a:P < 0.05,b:P < 0.01,与对照组比较 图 2 ATRA对143B细胞成骨分化的影响 |
2.3 ATRA对143B细胞中BMP9表达水平的影响
ATRA处理143B细胞48 h后,半定量PCR结果显示:ATRA处理143B细胞之后,能明显上调143B细胞中BMP9的表达水平,并且呈浓度依赖性(P < 0.05,图 3A、B)。此外,Western blot实验也显示出同样的结果(P < 0.05,图 3C、D)。以上结果提示,ATRA能够上调143B细胞中内源性BMP9的表达水平。
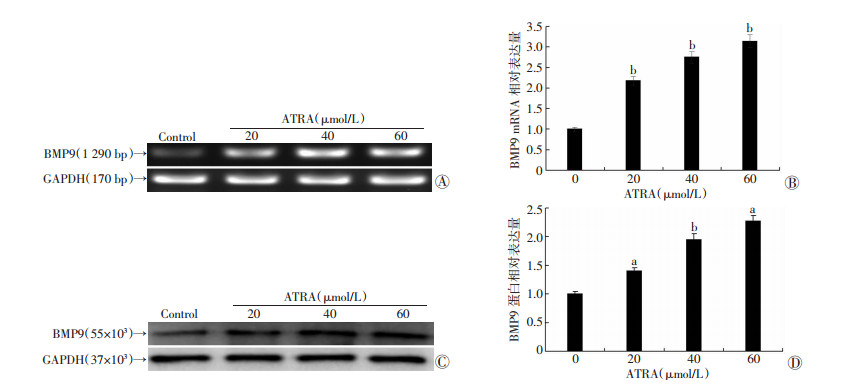
|
| A:PCR结果;B:PCR半定量分析结果;C:Western blot 结果;D:Western blot半定量分析结果;a:P < 0.05,b:P < 0.01,与对照组比较 图 3 ATRA对143B细胞内源性BMP9表达的影响 |
2.4 ATRA与BMP9联用后对143B细胞增殖的影响
外源性AdBMP9与ATRA联合处理143B细胞48 h后,半定量PCR结果显示:单独加入AdBMP9后,能上调143B细胞中BMP9的表达水平;此外与ATRA联用后,能协同上调143B细胞中BMP9的表达水平(图 4A)。Western blot实验也显示出同样的结果(图 4B)。MTT检测结果显示:BMP9能够促进143B细胞的增殖,但被ATRA翻转,并增强了ATRA的抗增殖效果(P < 0.05,图 4C)。这提示BMP9与ATRA联用后能协同抑制143B细胞的增殖。

|
| A:半定量PCR结果;B:Western blot 结果;C:MTT检测结果;a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.01,与ATRA组比较 图 4 ATRA与BMP9联用后对143B细胞增殖的影响 |
2.5 ATRA与BMP9联用后对143B成骨分化的影响
Western blot实验结果显示,单用BMP9并不能上调晚期成骨相关指标(OPN和OCN)表达;但与ATRA联用时,能够增强ATRA诱导的相关成骨指标表达(P < 0.05,图 5)。以上结果提示,ATRA与BMP9联用能够协同诱导其成骨分化。
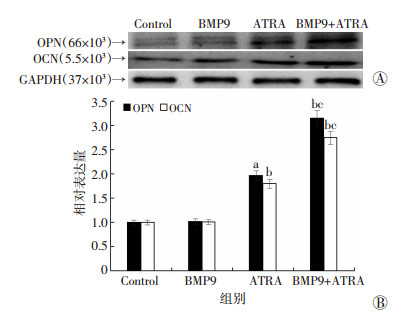
|
| A:Western blot 结果;B:半定量分析OPN、OCN蛋白相对表达水平;a:P < 0.01,与对照组比较;b:P < 0.01,与ATRA组比较 图 5 ATRA与BMP9联用后对143B细胞成骨分化的影响 |
3 讨论
骨肉瘤是最常见的骨原发恶性肿瘤,并被认为是由于成骨细胞的终末分化的遗传和表观遗传被破坏所导致的分化缺陷性疾病[4]。因此,诱导成骨分化可以为治疗骨肉瘤提供一种新策略。本研究表明,ATRA能够成骨诱导骨肉瘤143B细胞向成骨分化并抑制其增殖。并且BMP9能够增强这一作用。但单独的BMP9并不能诱导143B成骨分化,并促进其增殖。这可能与骨肉瘤的分化缺陷有关,而ATRA可能能够恢复BMP9在骨肉瘤中的成骨诱导分化能力,但其机制尚不清楚。
ATRA作为维生素A的一种衍生物,其生物效应主要是通过两个核受体家族:维甲酸受体(RAR)和视黄醇X受体(RXR)发挥作用,其作用方式为二者结合为RAR/RXR异二聚体,再绑定到维甲酸响应基因的启动子区域中的视黄酸应答元件,从而介导下游靶基因表达[16]。ATRA能够成功诱导多种肿瘤分化,其中最著名的就是诱导急性早幼粒细胞白血病(APL)分化,目前已成功应用于临床,并取得了良好的效果[6];此外,其也同样能够诱导骨肉瘤成骨分化,但遗憾的是其尚未应用于临床。大量研究表明,在肿瘤中,增殖和分化有着密切的联系:即诱导其分化,能够抑制其增殖;相反地,如果不能诱导其分化,就会促进其增殖[17]。在本课题前期研究中,发现ATRA能够通过激活BMP/Smad信号通路从而诱导骨肉瘤成骨分化,进而抑制其增殖[10]。本研究结果亦得到类似结果,即本研究结果进一步表明,ATRA能够诱导人骨肉瘤143B细胞株成骨分化,并抑制其增殖(图 1、2),这进一步验证了在肿瘤中,增殖和分化的关系。
BMP9虽然在间充质干细胞中,相比其他BMP成员而言,是迄今最有效的成骨诱导因子。但BMP9并不能够诱导骨肉瘤细胞成骨分化[4]。本研究亦发现到相同结果(图 5),这表明BMP9在骨肉瘤中其功能发挥受到限制,进一步表明骨肉瘤可能是一种分化缺陷引起的疾病。但BMP9对骨肉瘤增殖的影响目前尚存在争议,LV等[18]报道BMP9能够通过Wnt/β-catenin信号通路抑制骨肉瘤细胞增殖,但LI等[19]发现BMP9能够通过灭活Notch信号而促进骨肉瘤细胞增殖。出现这一现象可能与细胞种类及信号通路的不同相关。在本研究中,我们发现BMP9能够促进143B增殖,从上述增殖和分化的联系,可推测BMP9促进143B细胞株增殖,可能是由于其不能成功诱导143B细胞株分化所致。本课题前期研究发现在3T3-L1细胞中,ATRA能够上调其内源性BMP9表达水平,并且能够增强BMP9介导的成骨分化[14]。在本研究中,我们发现ATRA同样能明显上调143B细胞株的内源性BMP9表达水平(图 3),这提示ATRA能诱导143B成骨分化可能与BMP9有关。在进一步研究中,发现当ATRA与外源性BMP9联用时,BMP9能够增强ATRA所诱导的成骨分化(图 5),并且协同抑制143B细胞株的增殖(图 4)。这进一步表明ATRA能成功诱导143B细胞株成骨分化与BMP9有关。鉴于BMP9作为一种极强的成骨诱导因子,但并不能诱导骨肉瘤成骨分化。这提示BMP9的成骨诱导能力可能被ATRA恢复有关。但具体机制尚不明确,需进一步研究发现。
综上所述,ATRA能明显抑制人骨肉瘤143B细胞株增殖并促进其分化,上调其内源性BMP9表达水平;BMP9能够增强ATRA诱导的成骨分化和抗增殖作用;但单独的BMP9表现出与ATRA相反的作用。这提示骨肉瘤可能是由于BMP9功能缺陷引起的一种分化性疾病,并且ATRA能够恢复BMP9的成骨能力。因此,ATRA这一功能可能是治疗骨肉瘤的潜在有效靶点。但是ATRA具体如何恢复BMP9功能的详细机制还有待进一步研究。课题组将进一步分析在骨肉瘤细胞中ATRA恢复BMP9功能的可能机制,为将ATRA应用于临床治疗骨肉瘤提供理论和实验基础。
| [1] | HELMAN L J, MELTZER P. Mechanisms of sarcoma development[J]. Nat Rev Cancer, 2003, 3(9): 685–694. DOI:10.1038/nrc1168 |
| [2] | BIELACK S S, CARRLE D, HARDES J, et al. Bone tumors in adolescents and young adults[J]. Curr Treat Options Oncol, 2008, 9(1): 67–80. DOI:10.1007/s11864-008-0057-1 |
| [3] | GENG S, SUN B, LU R, et al. Coleusin factor, a novel anticancer diterpenoid, inhibits osteosarcoma growth by inducing bone morphogenetic protein-2-dependent differentiation[J]. Mol Cancer Ther, 2014, 13(6): 1431–1441. DOI:10.1158/1535-7163.MCT-13-0934 |
| [4] | LUO X, CHEN J, SONG W X, et al. Osteogenic bmps promote tumor growth of human osteosarcomas that harbor differentiation defects[J]. Lab Invest, 2008, 88(12): 1264–1277. DOI:10.1038/labinvest.2008.98 |
| [5] | CLAGETT-DAME M, KNUTSON D. Vitamin A in reproduction and development[J]. Nutrients, 2011, 3(4): 385–428. DOI:10.3390/nu3040385 |
| [6] | ATASHRAZM F, LOWENTHAL R M, DICKINSON J L, et al. Fucoidan enhances the therapeutic potential of arsenic trioxide and all-trans retinoic acid in acute promyelocytic leukemia, in vitro and in vivo[J]. Oncotarget, 2016, [Epub ahead of print]. DOI:10.18632/oncotarget.10016 |
| [7] | SILVIS A M, MCCORMICK M L, SPITZ D R, et al. Redox balance influences differentiation status of neuroblastoma in the presence of all-trans retinoic acid[J]. Redox Biol, 2016, 7: 88–96. DOI:10.1016/j.redox.2015.11.012 |
| [8] | YAN Y W, LI Z, XU X, et al. All-trans retinoic acids induce differentiation and sensitize a radioresistant breast cancer cells to chemotherapy[J]. BMC Complement Alter Med, 2016, 16: 113. DOI:10.1186/s12906-016-1088-y |
| [9] | AMANN P M, CZAJA K, BAZHIN A V, et al. Knockdown of lecithin retinol acyltransferase increases all-trans retinoic acid levels and restores retinoid sensitivity in malignant melanoma cells[J]. Exp Dermatol, 2014, 23(11): 832–837. DOI:10.1111/exd.12548 |
| [10] | YANG Q J, ZHOU L Y, MU Y Q, et al. All-trans retinoic acid inhibits tumor growth of human osteosarcoma by activating Smad signaling-induced osteogenic differentiation[J]. Int J Oncol, 2012, 41(1): 153–160. DOI:10.3892/ijo.2012.1426 |
| [11] | ZHANG L, ZHOU Q, ZHANG N, et al. E2F1 impairs all-trans retinoic acid-induced osteogenic differentiation of osteosarcoma via promoting ubiquitination-mediated degradation of RARα[J]. Cell cycle, 2014, 13(8): 1277–1287. DOI:10.4161/cc.28190 |
| [12] | DUAN L, YE L, WU R, et al. Inactivation of the phosphatidylinositol 3-kinase/Akt pathway is involved in BMP9-mediated tumor-suppressive effects in gastric cancer cells[J]. J Cell Biochem, 2015, 116(6): 1080–1089. DOI:10.1002/jcb.25063 |
| [13] |
黄帆, 刘映孜, 杨秋琚, 等. 全反式维甲酸增强骨形态蛋白9诱导间充质干细胞成骨分化作用[J].
第三军医大学学报, 2013, 35(4): 328–331.
HUANG F, LIU Y Z, YANG Q J, et al. All-trans retinoic acid enhances BMP9-induced osteogenic differentiation in mesenchymal stem cells[J]. J Third Mil Med Univ, 2013, 35(4): 328–331. DOI:10.16016/j.1000-5404.2013.04.025 |
| [14] | LIU Y, LIU Y, ZHANG R, et al. All-trans retinoic acid modulates bone morphogenic protein 9-induced osteogenesis and adipogenesis of preadipocytes through BMP/Smad and Wnt/β-catenin signaling pathways[J]. Int J Biochem Cell Biol, 2014, 47: 47–56. DOI:10.1016/j.biocel.2013.11.018 |
| [15] | TANG N, SONG W X, LUO J, et al. BMP-9-induced osteogenic differentiation of mesenchymal progenitors requires functional canonical Wnt/beta-catenin signalling[J]. J Cell Mol Med, 2009, 13(8B): 2448–2464. DOI:10.1111/j.1582-4934.2008.00569.x |
| [16] | DILWORTH F J, CHAMBON P. Nuclear receptors coordinate the activities of chromatin remodeling complexes and coactivators to facilitate initiation of transcription[J]. Oncogene, 2001, 20(24): 3047–3054. DOI:10.1038/sj.onc.1204329 |
| [17] | RUIJTENBERG S, VAN DEN HEUVEL S. Coordinating cell proliferation and differentiation: Antagonism between cell cycle regulators and cell type-specific gene expression[J]. Cell cycle, 2016, 15(2): 196–212. DOI:10.1080/15384101.2015.1120925 |
| [18] | LV Z, WANG C, YUAN T, et al. Bone morphogenetic protein 9 regulates tumor growth of osteosarcoma cells through the Wnt/β-catenin pathway[J]. Oncol Rep, 2014, 31(2): 989–994. DOI:10.3892/or.2013.2931 |
| [19] | LI R, ZHANG W, CUI J, et al. Targeting BMP9-promoted human osteosarcoma growth by inactivation of Notch signaling[J]. Curr Cancer Drug Targets, 2014, 14(3): 274–285. DOI:10.2174/1568009614666140305105805 |



