肺癌目前是世界上最常见、死亡率最高的恶性肿瘤,其中非小细胞肺癌 (non small cell lung cancer,NSCLC) 占肺癌总数的85%[1]。第1代可逆性表皮生长因子受体酪氨酸激酶抑制剂 (epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs) 吉非替尼 (Gefitinib) 和厄洛替尼 (Erlotinib) 对EGFR敏感突变肺癌患者有确切的疗效[2-3]。其中有20% ~30%的肺癌患者对EGFR-TKIs药物产生原发性耐药[4],即使对EGFR-TKIs药物初始有效的患者最终都会产生获得性耐药。目前,大部分获得性耐药机制及耐药后治疗策略已被提出并论证,而关于原发性耐药的研究甚少。原发性耐药严重限制了EGFR-TKIs的临床应用。因此,目前临床尚缺乏有效的治疗手段。因此,探讨针对EGFR-TKIs原发性耐药的治疗方案具有重要的临床应用价值。二甲双胍作为一种口服双胍类降糖药物,不仅经济、安全,还被证明有潜在良好的抗肿瘤作用。我们前期的研究结果证实,二甲双胍在体内、外均可克服肺癌细胞对EGFR-TKIs的获得性耐药[5]。为此,我们进一步观察二甲双胍是否能克服EGFR-TKIs原发性耐药。本实验通过研究吉非替尼和二甲双胍联合对原发性耐药非小细胞肺癌H1975细胞的疗效,探究其作用机制,旨在为临床联合治疗提供理论依据。
1 材料与方法 1.1 材料与试剂人肺癌细胞株H1975购自美国国家细胞库 (ATCC),二甲双胍、吉非替尼、MTT购自Sigma公司,RPMI1640培养基购自HyClone公司,胎牛血清购自Gibco公司,TUNEL试剂盒购自Millipore公司,Bcl-xl、Mcl-1、Bax、Vimentin、N-cadherin、Slug、Snail、E-cadherin、GAPDH等抗体购自美国CST公司,山羊血清、荧光标记山羊抗兔IgG抗体、荧光标记山羊抗鼠IgG抗体、山羊抗兔IgG抗体购自美国Abcam公司。
1.2 方法 1.2.1 细胞培养人肺癌细胞株H1975培养于含10%胎牛血清,100 μg/mL青、链霉素的RPMI1640培养基,培养于37 ℃、90%湿度、5%CO2的培养箱中。
1.2.2 MTT检测药物细胞毒性收集处于对数生长期的细胞,按每孔3×103个细胞接种96孔板,培养12 h后弃上清液,每个实验孔加入含不同浓度的二甲双胍、吉非替尼培养基200 μL。在培养箱中继续培养48 h后,每孔加入MTT (5 mg/mL) 20 μL,37 ℃培养4 h,加入二甲基亚砜 (DMSO)150 μL,检测前轻摇混匀,使用酶联检测仪在波长490 nm处检测各孔的光密度值[D(490)]。按照以下公式计算细胞增殖抑制率。细胞增殖抑制率=[(对照组光密度值-药物处理组光密度值)/对照组光密度值]×100%。实验重复3次。
1.2.3 划痕实验收集处于对数生长期细胞,按每孔25×104个细胞接种6孔板,培养12 h后弃上清液,实验设对照组 (正常细胞) 和不同药物作用实验组,实验孔分别加入5 mmol/L二甲双胍、4 μmol/L吉非替尼以及两药联合培养基4 mL。在培养箱中继续培养48 h后,用10 μL枪头垂直划痕,更换含5%胎牛血清的培养基,于0、24 h在显微镜下拍照。实验重复3次。
1.2.4 侵袭实验采用Boyden-Chamber分析法。将具有孔径为8 μm PET膜的Millicell小室放入24孔培养板中,用基质胶Matrigel 50 μL/孔包被Millicell小室的底部,37 ℃过夜使其成凝胶状。将对照组与不同实验处理组的H1975细胞以胰酶消化并收集后,以含1%胎牛血清的RPMI1640培养液制成细胞悬液,调整细胞密度为2×105个/mL,以100 μL/孔接种于上室,下室中加入600 μL含10%胎牛血清的培养基。37 ℃培养48 h,取出Millicell,用棉签小心擦去微孔滤膜上层细胞,以4%多聚甲醛固定30 min,结晶紫染色30 min。光镜下计数滤膜下层的细胞数。实验重复3次。
1.2.5 TUNEL实验收集处于对数生长期细胞,按每孔25×104个细胞接种于铺有载玻片的6孔板上,培养12 h后细胞贴附于玻片,对照组更换新鲜培养基,实验组更换二甲双胍、吉非替尼以及两药联合培养基4 mL,继续培养48 h后进行TUNEL检测,实验过程及步骤严格依照TUNEL检测试剂盒产品说明进行,显微镜下对阴性细胞及阳性细胞进行计数。实验重复3次。
1.2.6 免疫荧光染色收集处于对数生长期细胞,按每孔25×104个细胞接种6孔板,培养12 h后弃上清液,对照组更换新鲜培养基4 mL,实验孔分别加入二甲双胍、吉非替尼以及两药联合培养基4 mL,继续培养48 h后弃培养基,4%多聚甲醛固定30 min,5%普通山羊血清封闭30 min,用E-cadherin抗体1 :50稀释、Vimentin抗体1 :1 00稀释后置于4 ℃孵育过夜,荧光二抗避光孵育1 h,DAPI避光孵育15 min,显微镜下对阴性细胞及阳性细胞进行计数。实验重复3次。
1.2.7 Western blot检测收集并提取对照组及各实验组细胞蛋白溶液,根据BCA法蛋白定量试剂盒说明测定蛋白浓度,样品蛋白通过10% SDS-聚丙烯酰胺凝胶电泳 (PAGE) 分离后经半干转膜仪转至聚偏氩乙烯 (PVDF) 膜上,5%脱脂奶粉常温封闭1 h,一抗 (1 :1 000) 4 ℃孵育过夜,二抗 (1 :5 000) 常温孵育1 h,ECL发光显影液显影,Bio-Rad成像系统采集图像。实验重复3次。
1.3 统计学处理采用SPSS 13.0统计软件进行分析,计量资料以x±s表示,对二甲双胍组、对照组、吉非替尼组、二甲双胍+吉非替尼联合培养组细胞存活率、细胞凋亡率等指标组间差异采用单因素方差分析,两两比较采用LSD-t检验。检验水准:α=0.05。
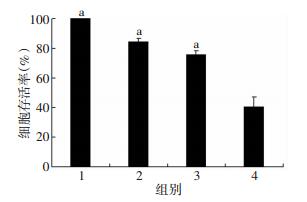
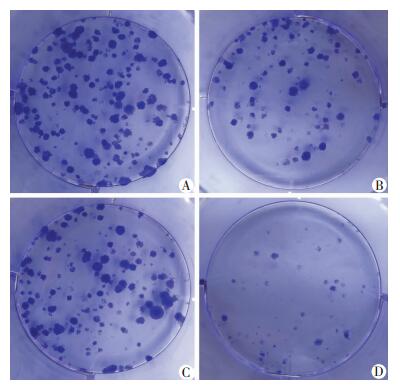
2 结果 2.1 二甲双胍与吉非替尼联用对H1975细胞增殖的影响以5 mmol/L二甲双胍和4 μmol/L吉非替尼分别作用H1975细胞48 h后,通过MTT实验及克隆形成实验检测未见明显的抑制作用;但当吉非替尼 (4 μmol/L) 联合二甲双胍 (5 mmol/L) 后,明显抑制H1975细胞的增殖能力 (P < 0.05,图 1、2)。
|
| a:P < 0.01,与二甲双胍+吉非替尼联合培养组比较1:对照组;2:二甲双胍组;3:吉非替尼组;4:二甲双胍+吉非替尼联合培养组 图 1 MTT检测各组H1975细胞的存活率 |
|
| A:对照组;B:二甲双胍组;C:吉非替尼组;D:二甲双胍+吉非替尼联合培养组 图 2 克隆形成实验检测各组H1975细胞克隆形成能力比较 |
2.2 二甲双胍与吉非替尼联用对H1975细胞侵袭、迁移能力的影响
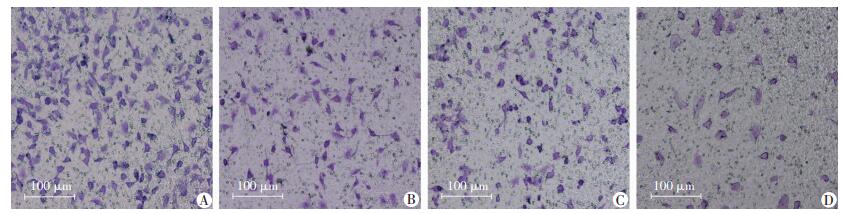
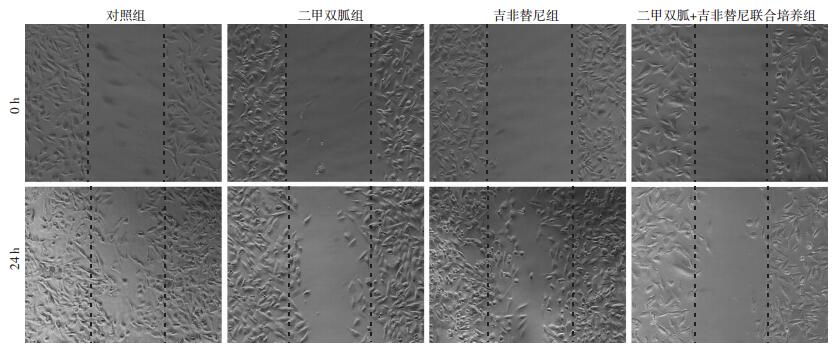
以5 mmol/L二甲双胍和4 μmol/L吉非替尼处理H1975细胞后通过侵袭实验、划痕实验检测发现,两药联合组与单药组细胞相比,细胞侵袭到Transwell小室Matrigel胶下面的细胞数显著降低,细胞迁移至创伤区的能力明显减弱 (图 3、4)。
|
| A:对照组;B:二甲双胍组;C:吉非替尼组;D:二甲双胍+吉非替尼联合培养组 图 3 Transwell实验检测各组H1975细胞侵袭能力 |
|
| 图 4 划痕形成实验检测各组H1975细胞迁移能力 (×10) |
2.3 二甲双胍联合吉非替尼对H1975细胞凋亡的影响
以5 mmol/L二甲双胍和4 μmol/L吉非替尼处理H1975细胞后通过TUNEL实验发现,各单药组细胞凋亡率较对照组增高。与二甲双胍组[(20.01±1.25)%]及吉非替尼组的凋亡率[(21.50±1.59)%]相比,两药联用后H1975细胞凋亡率[(39.55±7.39)%]显著增加。Western blot检测结果同样发现,二甲双胍+吉非替尼联合培养组处理H1975细胞较二甲双胍组、吉非替尼组,促凋亡蛋白Bax表达增高,抗凋亡蛋白Bcl-xl、Mcl-1表达降低 (图 5、6)。

|
| A:对照组;B:二甲双胍组;C:吉非替尼组;D:二甲双胍+吉非替尼联合培养组 图 5 TUNEL检测各组H1975细胞凋亡的变化 |

|
| 1:对照组;2:二甲双胍组;3:吉非替尼组;4:二甲双胍+吉非替尼联合培养组 图 6 Western blot检测各组H1975细胞促凋亡蛋白Bax以及抗凋亡蛋白Bcl-xl、Mcl-1的表达 |
2.4 二甲双胍联合吉非替尼对肺癌H1975细胞上皮
细胞-间充质转化 (epithelial to mesenchymal transition, EMT) 标志分子表达的影响
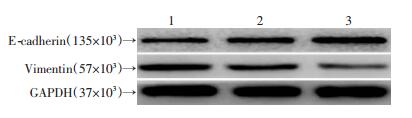
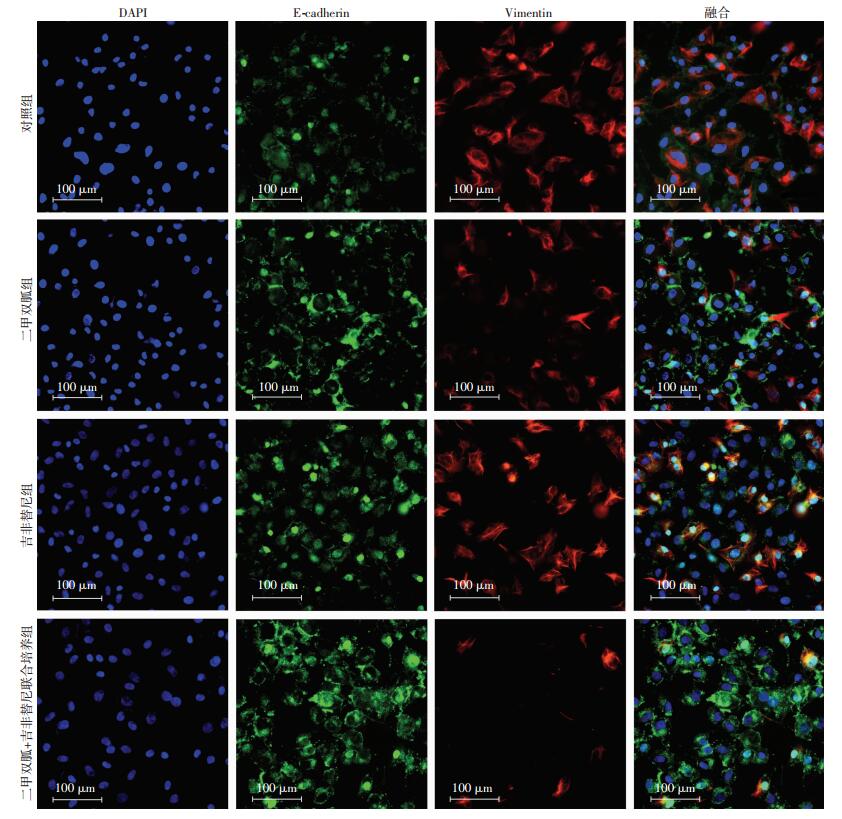
选取3种处于对数生长期的肺癌细胞株,使用Western blot检测各细胞株中E-cadherin、Vimentin的蛋白表达水平。结果显示,吉非替尼原发性耐药肺癌细胞株H1975较吉非替尼敏感肺癌细胞株PC-9、HCC827显示出了EMT转变特征,具体表现为E-cadherin表达水平低,Vimentin表达水平高 (图 7)。为明确二甲双胍协同吉非替尼对原发性耐药肺癌H1975细胞的抑制作用是否与逆转EMT有关,设计实验分组同2.2,免疫荧光和Western blot检测H1975细胞中EMT标志分子的表达差异。两药联合作用48 h后细胞间质标志Vimentin荧光定量和蛋白表达量较单药组均明显降低,Snail、Slug、N-cadherin蛋白表达量较单药组明显减少;细胞上皮标志E-cadherin荧光定量和蛋白表达量较单药组均增加 (图 8、9)。
|
| 1: H1975; 2: HCC827; 3: PC-9 图 7 Western blot检测耐药肺癌H1975细胞、敏感肺癌HCC827细胞及敏感肺癌PC-9细胞中E-cadherin、Vimentin蛋白的表达 |
|
| 图 8 免疫荧光染色法检测各组作用H1975细胞后EMT相关分子E-cadherin、Vimentin荧光定量的表达 |

|
| 1:对照组;2:二甲双胍组;3:吉非替尼组;4:二甲双胍+吉非替尼联合培养组 图 9 Western blot检测各组作用H1975细胞后EMT相关分子E-cadherin、Vimentin、N-cadherin、Slug、Snail蛋白水平的变化 |
3 讨论
可逆性EGFR-TKIs药物 (如吉非替尼) 是用于治疗非小细胞肺癌的重要靶向药物,但EGFR-TKIs原发性耐药肺癌患者不能从中获益,使人们不断寻找新的治疗方法。EGFR-TKIs原发性耐药的发生机制包括PTEN缺失、MET扩增和T790M基因突变等[6]。在EGFR-TKIs治疗前,约有30%的肿瘤标本存在T790M突变,导致EGFR-TKIs原发性耐药[7]。针对T790M突变的肺癌患者,二代不可逆EGFR-TKIs (如阿法替尼) 对T790M突变肺癌细胞有一定的抑制作用,但毒副作用大且不能有效提高患者的总生存期[8]。三代不可逆EGFR-TKIs (如AZD9291和CO-1686) 可阻断T790M突变,但这些新研发EGFR-TKIs药物的面世并应用于临床治疗尚待时日[9-10]。因此,本研究拟寻求简单、有效、经济的联合用药方案以增强EGFR-TKIs原发性耐药肺癌患者对一代EGFR-TKIs的敏感性。
二甲双胍广泛应用于2型糖尿病患者的降糖治疗,能有效降低糖尿病患者肿瘤的发生率及肿瘤相关死亡率[11]。我们回顾性研究发现,与其他降糖药物相比,服用EGFR-TKIs治疗的非小细胞肺癌合并糖尿病患者使用二甲双胍降糖治疗的中位无进展生存期明显延长[12]。我们前期研究证实,二甲双胍通过抑制IL-6/STAT3信号通路协同增强EGFR-TKIs对EGFR-TKIs获得性耐药肺癌细胞的杀伤作用[5]。于是我们希望验证吉非替尼联合二甲双胍是否能协同抑制EGFR-TKIs原发性耐药肺癌细胞。在本课题中,我们发现吉非替尼联合二甲双胍对比吉非替尼单药明显抑制原发性耐药肺癌H1975细胞的增殖、侵袭和迁移,并深入探讨两药联合作用机制。
本研究结果显示,吉非替尼与二甲双胍联用使细胞中Bcl-xl、Mcl-1蛋白表达明显减少,而Bax蛋白表达明显增加。这说明两药联用的确有协同增效作用,且对原发性耐药肺癌H1975细胞的增殖抑制作用可能是通过促进其发生线粒体凋亡实现的。
EMT的发生与EGFR-TKIs原发性耐药密切相关[13]。我们发现EGFR-TKIs原发性耐药肺癌H1975细胞存在EMT改变,该细胞与EGFR-TKIs敏感的HCC827、PC-9细胞相比,上皮标志物E-cadherin表达低,间质标志物Vimentin表达高。当用吉非替尼处理H1975细胞后,上皮标志物E-cadherin及间质标志物N-cadherin、Vimentin、Slug、Snail表达未见明显变化,提示吉非替尼不能逆转H1975细胞发生的EMT改变。有研究证实,二甲双胍可以逆转子宫内膜腺癌细胞及卵巢肿瘤干细胞发生EMT转变[14-15]。当用吉非替尼联合二甲双胍处理原发性耐药H1975细胞后,显著升高E-cadherin蛋白表达水平,降低Vimentin蛋白表达水平,说明二甲双胍可以明显逆转H1975细胞的EMT改变。我们进一步发现吉非替尼与二甲双胍联用能够降低肺癌H1975细胞中Snail、Slug的蛋白表达水平。Snail、Slug是含锌指结构的核转录因子,对E-cadherin的转录表达起到直接抑制作用[16],说明二甲双胍通过影响Snail及Slug参与E-cadherin蛋白的转录调控进而抑制肺癌H1975细胞EMT的发生。发生EMT的肿瘤细胞由于细胞间连接的缺失而更容易侵袭和迁移,因此,两药联用抑制H1975细胞的侵袭和迁移与EMT逆转有关。
综上所述,本研究发现吉非替尼联合二甲双胍对EGFR-TKIs原发性耐药肺癌H1975细胞具有抑制增效作用,其作用机制是激活线粒体凋亡途径及逆转EMT的发生。在后续研究中将继续探讨具体调控的信号通路,为今后临床联合用药奠定更加有力的理论基础。
| [1] | Herbst R S, Heymach J V, Lippman S M. Lung cancer[J]. N Engl J Med, 2008, 359(13): 1367–1380. DOI:10.1056/NEJMra0802714 |
| [2] | Mok T S, Wu Y L, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med, 2009, 361(10): 947–957. DOI:10.1056/NEJMoa0810699 |
| [3] | Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial[J]. Lancet Oncol, 2012, 13(3): 239–246. DOI:10.1016/S1470-2045(11)70393-X |
| [4] | Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010, 362(25): 2380–2388. DOI:10.1056/NEJMoa0909530 |
| [5] | Li L, Han R, Xiao H, et al. Metformin sensitizes EGFR-TKI-resistant human lung cancer cells in vitro and in vivo through inhibition of IL-6 signaling and EMT reversal[J]. Clin Cancer Res, 2014, 20(10): 2714–2726. DOI:10.1158/1078-0432.CCR-13-2613 |
| [6] | Wang J, Wang B, Chu H, et al. Intrinsic resistance to EGFR tyrosine kinase inhibitors in advanced non-small-cell lung cancer with activating EGFR mutations[J]. Onco Targets Ther, 2016, 9: 3711–3726. DOI:10.2147/ott.s106399 |
| [7] | Su K Y, Chen H Y, Li K C, et al. Pretreatment epidermal growth factor receptor (EGFR) T790M mutation predicts shorter EGFR tyrosine kinase inhibitor response duration in patients with non-small-cell lung cancer[J]. J Clin Oncol, 2012, 30(4): 433–440. DOI:10.1200/JCO.2011.38.3224 |
| [8] | Miller V A, Hirsh V, Cadranel J, et al. Afatinib versus placebo for patients with advanced, metastatic non-small-cell lung cancer after failure of erlotinib, gefitinib, or both, and one or two lines of chemotherapy (LUX-Lung 1): a phase 2b/3 randomised trial[J]. Lancet Oncol, 2012, 13(5): 528–538. DOI:10.1016/S1470-2045(12)70087-6 |
| [9] | Thress K S, Paweletz C P, Felip E, et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M[J]. Nat Med, 2015, 21(6): 560–562. DOI:10.1038/nm.3854 |
| [10] | Sequist L V, Soria J C, Goldman J W, et al. Rociletinib in EGFR-mutated non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(18): 1700–1709. DOI:10.1056/NEJMoa1413654 |
| [11] | Leone A, Di Gennaro E, Bruzzese F, et al. New perspective for an old antidiabetic drug: metformin as anticancer agent[J]. Cancer Treat Res, 2014, 159: 355–376. DOI:10.1007/978-3-642-38007-5_21 |
| [12] | Chen H, Yao W, Chu Q, et al. Synergistic effects of metformin in combination with EGFR-TKI in the treatment of patients with advanced non-small cell lung cancer and type 2 diabetes[J]. Cancer Lett, 2015, 369(1): 97–102. DOI:10.1016/j.canlet.2015.08.024 |
| [13] | Park K S, Raffeld M, Moon Y W, et al. CRIPTO1 expression in EGFR-mutant NSCLC elicits intrinsic EGFR-inhibitor resistance[J]. J Clin Invest, 2014, 124(7): 3003–3015. DOI:10.1172/JCI73048 |
| [14] | Liu Z, Qi S, Zhao X, et al. Metformin inhibits 17β-estradiol-induced epithelial-to-mesenchymal transition via βKlotho-related ERK1/2 signaling and AMPKα signaling in endometrial adenocarcinoma cells[J]. Oncotarget, 2016, 7(16): 21315–21331. DOI:10.18632/oncotarget.7040 |
| [15] | Zhang R, Zhang P, Wang H, et al. Inhibitory effects of metformin at low concentration on epithelial-mesenchymal transition of CD44(+) CD117(+) ovarian cancer stem cells[J]. Stem Cell Res Ther, 2015, 6: 262. DOI:10.1186/s13287-015-0249-0 |
| [16] | Tania M, Khan M A, Fu J. Epithelial to mesenchymal transition inducing transcription factors and metastatic cancer[J]. Tumour Biol, 2014, 35(8): 7335–7342. DOI:10.1007/s13277-014-2163-y |



