肝脏具有极强的再生能力和可塑性,在部分肝切除术后,成熟的肝细胞可以通过增生和增殖进行肝再生[1],同时受到精密的调控[2]。肝部分切除术 (partial hepatectomy,PH) 仍然是目前治疗肝脏良恶性疾病的最有效方法[3-4],因此研究部分肝切除术后的肝脏再生调控网络对于理解肝再生过程、防治肝衰竭、预防肿瘤发生具有非常重要的意义[5]。
Tmub1(transmembrane and ubiquitin like domain containing 1) 是一个包含泛素样结构域的核质穿梭蛋白。在肝再生过程中,Tmub1迅速出核并且高表达,起到负向调控肝细胞增殖的作用[6],但目前对于Tmub1负向调控肝再生的机制仍缺乏了解。Securin是一个重要的细胞周期调节蛋白,要完成姐妹染色单体的分离,securin在有丝分裂后期之前必须经过泛素化-蛋白酶体途径降解[7]。课题组前期研究发现Tmub1与securin存在相互作用[8-9]。本研究采用细胞生物学和分子生物学方法,观察Tmub1对大鼠正常肝细胞有丝分裂的影响以及对securin泛素化的影响,旨在探讨Tmub1与securin之间的调控关系及可能的机制。
1 材料与方法 1.1 实验动物与试剂雌性成年SD大鼠由第三军医大学大坪医院野战外科研究所实验动物中心提供。BRL-3A细胞购自中国科学院典型培养物保藏委员会细胞库。南美胎牛血清购自ExCell公司,DMEM培养基购自Gibco公司,总RNA提取试剂盒购自Promega公司,反转录试剂盒购自TaKaRa公司,荧光定量PCR试剂盒购自Qiagen公司,兔抗大鼠Tmub1单克隆抗体、小鼠抗大鼠securin单克隆抗体、兔抗大鼠β-tubulin单克隆抗体、兔抗大鼠ubiquitin单克隆抗体购自Abcam公司,小鼠抗大鼠GAPDH单克隆抗体、山羊抗兔TRITC荧光二抗购自中杉金桥公司,山羊抗兔、山羊抗小鼠HRP偶联二抗购自Proteintech公司,Hoechst 33258染料购自索莱宝公司,Protein G磁珠购自Bio-Rad公司。
1.2 大鼠肝大部分切除术后肝再生模型的建立 1.2.1 大鼠70%部分肝切除术成年SD雌性大鼠40只,体质量 (200±20) g,置于室温恒定、12 h白昼交替、自由进食饮水的相同条件下。将大鼠分为肝切除术后0、6、12、24、48、72、96、168 h共8组,每组5只,采用经典的70%肝大部分切除术。术前大鼠禁食4 h,2%戊巴比妥钠45 mg/kg腹腔注射麻醉,固定,备皮,常规消毒铺巾。自剑突下纵行剪开腹壁3 cm,用无菌棉签充分暴露肝脏,游离肝周韧带。用无菌棉签拨起肝脏,露出左外叶根部,1号丝线于肝叶根部结扎,同样方法结扎肝左中叶及右中叶,剪去肝左、中叶。确切压迫止血后间断缝合腹部切口。术后将大鼠置于灯光下促醒,给予自由进食饮水,观察苏醒和生存情况。
1.2.2 样本的获取和保存于术后相应时间点获取大鼠再生肝组织。大鼠常规麻醉,消毒铺巾,原切口剪开腹腔,解剖门静脉,使用静脉穿刺针穿刺门静脉,剪破下腔静脉,依次使用D-Hanks液和PBS 150 mL灌注肝脏。剪下肝脏,迅速放入液氮中保存。
1.3 RNA提取和逆转录-荧光定量聚合酶链反应 (RT-qPCR)取适量组织,用液氮研磨至粉末,按照试剂盒说明书步骤进行总RNA提取、反转录和荧光定量PCR。PCR引物使用NCBI Primer-BLAST设计,交由成都擎科生物合成,引物序列依次为:Tmub1上游:5′-CCC-G AGGAGCCGAAATGGAG-3′;Tmub1下游:5′-GACGA-CTGTGGTAGGGGATCT-3′;securin上游:5′-CTGCTCCTGATGATGCCTACC-3′;securin下游:5′-CTTCTCAA-GCCCCCTCTCTTC-3′;GAPDH上游:5′-GTTACCAGG-GCTGCCTTCTC-3′;GAPDH下游:5′-ACCAGCTTCCC-ATTCTCAGC-3′。GAPDH作内参基因,采用2-△△Ct法计算目的基因的相对表达量。
1.4 Western blot检测取适量组织剪碎,在玻璃匀浆器中用RIPA裂解液制备细胞裂解液,离心后取上清,BCA法测定总蛋白浓度。行聚丙烯酰胺凝胶电泳,PVDF膜转膜,5%脱脂奶粉常温封闭1 h后,依次孵育一抗及二抗,用化学发光试剂ECL显色液显影检测Tmub1、securin的表达。以GAPDH作内参,结果用Image J软件进行灰度值分析。
1.5 慢病毒稳定过表达和干扰细胞株的构建Tmub1过表达、Tmub1干扰慢病毒及相应阴性对照慢病毒由吉凯基因构建和合成。按照慢病毒感染操作说明书以感染复数 (MOI)=30感染BRL-3A细胞,72 h后使用荧光显微镜观察绿色荧光蛋白表达情况,7 d后使用嘌呤霉素筛选抗性细胞株,继续培养7 d后使用Western blot检测Tmub1过表达和干扰效率。
1.6 免疫荧光观察细胞有丝分裂Tmub1过表达组和阴性对照组细胞于24孔板中细胞爬片上培养24 h,用330 nmol/L诺考达唑处理18 h 获取同步于有丝分裂前中期的细胞。更换为完全培养基后,于0、0.5、1、1.5 h分别取出细胞爬片,多聚甲醛固定、山羊血清封闭,用抗β-tubulin一抗和TRITC荧光二抗标记微管、Hoechst 33258标记染色体,封片后置于荧光显微镜下观察。
1.7 免疫沉淀-Western blot检测securin的泛素化水平使用MG-132处理细胞4 h后,用含蛋白酶抑制剂、NEM的RIPA裂解液裂解细胞,protein G磁珠和securin一抗室温孵育30 min,分别加入Tmub1过表达、干扰和正常BRL-3A 3组细胞总蛋白1 mg,4 ℃孵育过夜,用1×上样缓冲液95 ℃孵育10 min洗脱反应产物,用ubiquitin抗体进行Western blot检测免疫沉淀产物中securin的泛素化水平。
1.8 统计学分析使用Image J软件计算Western blot条带灰度值,数据采用SPSS 19.0统计软件进行分析,计量资料结果以x±s表示,采用t检验进行两组间均数比较,单因素方差分析与LSD法进行多组间均数比较。
2 结果 2.1 大鼠70%肝切除术后Tmub1和securin的表达趋势RT-qPCR检测结果显示,在大鼠70%肝切除术后7 d内,Tmub1的mRNA水平首先逐渐增加,在术后48 h达到最高,随后逐渐降低;securin的mRNA水平也在48 h最高。Western blot检测结果显示,Tmub1的蛋白水平在70%肝切除术后逐渐升高,在24、48 h达到最高,与mRNA水平高峰基本一致;securin的蛋白水平在术后逐渐降低,在48 h最低,与mRNA趋势基本相反。该现象提示securin在肝再生过程中可能受到了翻译后修饰的调控,从而引起了蛋白水平的降低 (图 1、表 1)。

|
| 1:0 h;2:6 h;3:12 h;4:24 h;5:48 h;6:72 h;7:96 h;8:168 h 图 1 Western blot检测Tmub1和securin在大鼠70%肝切除术后各时间点的表达趋势 |
| 时相点 | securin | Tmub1 | |||
| mRNA | 蛋白 | mRNA | 蛋白 | ||
| 0 h | 0.070±0.035 | 1.135±0.050 | 0.887±0.340 | 1.216±0.167 | |
| 6 h | 0.050±0.025 | 1.508±0.200 | 0.186±0.108 | 1.345±0.341 | |
| 12 h | 0.016±0.008 | 0.832±0.104 | 0.575±0.150 | 1.495±0.445 | |
| 24 h | 0.800±0.006 | 0.298±0.012 | 1.000±0.203 | 1.988±0.338 | |
| 48 h | 1.230±0.215 | 0.041±0.010 | 1.200±0.334 | 1.599±0.062 | |
| 72 h | 1.007±0.252 | 0.423±0.017 | 1.023±0.200 | 1.022±0.192 | |
| 96 h | 0.329±0.135 | 0.178±0.050 | 0.800±0.123 | 0.459±0.114 | |
| 168 h | 0.379±0.080 | 1.540±0.242 | 1.000±0.200 | 0.226±0.206 | |
2.2 慢病毒感染效率
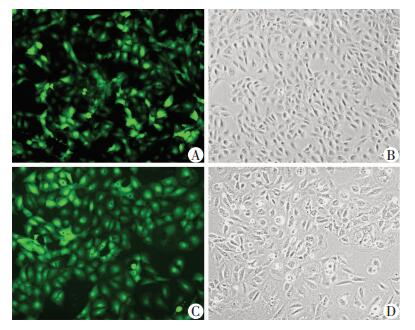
成功使用BRL-3A细胞构建慢病毒稳定感染细胞株。免疫荧光观察绿色荧光表达情况,各组慢病毒感染效率均约为90%(图 2)。Western blot检测结果显示,Tmub1干扰慢病毒组Tmub1表达量明显低于阴性对照组,Tmub1过表达慢病毒组Tmub1表达量明显高于阴性对照组 (图 3),干扰和过表达效果满意。
|
| A、B:Tmub1干扰慢病毒感染效率;C、D:Tmub1过表达慢病毒感染效率;A、C:绿色荧光;B、D:白光 图 2 荧光显微镜观察慢病毒感染效率 (×100) |

|
| 1:Tmub1过表达组; 2:Tmub1过表达的阴性对照组; 3:Tmub1干扰组; 4:Tmub1干扰的阴性对照组 图 3 Western blot检测慢病毒过表达和干扰效率 |
2.3 过表达Tmub1对BRL-3A细胞有丝分裂的影响
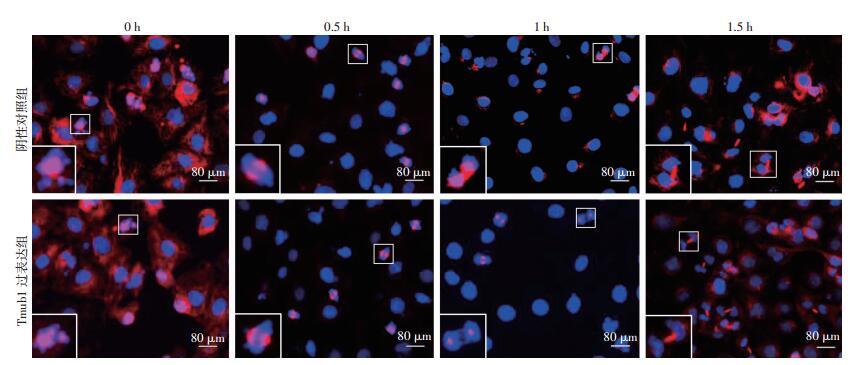
细胞周期同步化后的免疫荧光结果显示,在有丝分裂各个时相点中,随着有丝分裂的进展,阴性对照组中处于有丝分裂相的细胞比例逐渐降低,在0、0.5、1、1.5 h时,阴性对照组中处于有丝分裂相的细胞比例分别为 (32.86±1.52)%、(26.20±4.32)%、(7.23±3.58)%、(7.03±1.28)%。而Tmub1过表达组中处于有丝分裂相的细胞比例大致保持在稳定的 (19.45±4.01)%,上述结果提示Tmub1过表达可影响BRL-3A细胞的有丝分裂,可能起到了负向调控作用,从而使细胞有丝分裂进程减慢 (图 4)。
|
| 红色荧光:β-tubulin,示微管/纺锤体;蓝色荧光:Hoechst 33258,示染色体;左下角方框为局部放大图像 图 4 免疫荧光检测Tmub1过表达组及阴性对照组细胞有丝分裂情况 |
2.4 Tmub1可抑制securin的泛素化
RT-qPCR和Western blot检测结果显示:Tmub1过表达组和阴性对照组 (P=0.07)、Tmub1干扰组和阴性对照组之间 (P=0.10) 的securin mRNA表达差异均无统计学意义 (图 5A),而Tmub1过表达组securin蛋白表达量明显高于阴性对照组 (P < 0.01),Tmub1干扰组securin蛋白表达量明显低于阴性对照组 (P=0.014,图 5B)。免疫沉淀-Western blot检测结果显示:Tmub1过表达组的securin泛素化水平显著低于阴性对照组 (P < 0.01),Tmub1干扰组的securin泛素化水平显著高于阴性对照组 (P < 0.01,图 5C)。

|
| 1:Tmub1过表达组; 2:Tmub1过表达的阴性对照组; 3:Tmub1干扰的阴性对照组; 4:Tmub1干扰组 A:RT-qPCR检测各组Tmub1和securin的mRNA表达量;B:Western blot检测各组securin的蛋白表达量;C:免疫沉淀-Western blot检测各组securin的泛素化水平 图 5 Tmub1对securin泛素化水平的影响 |
3 讨论
肝再生的精密调控网络保证了肝脏在恢复体积和功能的同时不发生过度增殖[10],因此除如何促进肝再生之外,如何抑制和调控肝再生也是需要研究的关键问题[11-12]。作为肝再生相关分子机制研究的一部分,Tmub1最早被报道具有核质穿梭的特点和负向调控肝细胞增殖的作用[6],而Tmub1作为包含泛素样结构域的蛋白 (UBLs) 的相关功能一直少见报道。UBLs由于具有类似泛素的结构域,与经典的泛素化途径存在复杂的联系和交互作用,如SUMO[13]、NEDD8[14]、FAT10[15]等,因此UBLs可以通过调控泛素化底物从而实现对细胞周期、凋亡、衰老、代谢等细胞事件的调控。
大鼠70%肝切除术后肝再生模型是经典的肝再生研究模型[16],在70%肝切除后的第1~3天,大鼠大部分成熟肝细胞重新进入细胞周期,进行第1轮增殖,第4~7天部分肝细胞进行第2轮增殖,在第7天结束时肝脏体积可恢复术前水平[17]。通过观察大鼠肝70%肝切除术后再生全程Tmub1和securin的表达趋势,我们发现在肝细胞再生过程中,Tmub1随着肝再生的进行表达量增加,提示Tmub1可能参与了肝再生调控;而securin可能受到了翻译后修饰调控,从而引起了其蛋白水平的降低,与肝再生细胞分裂的需求相适应。构建慢病毒载体过表达Tmub1后的免疫荧光实验提示过表达Tmub1可影响细胞有丝分裂,可能调控了有丝分裂中后期的转换过程从而延长了有丝分裂时间。由于securin在有丝分裂中后期转换中有重要调控作用,我们进一步证明了Tmub1并非通过调控securin的基因表达,而是可通过抑制securin的泛素化降解来提高securin的蛋白水平,从而负向调控再生肝细胞的有丝分裂进程。
以上研究结果证实了Tmub1对于细胞周期的负向调控作用,揭示了Tmub1抑制肝再生的一个分子机制,为进一步研究肝再生机制提供了一个新的方向。Tmub1作为3次跨核膜的蛋白,在增殖细胞的不同细胞周期中有不同的细胞定位和作用[18],除有丝分裂期以外,Tmub1对G1、S和G2期也可能存在相应的调控。Tmub1核质穿梭现象的存在给深入研究其功能带来了难度,然而,要更加深入了解Tmub1对细胞周期的调控机制,必须结合Tmub1在细胞周期中的定位特征,在细胞周期同步化和精确时相定位的基础上来进行探讨,以更深入地阐明细胞周期调控和肝再生的机制。
| [1] | Miyaoka Y, Miyajima A. To divide or not to divide: revisiting liver regeneration[J]. Cell Div, 2013, 8(1): 8. DOI:10.1186/1747-1028-8-8 |
| [2] | Alison M R, Lin W R. Regenerating the liver: not so simple after all?[J]. F1000Res, 2016, 5: 1818. DOI:10.12688/f1000research.8827.1 |
| [3] | Dhir M, Melin A A, Douaiher J, et al. A Review and Update of Treatment Options and Controversies in the Management of Hepatocellular Carcinoma[J]. Ann Surg, 2016, 263(6): 1112–1125. DOI:10.1097/SLA.0000000000001556 |
| [4] | Zhu Z X, Huang J W, Liao M H, et al. Treatment strategy for hepatocellular carcinoma in China: radiofrequency ablation versus liver resection[J]. Jpn J Clin Oncol, 2016, 46(12): 1075–1080. DOI:10.1093/jjco/hyw134 |
| [5] | Minuk G Y. Hepatic regeneration: If it ain't broke, don't fix it[J]. Can J Gastroenterol, 2003, 17(7): 418–424. DOI:10.1016/j.wneu.2016.06.074 |
| [6] | Della Fazia M A, Castelli M, Bartoli D, et al. HOPS: a novel cAMP-dependent shuttling protein involved in protein synthesis regulation[J]. J Cell Sci, 2005, 118(Pt 14): 3185–3194. DOI:10.1242/jcs.02452 |
| [7] | Li M, York J P, Zhang P. Loss of Cdc20 causes a securin-dependent metaphase arrest in two-cell mouse embryos[J]. Mol Cell Biol, 2007, 27(9): 3481–3488. DOI:10.1128/MCB.02088-06 |
| [8] | 赵晓彪, 李光耀, 刘孟刚, 等. 肝部分切除术后Tmub1蛋白与securin蛋白的相互作用研究[J]. 解放军医学杂志, 2014, 39(11): 864–867. DOI:10.11855/j.issn.0577-7402.2014.11.04 |
| [9] | 马德宾, 沈雁兵, 王保林, 等. Tmub1沉默对大鼠肝部分切除术后肝细胞增殖的影响[J]. 第三军医大学学报, 2013, 35(9): 850–853. DOI:10.16016/j.1000-5404.2013.09.019 |
| [10] | Sasturkar S V, David P, Sharma S, et al. Serial changes of cytokines and growth factors in peripheral circulation after right lobe donor hepatectomy[J]. Liver Transpl, 2016, 22(3): 344–351. DOI:10.1002/lt.24373 |
| [11] | Fabregat I, Moreno-Càceres J, Sánchez A, et al. TGF-β signalling and liver disease[J]. FEBS J, 2016, 283(12): 2219–2232. DOI:10.1111/febs.13665 |
| [12] | Nygård I E, Mortensen K E, Hedegaard J, et al. The genetic regulation of the terminating phase of liver regeneration[J]. Comp Hepatol, 2012, 11(1): 3. DOI:10.1186/1476-5926-11-3 |
| [13] | Eifler K, Vertegaal A C. Mapping the SUMOylated landscape[J]. FEBS J, 2015, 282(19): 3669–3680. DOI:10.1111/febs.13378 |
| [14] | Enchev R I, Schulman B A, Peter M. Protein neddylation: beyond cullin-RING ligases[J]. Nat Rev Mol Cell Biol, 2015, 16(1): 30–44. DOI:10.1038/nrm3919 |
| [15] | Liu H, Li J, Tillman B, et al. Ufmylation and FATylation pathways are downregulated in human alcoholic and nonalcoholic steatohepatitis, and mice fed DDC, where Mallory-Denk bodies (MDBs) form[J]. Exp Mol Pathol, 2014, 97(1): 81–88. DOI:10.1016/j.yexmp.2014.05.010 |
| [16] | Meier M, Andersen K J, Knudsen A R, et al. Liver regeneration is dependent on the extent of hepatectomy[J]. J Surg Res, 2016, 205(1): 76–84. DOI:10.1016/j.jss.2016.06.020 |
| [17] | Martins P N, Theruvath T P, Neuhaus P. Rodent models of partial hepatectomies[J]. Liver Int, 2008, 28(1): 3–11. DOI:10.1111/j.1478-3231.2007.01628.x |
| [18] | Castelli M, Piobbico D, Bartoli D, et al. Different functions of HOPS isoforms in the cell: HOPS shuttling isoform is determined by RIP cleavage system[J]. Cell Cycle, 2014, 13(2): 293–302. DOI:10.4161/cc.27054 |



