2. 400010 重庆,重庆医科大学附属第二医院:肝胆外科
2. Department of Hepatobiliary Surgery, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010, China
对于中晚期肝癌,高强度聚焦超声 (high intensity focused ultrasound,HIFU) 作为一种非侵入性的治疗技术,通过热效应、空化效应及机械效应,造成肿瘤组织凝固坏死,从而达到治疗目的,已成为前景良好的肝癌治疗辅助方式。但是,HIFU治疗后残余癌的快速复发是影响其治疗效果和限制其发展的重要因素。在前期动物实验中,我们观察到HIFU不完全消融可促进血管形成。随后在体外细胞实验中发现,相较于未经HIFU处理的肝癌细胞,HIFU不完全消融后残余肝癌细胞对内皮细胞的迁移、增殖及小管形成的促进作用更强,提示其具备更强的促血管生成能力[1-2]。而血管生成,对肿瘤组织的生长、复发、转移具有至关重要的作用,是肿瘤细胞多项生物学特性的基础[3-4],需要多种促进或抑制因子的参与。血管内皮生长因子 (vascular endothelium growth factor,VEGF) 是一种强力的促血管生成因子,在原发性肝癌 (hepatocellular carcinoma,HCC) 中常可见表达[5],其表达水平对评估肝癌的血管侵袭性、复发、转移及预后有一定的指导作用[6]。除了VEGF外,缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α) 同样可调控肿瘤的血管生成,并对肿瘤的生长速率、侵袭性和转移性起重要的调控作用[7]。有研究表明HIF-1α通过对VEGF表达的调控,从而控制肿瘤的血管生成[8]。也有研究指出,HIF-1α仅在缺氧初期参与调控VEGF的表达,而在持续缺氧中,由同属于缺氧诱导因子家族 (hypoxia-inducible factors, HIFs) 的缺氧诱导因子2α(HIF-2α) 调控VEGF的表达[9]。此外,Notch信号通路同样参与了VEGF对肿瘤血管生成的调控过程[10]。本研究观察HIF-1α、HIF-2α、VEGF、Notch等基因在高强度聚焦超声不完全消融肝癌血管新生中的表达及其作用,以期了解高强度聚焦超声不完全消融后残余肝癌血管新生的机制。
1 材料与方法 1.1 实验材料及仪器 1.1.1 细胞株及分组情况人肝癌SMMC7721细胞株由重庆医科大学生物工程学院惠赠。实验共分5组,HIFU残留肝癌细胞亚系为实验组,未处理肝癌细胞为对照组,转染HIF-2α基因沉默重组慢病毒残留肝癌细胞为抑制HIF-2α组,转染VEGF基因沉默重组慢病毒残留肝癌细胞为抑制VEGF组,转染空载慢病毒残留肝癌细胞为空载组。
1.1.2 主要材料DMEM培养基、胎牛血清购自HyClone公司,鼠抗人VEGF单克隆一抗购自Santa Cruz公司,鼠抗人HIF-1α单克隆一抗、兔抗人HIF-2α多克隆一抗、羊抗人DLL4多克隆一抗均购自Abcam公司,兔抗人Notch1单克隆一抗购自CST公司,鼠抗人GAPDH单克隆一抗购自北京中杉金桥生物技术有限公司。VEGF及HIF-2α基因沉默重组慢病毒颗粒 (LV-shRNA-VEGF和LV-shRNA-HIF-2α) 及空载慢病毒颗粒 (LV-shRNA-NC,均同时带有绿色荧光蛋白和嘌呤霉素抗性筛选标记) 由上海汉恒生物技术有限公司协助包装。PCR引物由上海生工生物工程有限公司合成。逆转录试剂盒及荧光定量PCR试剂盒SYBR Premix Ex TaqTM(Perfect Real-time) 购自TaKaRa宝生物工程 (大连) 有限公司。
1.1.3 特殊仪器HIFU系统由重庆医科大学超声工程研究所研制。三气培养箱 (美国Thermo Fisher Scientific Forma 3131),倒置荧光显微镜成像系统 (德国Leica DMIL LED)。
1.2 实验方法 1.2.1 细胞培养及实验组细胞构建实验组细胞的构建参照本课题前期实验[1],设定HIFU系统参数为声功率5 W,声波频率10.10 MHz,辐照温度47 ℃时所筛选出的稳定细胞系为实验组细胞。细胞采用10%血清浓度的DMEM培养基,置于37 ℃、5%CO2条件下的细胞敷箱培养,常规换液、传代、冻存。
1.2.2 细胞免疫荧光检测VEGF蛋白在对照组及实验组表达情况对照组和实验组细胞按1×105/mL接种于24孔板制备细胞爬片,加入完全培养基,37 ℃、5%CO2条件培养24 h后用PBS清洗3次,随后加入4%多聚甲醛,37 ℃固定30 min后弃去固定液,PBS清洗3次。加入0.1%Triton X-100以破除细胞膜,37 ℃孵育10 min,弃掉Triton X-100,用PBS清洗3次。将爬片置于蜡板上,加入10%山羊血清覆盖爬片,37 ℃封闭1 h,PBS清洗3次后,加入鼠抗人VEGF一抗 (1 :100),4 ℃孵育过夜。次日移除一抗,用PBS清洗3次后加入羊抗鼠荧光二抗 (1 :200),37 ℃避光孵育1 h后PBS清洗3次。加入DAPI,37 ℃避光孵育5 min后PBS清洗3次。立即用防淬灭封片剂封片,在荧光显微镜下观察并拍照。
1.2.3 对照组与实验组细胞各时间点的低氧处理将对照组与实验组细胞按2×105/mL接种于6孔板,每组细胞每个时间点重复3个孔,共计接种4块6孔板,每孔加入完全培养基,37 ℃、5%CO2条件培养过夜后,更换完全培养基,放入37 ℃、5%CO2、1%O2[7]条件下的三气培养箱,分别培养到指定时间取出。
1.2.4 Western blot检测各时间点细胞HIF-1α、HIF-2α、VEGF蛋白表达水平于低氧培养0、6、12、24 h取出对照组与实验组细胞,使用蛋白提取试剂盒 (碧云天,中国) 提取蛋白后,BCA测定蛋白浓度,加入4倍的5×SDS上样缓冲液,混匀后置于沸水5 min,分装后取适量蛋白样本采用Western blot检测HIF-1α、HIF-2α、VEGF的蛋白表达水平,其余样本存储于-80 ℃。
1.2.5 荧光定量PCR检测各时间点细胞HIF-1α、HIF-2α、VEGF mRNA表达水平分别于低氧培养0、6、12、24 h取出对照组与实验组细胞,手工法提取RNA,40 μL体系逆转录后,采用荧光定量PCR技术检测HIF-1α、HIF-2α、VEGF的mRNA表达水平 (表 1),RNA样本存储于-80 ℃。
| 基因名称 | 引物序列 (5′→3′) |
| HIF-1α | 正义链GTTCACAAATCAGCACCAAGC 反义链GGGGATGGAGGAAGGTCAAC |
| HIF-2α | 正义链TCCGAGAACATGACCAAGAGTC 反义链GCAGGTTGCGAGGGTTGT |
| VEGF | 正义链CGCTTACTCTCACCTGCTTCTG 反义链GGGGATGGAGGAAGGTCAAC |
| Notch1 | 正义链GCCGCCTTTGTGCTTCTGTTC 反义链TCCTCGTCCCCCCACTCATTC |
| DLL4 | 正义链TCCCCACAGTGACAAGAGCTTAGG 反义链CGGGGCTGAGCAGGGATGTC |
| GAPDH | 正义链AGGCTGTGGGCAAGGTCATCCC 反义链CCGCCTGCTTCACCACCTTCTT |
1.2.6 细胞转染LV-shRNA-HIF-2α、LV-shRNA-NC及稳定转染细胞株的筛选
第1天将实验组细胞按照4×105/mL接种于6孔板,共计2孔,每孔加入完全培养基,37 ℃、5%CO2条件培养24 h。转染前,从冰箱取出LV-shRNA-HIF-2α(siRNA序列:GAACTTCGAGGAGTCCTCAGCCTAT)、LV-shRNA-NC (空载序列:TTCTCCGAACGTGTCACGT) 慢病毒并在冰上缓慢融化,吸去细胞原有培养基,加入1 mL新鲜培养基,再将病毒原液加入细胞中,轻轻8字混匀。37 ℃转染4 h,4 h后补齐培养基至2 mL。转染后约24 h,吸去含病毒的培养液,换上新鲜的完全培养液,继续37 ℃培养。转染后48 h,可通过荧光显微镜观测绿色荧光蛋白表达情况。然后换上含嘌呤霉素 (2 μg/mL) 的新鲜完全培养液,筛选稳定转导的细胞株,设立未转染组,加入相同浓度的嘌呤霉素。次日未转染组细胞被嘌呤霉素杀光,将转染并筛选后的细胞进行传代,并继续施加嘌呤霉素 (1 μg/mL) 进行维持性筛选培养。连续筛选并传3代后,得到稳定转染细胞株,大量扩增后冻存于液氮罐中备用。抑制HIF-2α组:转染HIF-2α基因沉默重组慢病毒残留肝癌细胞;空载组:转染空载慢病毒残留肝癌细胞。
1.2.7 Western blot检测抑制HIF-2α组、实验组、对照组及空载组细胞HIF-2α、VEGF的蛋白表达水平低氧处理24 h后取出各组细胞,采用Western blot检测HIF-2α、VEGF的蛋白表达水平,操作同1.2.4。
1.2.8 荧光定量PCR检测抑制HIF-2α组、实验组、对照组及空载组细胞HIF-2α、VEGF的mRNA表达水平低氧处理24 h后取出各组细胞,采用荧光定量PCR检测HIF-2α、VEGF的mRNA表达水平 (表 1),操作同1.2.5。
1.2.9 细胞转染LV-shRNA-VEGF、LV-shRNA-NC及稳定转染细胞株的筛选转染前,从冰箱取出LV-shRNA-VEGF (siRNA序列:GCGCAAGAAATCCCGGTATAA)、LV-shRNA-NC慢病毒并在冰上缓慢融化。其余操作同1.2.6。抑制VEGF组:转染VEGF基因沉默重组慢病毒残留肝癌细胞;空载组:转染空载慢病毒残留肝癌细胞。
1.2.10 Western blot检测抑制VEGF组、实验组、对照组及空载组细胞VEGF、DLL4、Notch1蛋白表达水平低氧处理24 h后取出各组细胞,采用Western blot检测VEGF、DLL4、Notch1的蛋白表达水平,操作同1.2.4。
1.2.11 荧光定量PCR检测抑制VEGF组、实验组、对照组及空载组细胞VEGF、DLL4、Notch1 mRNA表达水平低氧处理24 h后取出各组细胞,采用荧光定量PCR检测VEGF、DLL4、Notch1的mRNA表达水平 (表 1),操作同1.2.5。
1.3 统计学分析应用SPSS 19.0统计软件进行统计分析,数据以x±s表示,不同低氧时间点处理后实验组与对照组组间分析采用重复测量方差分析,组间各时间点比较采用独立样本t检验,组内各时间点采用配对t检验。转染慢病毒后各个细胞组间比较采用单因素方差分析,组间两两比较采用LSD法。检验水准:α=0.05。
2 结果 2.1 对照组与实验组细胞的VEGF蛋白免疫荧光表达情况免疫荧光检测结果显示,绿色荧光所示的VEGF蛋白主要在细胞质中表达,且在对照组与实验组细胞中均有表达 (图 1)。

|
| A:实验组; B:对照组蓝色荧光为细胞核, 绿色荧光为VEGF蛋白 图 1 免疫荧光检测VEGF在实验组和对照组中的表达 (×200) |
2.2 各时间点对照组与实验组细胞HIF-1α、HIF-2α、VEGF蛋白表达水平
随着缺氧时间的增加,实验组与对照组HIF-1α蛋白的表达都呈现先上升后下降的趋势,在缺氧12 h达到表达的高峰期,随后开始下降,但仍然高于常氧条件。而实验组与对照组HIF-2α、VEGF蛋白表达都随着缺氧时间的增加呈现逐渐上升的趋势。同时观察到实验组细胞HIF-2α、VEGF、HIF-1α蛋白表达水平均明显高于对照组细胞 (P < 0.05,图 2)。
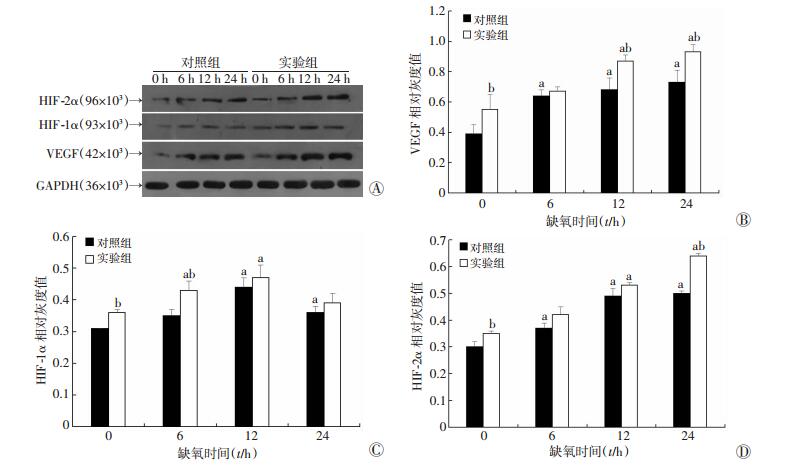
|
| A:Western blot检测结果;B~D:VEGF、HIF-1α、HIF-2α半定量分析结果a:P < 0.05, 与0 h比较;b:P < 0.05, 与对照组比较 图 2 实验组和对照组在低氧处理不同时间点HIF-1α、HIF-2α、VEGF蛋白的表达水平 |
2.3 对照组与实验组各时间点细胞HIF-1α、HIF-2α、VEGF mRNA表达水平
随着缺氧时间的增加,实验组与对照组HIF-1α mRNA的表达都呈现先上升后下降的趋势,在缺氧12 h达到表达的高峰期,随后开始下降,但仍然高于常氧条件。而实验组与对照组HIF-2α、VEGF mRNA表达都随着缺氧时间的增加呈现逐渐上升的趋势。同时观察到实验组细胞HIF-1α、HIF-2α、VEGF mRNA表达水平均高于对照组细胞 (P < 0.05,图 3)。
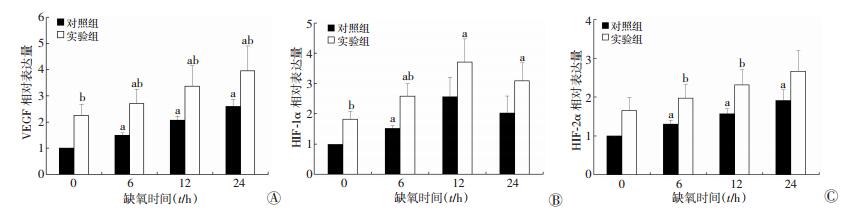
|
| A:VEGF;B: HIF-1α;C: HIF-2α a: P < 0.05, 与0 h比较;b: P < 0.05, 与对照组比较 图 3 实验组和对照组低氧处理不同时间点HIF-1α、HIF-2α、VEGF mRNA表达水平 |
2.4 荧光评价稳定转染细胞株转染效果
转染后48 h,转染成功细胞即可表达绿色荧光,72 h可达巅峰。倒置荧光显微镜观察嘌呤霉素筛选出的稳定转染细胞,可见几乎全部细胞表达绿色荧光,表明稳定转染细胞株建立成功,可进行下一步实验 (图 4)。
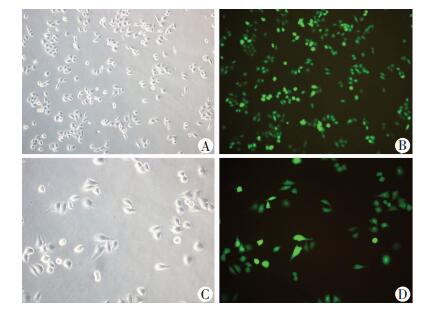
|
| A、C:明场图像; B、D:暗场图像; A、B:×100;C、D:×200 图 4 倒置荧光显微镜下实验组细胞转染情况 |
2.5 抑制HIF-2α组、实验组、对照组及空载组细胞HIF-2α、VEGF的蛋白表达水平
实验组细胞HIF-2α蛋白高于对照组细胞及抑制HIF-2α组细胞 (P < 0.05),但与空载组细胞比较,差异无统计学意义 (P > 0.05);抑制HIF-2α组细胞HIF-2α蛋白与对照组比较,差异无统计学意义 (P > 0.05)。实验组细胞VEGF蛋白明显高于对照组细胞及抑制HIF-2α组细胞 (P < 0.05),但与空载组细胞比较,差异无统计学意义 (P > 0.05);抑制HIF-2α组细胞VEGF蛋白与对照组差异无统计学意义 (P > 0.05,图 5)。
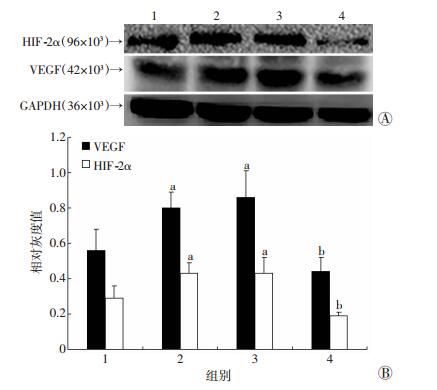
|
| 1:对照组;2:实验组;3:空载组;4:抑制HIF-2α组A:Western blot检测结果;B:半定量分析结果a:P < 0.05,与对照组比较;b:P < 0.05,与实验组比较 图 5 抑制HIF-2α组、实验组、对照组及空载组HIF-2α、VEGF蛋白表达水平 |
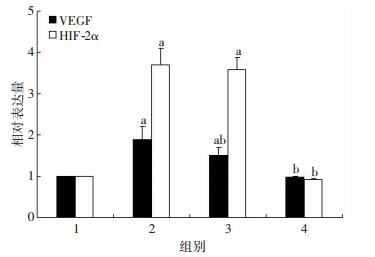
2.6 抑制HIF-2α组、实验组、对照组及空载组细胞HIF-2α、VEGF mRNA表达水平
实验组细胞HIF-2α mRNA明显高于对照组细胞及抑制HIF-2α组细胞 (P < 0.05),但与空载组细胞比较,差异无统计学意义 (P > 0.05);抑制HIF-2α组细胞HIF-2α mRNA与对照组比较,差异无统计学意义 (P > 0.05)。实验组细胞VEGF mRNA明显高于对照组细胞及抑制HIF-2α组细胞 (P < 0.05),与空载组细胞比较,差异有统计学意义 (P < 0.05),与蛋白检测结果不同可能为样本量小所致。抑制HIF-2α组细胞VEGF mRNA与对照组比较,差异无统计学意义 (P > 0.05,图 6)。
|
| 1:对照组;2:实验组;3:空载组;4:抑制HIF-2α组a:P < 0.05,与对照组比较;b:P < 0.05,与实验组比较 图 6 抑制HIF-2α组、实验组、对照组及空载组HIF-2α、VEGF mRNA表达水平 |
2.7 抑制VEGF组、实验组、对照组及空载组细胞VEGF、Notch1、DLL4蛋白表达水平
实验组细胞VEGF蛋白明显高于对照组细胞及抑制VEGF组细胞 (P < 0.05),但与空载组细胞比较,差异无统计学意义 (P > 0.05);抑制VEGF组细胞VEGF蛋白与对照组差异有统计学意义 (P < 0.05)。实验组细胞Notch1蛋白明显高于对照组细胞及抑制VEGF组细胞 (P < 0.05),但与空载组细胞比较,差异无统计学意义 (P > 0.05);抑制VEGF组细胞Notch1蛋白与对照组比较,差异有统计学意义 (P < 0.05)。实验组细胞DLL4蛋白高于对照组细胞及抑制VEGF组细胞 (P < 0.05),但与空载组细胞比较,差异无统计学意义 (P > 0.05)。抑制VEGF组细胞DLL4蛋白与对照组比较,差异无统计学意义 (P > 0.05,图 7)。

|
| 1:对照组;2:实验组;3:空载组;4:抑制VEGF组A:Western blot检测结果;B:半定量分析结果a:P < 0.05,与对照组比较;b:P < 0.05,与实验组比较 图 7 抑制VEGF组、实验组、对照组及空载组细胞VEGF、Notch1、DLL4蛋白表达水平 |
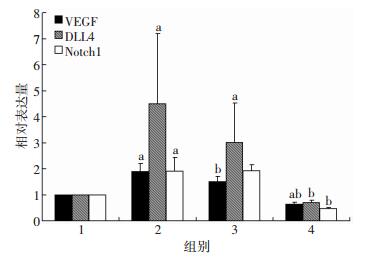
2.8 抑制VEGF组、实验组、对照组及空载组细胞VEGF、Notch1、DLL4 mRNA表达水平
实验组细胞VEGF mRNA明显高于对照组细胞及抑制VEGF组细胞 (P < 0.05),但与空载组细胞比较,差异有统计学意义 (P < 0.05);抑制VEGF组细胞VEGF mRNA与对照组比较,差异有统计学意义 (P < 0.05)。实验组细胞Notch1 mRNA明显高于对照组细胞及抑制VEGF组细胞 (P < 0.05),但与空载组比较,细胞差异无统计学意义 (P > 0.05);抑制VEGF组细胞Notch1 mRNA与对照组比较,差异无统计学意义 (P > 0.05)。实验组细胞DLL4 mRNA明显高于对照组细胞及抑制VEGF组细胞 (P < 0.05),但与空载组细胞比较,差异无统计学意义 (P > 0.05);抑制VEGF组细胞DLL4 mRNA与对照组比较,差异无统计学意义 (P > 0.05,图 8)。这与蛋白表达检测结果不同可能为样本量小所致。
|
| 1:对照组;2:实验组;3:空载组;4:抑制VEGF组 a:P < 0.05,与对照组比较;b:P < 0.05,与实验组比较 图 8 抑制VEGF组、实验组、对照组及空载组细胞VEGF、Notch1、DLL4 mRNA表达水平 |
3 讨论
HCC是一种消化系统的恶性肿瘤,在全球均有较高的发病率及致死率,尤其是在发展中国家,其致死率更是远高于发达国家[11]。目前的主要治疗方法为外科手术切除或肝移植,但也仅适用于部分患者,其余的治疗方式如化疗、射频消融等均有一定效果,但同时也可引起一系列严重的并发症[12]。近年来,HIFU作为一种微创的肝癌辅助治疗方式受到了广泛的关注,然而HIFU治疗后残余癌的快速复发也被越来越多的临床中心所注意到,但其机制至今仍不十分清楚。有研究表明,HIFU治疗后,残余的肿瘤细胞处于严重缺氧的微环境,其可能与HIFU导致的肿瘤组织微血管损伤有关[13]。HCC是一种血供丰富的实体肿瘤,其生长过程中由于肿瘤组织生长过快,糖酵解旺盛,往往存在微环境缺氧[14]。缺氧诱导因子在肿瘤组织的缺氧环境中起关键作用,其可参与并介导肿瘤的生长、转移、代谢、血管生成等多个重要环节,且目前的研究主要集中在HIF-1α和HIF-2α。HIF-2α与HIF-1α有48%的同源氨基酸序列及相似的分子结构,HIF-1α在短暂缺氧时被大量激活,在持续缺氧情况下HIF-1α的含量会逐渐减少甚至消失,而HIF-2α则在缺氧的一段时期内持续增加,并调控持续缺氧下的缺氧反应基因 (VEGF) 的表达[9]。在本实验中同样观察到这一现象,HIF-1α在细胞缺氧12 h后达到高峰,随后开始逐渐减少,而HIF-2α在缺氧过程中逐渐增加,同时VEGF在持续缺氧下同样逐渐增加,并且我们发现实验组细胞HIF-2α、VEGF表达均高于对照组细胞,提示HIFU残留肝癌快速复发可能同HIF-1α、HIF-2α及VEGF介导的血管新生有关。已有研究表明,HIF-2α相较于HIF-1α,对VEGF启动子具有更强的反式激活作用,甚至HIF-2α在小鼠肝血管瘤中主导了VEGF和其他血管生成因子的表达[15-17]。我们发现,相较于实验组细胞,抑制HIF-2α组细胞HIF-2α及VEGF表达均下调,提示在HIFU残留肝癌细胞中,HIF-2α同样对VEGF起调控作用,且结合之前的结果,我们认为HIF-2α相较于HIF-1α,对VEGF表达调控更为关键。
当然,在肝癌组织血管新生的过程中还需要其他因子的参与,DLL4-Notch信号通路就是其中之一。Notch家族由Notch受体、配体和DNA结合蛋白 (CSL) 组成,目前已经发现有4种Notch受体 (Notch1、Notch2、Notch3、Notch4) 及5种Notch配体,包括Jagged1、Jagged2、DLL1、DLL3和DLL4。有研究发现5个配体中,仅Jagged1和DLL4在肝脏中表达,而4种Notch受体均在肝脏中表达[18]。DLL4/Notch1调节血管的新生和有序成形,Jagged1可促进造血干细胞形成,Notch3调控血管平滑肌细胞成熟,而Notch4作用仍未阐明,但脉管系统内过表达Notch4可导致胚胎血管生成异常[19]。有研究表明,沉默血管内皮细胞DLL4可导致细胞周期停滞,促进凋亡,减少基质层小管形成,同时,抑制VEGF可导致细胞迁移,这些都将对血管形成造成重大影响[20]。Lobov等[21]发现,VEGF位于Notch信号通路的上游,VEGF结合VEGFR2后,可通过提高Notch配体如DLL4等表达水平,从而激活Notch信号通路。以上研究都表明了Notch信号通路对血管新生的调控都伴随有VEGF的密切参与。本实验也观察到实验组VEGF、Notch、DLL4表达都高于对照组,提示HIFU残留肝癌细胞有着更强的血管生成能力。我们同样观察到,抑制VEGF组细胞的VEGF、Notch、DLL4表达均下调,表明在HIFU残留肝癌细胞中,VEGF仍然参与调控Notch信号通路的表达和血管新生。
综上所述,我们发现在HIFU残留肝癌中,HIF-2α、VEGF、Notch信号通路仍参与了血管新生的调控,由缺氧刺激引起的HIF-2α表达如同信号中心,发出指令促进了VEGF的分泌,而增多的VEGF又促进DLL4的分泌,从而激活Notch信号通路,进而调控血管新生。我们推测HIFU残留肝癌血管新生与HIFU残留肝癌的快速复发具有密切关系。我们探索出的HIF-2α-VEGF-Notch信号通路参与了HIFU残留肝癌血管新生的过程,可通过针对特定的靶点运用相应的靶向药物,如抗VEGF的靶向药物贝伐单抗,或针对Notch信号通路与VEGF协同用药,从而减少耐药,提高用药效率。当然,因为这条通路所涉及的因子众多,又与体内其他通路有着密切联系,仍需要继续深入研究。总之,我们发现的HIF-2α-VEGF-Notch信号通路具有积极的临床意义,进一步揭示了HIFU残留肝癌快速进展的新机制,为提高HIFU治疗肝癌的疗效提供了新思路。
| [1] |
张映林, 陈蛟, 吴涯昆, 等. 高强度聚焦超声不完全消融对体外培养肝癌细胞的影响[J].
第三军医大学学报, 2015, 37(3): 261–266.
Zhang Y L, Chen J, Wu Y K, et al. Effect of insufficient ablation of high intensity focused ultrasound on hepatoma cells in vitro[J]. J Third Mil Med Univ, 2015, 37(3): 261–266. DOI:10.16016/j.1000-5404.201408161 |
| [2] | Wu L, Fu Z, Zhou S, et al. HIF-1α and HIF-2α: Siblings in promoting angiogenesis of residual hepatocellular carcinoma after high-intensity focused ultrasound ablation[J]. PLoS ONE, 2014, 9(2): e88913. DOI:10.1371/journal.pone.0088913 |
| [3] | Bao S, Wu Q, Sathornsumetee S, et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor[J]. Cancer Res, 2006, 66(16): 7843–7848. DOI:10.1158/0008-5472.CAN-06-1010 |
| [4] | Carmeliet P, Dor Y, Herbert J M, et al. Role of HIF-1alpha in hypoxia-mediated apoptosis, cell proliferation and tumour angiogenesis[J]. Nature, 1998, 394(6692): 485–490. DOI:10.1038/28867 |
| [5] | Kaseb A O, Hanbali A, Cotant M, et al. Vascular endothelial growth factor in the management of hepatocellular carcinoma: a review of literature[J]. Cancer, 2009, 115(21): 4895–4906. DOI:10.1002/cncr.24537 |
| [6] | Kaseb A O, Morris J S, Hassan M M, et al. Clinical and prognostic implications of plasma insulin-like growth factor-1 and vascular endothelial growth factor in patients with hepatocellular carcinoma[J]. J Clin Oncol, 2011, 29(29): 3892–3899. DOI:10.1200/JCO.2011.36.0636 |
| [7] | Zhao J, Du F, Shen G, et al. The role of hypoxia-inducible factor-2 in digestive system cancers[J]. Cell Death Dis, 2015, 6: e1600. DOI:10.1038/cddis.2014.565 |
| [8] | Boreddy S R, Sahu R P, Srivastava S K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: pivotal role of STAT-3[J]. PLoS ONE, 2011, 6(10): e25799. DOI:10.1371/journal.pone.0025799 |
| [9] | Holmquist-Mengelbier L, Fredlund E, Löfstedt T, et al. Recruitment of HIF-1alpha and HIF-2alpha to common target genes is differentially regulated in neuroblastoma: HIF-2alpha promotes an aggressive phenotype[J]. Cancer Cell, 2006, 10(5): 413–423. DOI:10.1016/j.ccr.2006.08.026 |
| [10] | Benedito R, Rocha S F, Woeste M, et al. Notch-dependent VEGFR3 upregulation allows angiogenesis without VEGF-VEGFR2 signalling[J]. Nature, 2012, 484(7392): 110–114. DOI:10.1038/nature10908 |
| [11] | Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [12] | Corey K E, Pratt D S. Current status of therapy for hepatocellular carcinoma[J]. Therap Adv Gastroenterol, 2009, 2(1): 45–57. DOI:10.1177/1756283X08100328 |
| [13] | Chen L P, Li N, Ye H. The effect of high intensity focused ultrasound on vascular endothelial growth factor and microvessel density in rabbit V-X2 hepatocellular carcinoma models[J]. Hepatogastroenterology, 2013, 60(121): 136–139. DOI:10.5754/hge12469 |
| [14] | Wouters B G, Koritzinsky M. Hypoxia signalling through mTOR and the unfolded protein response in cancer[J]. Nat Rev Cancer, 2008, 8(11): 851–864. DOI:10.1038/nrc2501 |
| [15] | Xia G, Kageyama Y, Hayashi T, et al. Regulation of vascular endothelial growth factor transcription by endothelial PAS domain protein 1 (EPAS1) and possible involvement of EPAS1 in the angiogenesis of renal cell carcinoma[J]. Cancer, 2001, 91(8): 1429–1436. |
| [16] | Akeno N, Czyzyk-Krzeska M F, Gross T S, et al. Hypoxia induces vascular endothelial growth factor gene transcription in human osteoblast-like cells through the hypoxia-inducible factor-2alpha[J]. Endocrinology, 2001, 142(2): 959–962. DOI:10.1210/endo.142.2.8112 |
| [17] | Rankin E B, Rha J, Unger T L, et al. Hypoxia-inducible factor-2 regulates vascular tumorigenesis in mice[J]. Oncogene, 2008, 27(40): 5354–5358. DOI:10.1038/onc.2008.160 |
| [18] | Nijjar S S, Wallace L, Crosby H A, et al. Altered Notch ligand expression in human liver disease: further evidence for a role of the Notch signaling pathway in hepatic neovascularization and biliary ductular defects[J]. Am J Pathol, 2002, 160(5): 1695–1703. DOI:10.1016/S0002-9440(10)61116-9 |
| [19] | Liu Z, Fan F, Wang A, et al. Dll4-Notch signaling in regulation of tumor angiogenesis[J]. J Cancer Res Clin Oncol, 2014, 140(4): 525–536. DOI:10.1007/s00432-013-1534-x |
| [20] | Hellström M, Phng L K, Hofmann J J, et al. Dll4 signalling through Notch1 regulates formation of tip cells during angiogenesis[J]. Nature, 2007, 445(7129): 776–780. DOI:10.1038/nature05571 |
| [21] | Lobov I B, Renard R A, Papadopoulos N, et al. Delta-like ligand 4 (Dll4) is induced by VEGF as a negative regulator of angiogenic sprouting[J]. Proc Natl Acad Sci U S A, 2007, 104(9): 3219–3224. DOI:10.1073/pnas.0611206104 |



