阿尔茨海默病 (Alzheimer’s disease, AD),为老年痴呆的一种常见类型,其特征以渐进的认知功能下降为主[1]。既往研究表明AD大脑内存在多种病理改变:神经元纤维缠结和β-淀粉样蛋白 (amyloid-beta peptides, Aβ) 沉积, 神经纤维脱髓鞘,轴突退化和突触功能障碍等[2-6]。海马结构作为学习记忆功能的载体,在探讨AD的早期发病阶段扮演重要的角色[7]。Desai等[8]发现3xTg-AD小鼠在6月龄时出现海马脱髓鞘和少突胶质细胞标记物的相应减少。我们推测早期AD海马内有髓神经纤维的改变可能是AD早期记忆和认知功能下降的重要原因之一。
然而海马各亚区对疾病的敏感程度又不一样[9-10],那么AD海马不同区域内有髓神经纤维及其髓鞘的改变是否存在差异呢?我们团队前期研究发现10月龄Tg2576转基因AD小鼠海马仅齿状回 (dentate gyrus,DG) 内存在有髓神经纤维的丢失[11]。目前转基因AD模型鼠有多种表型被用于AD行为学和机制的研究[12],不同表型的模型小鼠其大脑内病理改变的特点和程度各不尽相同。与单转Tg2576模型相比,APP/PS1双转基因模型其病理改变程度更严重,在模拟与AD相关的神经病理学改变方面可能更接近于真实的AD患者[13]。然而目前没有早期APP/PS1转基因AD小鼠海马及海马不同区域内的有髓神经纤维的相关研究报道。为此,本实验将选取雄性10月龄APP/PS1转基因AD小鼠和同月龄野生型小鼠各7只,运用无偏体视学三维定量方法结合电子显微镜技术研究AD海马CA1和DG内有髓神经纤维的一系列超微结构参数改变情况,以期探讨早期AD行为学发生改变的结构基础,为AD的早期防治提供有效的靶点。
1 材料与方法 1.1 实验动物10月龄雄性APP/PS1模型小鼠和野生型小鼠各7只,每天给予充足的水和食物,昼夜交替,室温保持在 (22±1)℃,湿度保持在55%左右,每周更换1次垫料。
1.2 Morris水迷宫测试2组小鼠均采用Morris水迷宫进行连续6 d的测试:前5 d为定位航行实验,第6天为空间探索实验,来检测空间学习和记忆能力[14-16]。我们选用直径为1 m,高为0.5 m的圆桶作为测试工具,将圆桶等分为4个象限并设置4个入水点,将平台随机放入某一象限的中间。实验水温控制在20~22 ℃,同时必须保持周围环境的安静。在前5 d的定位航行实验,保持水面高于平台1~1.5 cm,随机选择每天的入水点顺序,从每个入水点均入水测试1次,每天的测试环境及平台位置均要保持不变。先把小鼠置于平台上15 s,让其熟悉环境,然后将小鼠面朝池壁轻放入水,记录小鼠的寻台时间 (即逃避潜伏期,从入水到找到平台且停留3 s,保证老鼠在平台上停留而不是越过平台)。如果小鼠在60 s内未找到平台,引导老鼠到平台并让其爬上去,则记录其寻台时间为60 s,并将其再置于平台上15 s。实验结束,将小鼠移出水迷宫。第6天的空间探索实验,将平台所在位置标记好后撤除平台,选择两个离之前平台所在象限较远的两个入水点进行测试,记录小鼠穿台次数以及在之前平台所在象限的时间百分比。
1.3 标本取材与固定每只小鼠先用1%戊巴比妥钠按0.4 mL/100 g的剂量进行腹腔注射麻醉,接着迅速剪开胸腔暴露心脏,将灌注泵针头经心尖刺入左心室固定,同时刺破右心耳,先以10 mL/min的速度用50~60 mL生理盐水灌注内脏至颜色变浅,再以相同速度用2%多聚甲醛与2.5%戊二醛混合液灌注固定至身体僵硬。剖出大脑,自大脑纵裂将大脑分成左右两半球。随机选取一侧大脑包埋于6%琼脂中,冷却后以冠状方向切成1 mm厚的连续脑切片,每侧大脑半球可切7~9张等距离的组织片。
1.4 计算海马及CA1、DG体积每只小鼠随机抽取一侧大脑半球含有海马结构的连续切片,在解剖显微镜下拍照,叠加等距的测试点 (图 1),计数落在海马结构上的总点数,运用卡瓦列里原理[17]计算海马体积Vhp。

|
| 图 1 解剖显微镜下显示叠加等距的点及其计数落在海马结构上 (蓝线标记区) 的总点数 |
接着利用冰冻切片机在每一张脑片的表面切下10 μm厚的冰冻切片并用苏木精染色,然后在体视学显微镜下画CA1、DG边界,拍照,并在表面叠加等距点 (图 2),求出落在CA1、DG上的点数和海马结构上的点数之比,即CA1、DG与海马体积之比。根据已经求出的海马体积,即可算出CA1和DG体积。
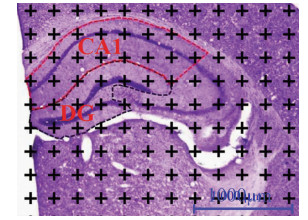
|
| 图 2 CA1、DG区边界被标出计数CA1、DG区的总点数 |
1.5 制备电镜切片
组织取块 (1 mm×1 mm×1 mm),置于4 ℃冰箱中用4%的戊二醛浸泡固定2 h,经0.1 mol/L PBS (pH 7.2) 冲洗3次,然后用锇酸 (OsO4) 在4 ℃条件下染色2 h。依次经过50%、70%、90%、100%乙醇脱水,再用环氧丙烷脱水,然后用环氧丙烷与树脂不同比例溶液浸润组织块,最后浸泡在100%树脂中。为保证获得各向同性切片,将经过电镜染色的标本按“球切法”[18]处理,即将浸泡好的组织块放入直径为5 mm的球形小腔中,然后用树脂充填小腔,树脂变硬后包埋的标本就形成了球形,然后滚动小球,以确保在不同的方向被切取的机会均等。再按常规电镜包埋方法包埋小球。从包埋好的每个电镜组织块随机切取1张60 nm厚的超薄切片。镜下放大8 000倍,等距随机选取20个视野 (第一的视野在左上部随机选择,随后以之字形等距移动) 进行拍照。
1.6 体视学分析 1.6.1 计算海马DG内有髓神经纤维总长度及总体积、髓鞘总体积在放大8 000倍的电镜照片上随机叠加无偏计数框,根据禁线法则:计数所有位于计数框内的纤维断面数和部分位于框内但没有与实线及其延长线有任何交叉的纤维断面,确定待测的有髓神经纤维断面数 (图 3),再根据体视学方法计算单位体积内有髓神经纤维的长度密度,用之前计算得到的海马齿状回总体积乘以单位体积内有髓神经纤维的长度密度就得到了海马内有髓神经纤维的总长度[19-21]。
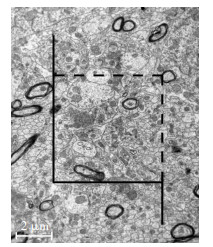
|
| 图 3 将二维无偏计数框随机叠加在电镜照片上计数有髓神经纤维断面数 |
在所得的电镜照片上随机叠加等距点 (图 4),分别计数落在整个DG内、有髓神经纤维及其髓鞘上的点数。再根据体视学方法[19-21]分别计算有髓神经纤维及其髓鞘的体积密度,用之前计算得到的DG总体积分别乘以单位体积内有髓神经纤维的体积密度、有髓神经纤维髓鞘的体积密度就得到了海马齿状回内有髓神经纤维的总体积、有髓神经纤维髓鞘的总体积[19-21]。
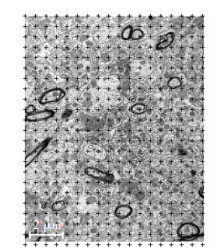
|
| 图 4 随机叠加等距测点数分别计数击中整张电镜照片的测点数以及只击中有髓神经纤维及髓鞘的测点数 |
1.6.2 计算海马CA1内有髓神经纤维总长度及总体积、髓鞘总体积
具体方法同1.6.1部分。
1.7 统计学分析使用SPSS 19.0统计软件经过正态分布检验后,Morris水迷宫前5 d定位航行实验数据采用重复测量的方差分析。其余数据用正态检验,如果符合正态分布则用t检验,如果非正态分布则用非参数检验。检验水准:α=0.05。
2 结果 2.1 Morris水迷宫结果 2.1.1 定位航行实验结果与同月龄野生型小鼠相比,10月龄APP/PS1转基因AD小鼠在前5d的定位航行实验中的逃避潜伏期显著延长 (P=0.011, 图 5)。

|
| a: P < 0.05, 与野生型组比较 图 5 两组小鼠Morris水迷宫定位航行实验检测结果 |
2.1.2 空间探索实验结果
与同月龄野生型小鼠相比,10月龄APP/PS1转基因AD小鼠在第6天的空间探索实验中的平台所在象限游泳时间百分比显著减小 (P=0.001);而穿台次数差异不具有统计学意义 (P=0.276, 图 6)。
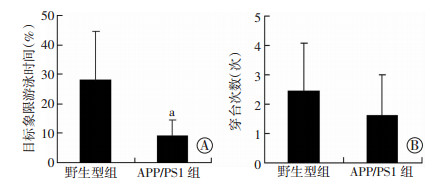
|
| A:目标象线游泳时间;B:穿台次数a:P < 0.01,与野生型组比较 图 6 两组小鼠Morris水迷宫空间探索实验目标象限游泳时间百分比和穿台次数 |
2.2 体视学定量结果 2.2.1 海马、CA1、DG体积
10月龄APP/PS1转基因AD小鼠海马体积较同月龄野生型小鼠显著减少30.6%(P < 0.01),CA1体积较同月龄野生型小鼠显著减少21.9%(P=0.045),DG体积较同月龄野生型小鼠显著减少41.8%(P=0.001,图 7)。

|
| a:P < 0.05, b:P < 0.01,与野生型组比较 图 7 两组小鼠海马、CA1、DG体积比较 |
2.2.2 海马有髓神经纤维总长度
10月龄APP/PS1转基因AD小鼠CA1内有髓神经纤维总长度较同月龄野生型小鼠减少20.0%(P=0.949), DG内有髓神经纤维的总长度较同月龄野生型小鼠减少45.9%(P=0.482,图 8)。
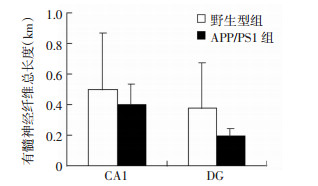
|
| 图 8 两组海马CA1区DG内有髓神经纤维总长度的比较 |
2.2.3 海马有髓神经纤维的总体积
10月龄APP/PS1转基因AD小鼠CA1内有髓神经纤维总体积较同月龄野生型小鼠显著减少36.0%(P=0.039),DG内有髓神经纤维的总体积较同月龄野生型小鼠显著性的减少42.9%(P=0.041,图 9)。
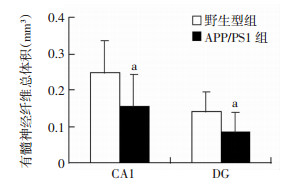
|
| a:P < 0.05,与野生型组比较 图 9 两组海马CA1区, DG内有髓神经纤维总体积的比较 |
2.2.4 海马有髓神经纤维髓鞘总体积
10月龄APP/PS1转基因AD小鼠CA1内有髓神经纤维髓鞘的总体积较同月龄野生型小鼠显著减少45.4%(P=0.018),DG内有髓神经纤维髓鞘的总体积较同月龄野生型小鼠显著减少57.1%(P=0.007,图 10)。
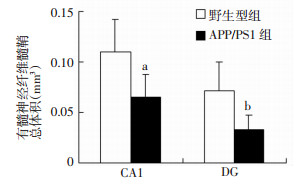
|
| a:P < 0.05,b:P < 0.01,与野生型组比较 图 10 两组海马CA1区, DG内有髓神经纤维髓鞘总体积的比较 |
3 讨论
随着人口老龄化程度加剧,AD患病率逐渐增加,给家庭社会也带来巨大的经济负担,因此越来越多的科学家对AD机制进行深入研究。而在众多的实验研究中,APP/PS1转基因小鼠模型的病理改变可能更接近真实的AD患者[13]。本团队前期研究发现:APP/PS1转基因小鼠开始出现行为学改变的时间大约为10月龄,而2、4、6月龄和8月龄的APP/PS1转基因AD小鼠行为学均未发生改变[22]。可见,10月龄APP/PS1转基因AD小鼠为AD发病的早期。本研究发现:10月龄APP/PS1转基因AD小鼠的逃避潜伏期显著性增加并且所在象限游泳时间百分比显著减少。实验结果提示10月龄APP/PS1转基因AD小鼠的空间学习和记忆能力确实出现显著性下降。
然而早期AD行为学发生改变的结构基础是什么呢?已有研究指出:AD患者认知功能的下降与海马结构萎缩存在一定的正相关性[23]。海马结构萎缩的速率在AD患者疾病的进程中起着决定性的作用[24]。之后多项影像学研究报道双侧海马结构体积在AD患者中比正常人的体积显著缩小,说明AD与海马结构萎缩有明显的关联。海马结构是AD患者脑结构和功能改变的主要脑区之一[7, 9, 25]。但现有实验结果处在定性或半定量水平,没有早期AD患者海马结构的体积改变情况的精确定量研究。本实验采用三维定量研究结果显示:与野生组小鼠相比,10月龄APP/PS1转基因AD小鼠海马结构体积显著减少。结合影像学研究结果,我们认为在AD发病的早期阶段海马结构体积的改变发挥着至关重要的作用。
在海马结构中,主要包括CA1、CA2、CA3、DG 4个亚区,每个亚区对疾病的敏感程度不尽相同。而DG区作为海马结构信息传导通路的门户,CA1执行信息的存储功能,其都在维持海马学习记忆功能方面发挥着重要作用[26]。有研究表明:DG作为海马结构神经信息传入的门路,运用MRI检查发现AD患者的DG区较其他正常对照组显著性的减小[9];也有研究表明CA1区体积的改变对衡量AD疾病的严重程度更敏感[10]。可见海马CA1区和DG在AD发病的早期具有重要意义。我们运用体视学方法精确定量10月龄APP/PS1转基因AD小鼠海马各亚区体积,结果显示:与野生型小鼠相比,10月龄APP/PS1转基因AD小鼠海马CA1和DG区体积存在显著减少。这一结果更进一步证实CA1和DG区的体积改变都参与AD患者早期脑结构和功能改变, 其体积的改变也为进一步探究AD海马微观结构的改变提供真实的形态学数据。
APP/PS1转基因AD小鼠存在海马CA1区和DG的萎缩,提示其内存在微观结构的改变。以往的DTI研究发现AD患者海马结构各区存在FA值的降低,这说明AD患者神经回路出现异常[7]。然在神经信息高速传导中,海马结构内神经回路任一结构的完整性缺一不可,其结构的改变可能是AD症状及海马CA1及DG体积改变的重要原因之一。Schmued等[27]通过卢卡斯快蓝染色分析髓鞘密度的改变情况发现AD患者大脑海马内存在髓鞘的丢失。Desai等[8]发现3xTg-AD小鼠在6月龄时出现海马脱髓鞘和少突胶质细胞标记物的相应减少。这些研究均提示AD早期大脑海马内存在脱髓鞘的改变。本实验运用体视学与电镜技术相结合的方法对10月龄雄性APP/PS1转基因AD小鼠海马CA1区和DG内有髓神经纤维进行准确的三维定量研究,结果显示:与同月龄野生型小鼠相比,10月龄APP/PS1转基因AD小鼠海马CA1和DG内有髓神经纤维的总长度分别较同月龄野生型小鼠减少20.0%、45.9%,但其差异没有统计学意义。而海马CA1和DG内有髓神经纤维的总体积分别显著减小36.0%和42.9%,有髓神经纤维髓鞘总体积分别显著减小45.4%和57.1%。本实验结果提示:与相同月龄野生型小鼠相比,10月龄雄性APP/PS1转基因小鼠海马CA1、DG内有髓纤维的总长度均有不同程度的减少,但是差异没有统计学意义,而有髓神经纤维的总体积以及髓鞘的总体积却显著性的减少,出现有髓神经纤维总长度和总体积及髓鞘总体积改变不一致的原因不清楚,我们猜测可能是因为较多直径较大的有髓神经纤维出现脱髓鞘改变所致,具体原因尚有待进一步研究。本团队前期研究结果发现:10月龄Tg2576转基因AD小鼠仅海马DG内有髓神经纤维的总长度显著减少;而CA1区有髓神经纤维的总长度、CA1和DG内有髓神经纤维的总体积和髓鞘总体积均差异没有统计学意义。我们分析可能:相较APP/PS1双转基因AD小鼠而言,Tg2576单转基因AD小鼠病理改变相对较轻,其丢失的有髓神经纤维不足以引起有髓神经纤维及髓鞘体积的显著性改变。顾丽华[28]通过定量分析5XFAD小鼠模型中海马CA1区轴突比率 (有髓神经纤维轴突直径与纤维直径之间的比值) 发现5XFAD小鼠1月龄即出现了海马CA1区髓鞘的改变,并随着年龄增加而加重。与Tg2576转基因小鼠和APP/PS1转基因小鼠相比,5XFAD有髓神经纤维髓鞘损伤出现的时间更早,且损伤的程度也不一致。结合以上研究结果,我们推测不同表型的各品系转基因AD模型鼠其海马不同亚区内髓鞘改变的程度各不相同。AD的发病进程可能与AD海马内有髓神经纤维及髓鞘的改变息息相关,有髓神经纤维及髓鞘的改变在AD的早期发病中具有重要意义并可能作为AD早期防治的靶点。
综上所述,APP/PS1模型小鼠在10月龄时出现空间学习和记忆能力显著性下降,有髓神经纤维及髓鞘的改变可能是导致其认知功能改变的重要结构基础之一。不同表型的各品系转基因AD模型鼠其海马不同亚区内髓鞘改变的程度各不相同,本实验为以后运用APP/PS1动物模型探讨髓鞘相关研究提供更精确的形态学数据。但要证明有髓神经纤维及髓鞘体积损伤与AD的因果关系,以及其中的分子机制还有待于在今后的实验中进一步阐明。
| [1] | Brookmeyer R, Johnson E, Ziegler-Graham K, et al. Forecasting the global burden of Alzheimer's disease[J]. Alzheimers Dement, 2007, 3(3): 186–191. DOI:10.1016/j.jalz.2007.04.381 |
| [2] | Ihara M, Polvikoski T M, Hall R, et al. Quantification of myelin loss in frontal lobe white matter in vascular dementia, Alzheimer's disease, and dementia with Lewy bodies[J]. Acta Neuropathol, 2010, 119(5): 579–589. DOI:10.1007/s00401-009-0635-8 |
| [3] | Wang L, Guo L, Lu L, et al. Synaptosomal Mitochondrial Dysfunction in 5xFAD Mouse Model of Alzheimer's Disease[J]. PLoS ONE, 2016, 11(3): e0150441. DOI:10.1371/journal.pone.0150441 |
| [4] | Tanzi R E, Bertram L. Twenty years of the Alzheimer's disease amyloid hypothesis: a genetic perspective[J]. Cell, 2005, 120(4): 545–555. DOI:10.1016/j.cell.2005.02.008 |
| [5] | Koppensteiner P, Trinchese F, Fà M, et al. Time-dependent reversal of synaptic plasticity induced by physiological concentrations of oligomeric Aβ42: an early index of Alzheimer's disease[J]. Sci Rep, 2016, 6: 32553. DOI:10.1038/srep32553 |
| [6] | Terry R D, Gonatas N K, Weiss M. Ultrastructural Studies In Alzheimer's Presenile Dementia[J]. Am J Pathol, 1964, 44: 269–297. |
| [7] | Tang X, Qin Y, Wu J, et al. Shape and diffusion tensor imaging based integrative analysis of the hippocampus and the amygdala in Alzheimer's disease[J]. Magn Reson Imaging, 2016, 34(8): 1087–1099. DOI:10.1016/j.mri.2016.05.001 |
| [8] | Desai M K, Sudol K L, Janelsins M C, et al. Triple-transgenic Alzheimer's disease mice exhibit region-specific abnormalities in brain myelination patterns prior to appearance of amyloid and tau pathology[J]. Glia, 2009, 57(1): 54–65. DOI:10.1002/glia.20734 |
| [9] | Melnikova T, Park D, Becker L, et al. Sex-related dimorphism in dentate gyrus atrophy and behavioral phenotypes in an inducible tTa:APPsi transgenic model of Alzheimer's disease[J]. Neurobiol Dis, 2016, 96: 171–185. DOI:10.1016/j.nbd.2016.08.009 |
| [10] | La Joie R, Perrotin A, De La Sayette V, et al. Hippocampal subfield volumetry in mild cognitive impairment, Alzheimer's disease and semantic dementia[J]. Neuroimage Clin, 2013, 3: 155–162. DOI:10.1016/j.nicl.2013.08.007 |
| [11] |
卢伟. 正常老年大鼠和转基因老年痴呆小鼠海马有髓神经纤维改变的研究[D]. 重庆: 重庆医科大学, 2012.
Lu W.The changes of myelinated fibers in the hippocampus of normal aging rats and transgenic mouse models of AD[D]. Chongqing: Chongqing Medical University, 2012. |
| [12] | Bilkei-Gorzo A. Genetic mouse models of brain ageing and Alzheimer's disease[J]. Pharmacol Ther, 2014, 142(2): 244–257. DOI:10.1016/j.pharmthera.2013.12.009 |
| [13] | Allu J A, Sarasa L, Izco M, et al. Outstanding phenotypic differences in the profile of Amyloid-β between Tg2576 and APPswe/PS1dE9 transgenic mouse models of Alzheimer's disease[J]. J Alzheimers Dis, 2016, 53(3): 773–785. DOI:10.3233/JAD-160280 |
| [14] | Vorhees C V, Williams M T. Morris water maze: procedures for assessing spatial and related forms of learning and memory[J]. Nat Protoc, 2006, 1(2): 848–858. DOI:10.1038/nprot.2006.116 |
| [15] | Morris R. Developments of a water-maze procedure for studying spatial learning in the rat[J]. J Neurosci Methods, 1984, 11(1): 47–60. DOI:10.1016/0165-0270(84)90007-4 |
| [16] | Nosten-Bertrand M, Errington M L, Murphy K P, et al. Normal spatial learning despite regional inhibition of LTP in mice lacking Thy-1[J]. Nature, 1996, 379(6568): 826–829. DOI:10.1038/379826a0 |
| [17] | Chao F, Zhang L, Luo Y, et al. Running Exercise Reduces Myelinated Fiber Loss in the Dentate Gyrus of the Hippocampus in APP/PS1 Transgenic Mice[J]. Curr Alzheimer Res, 2015, 12(4): 377–383. DOI:10.2174/1567205012666150325183011 |
| [18] | Zhang W, Yang S, Li C, et al. Stereological investigation of age-related changes of myelinated fibers in the rat cortex[J]. J Neurosci Res, 2009, 87(13): 2872–2880. DOI:10.1002/jnr.22114 |
| [19] |
肖倩, 吕福林, 罗艳敏, 等. 雌激素替代治疗对中老年卵巢切除大鼠海马CA1区有髓神经纤维的影响[J].
第三军医大学学报, 2014, 36(05): 432–436.
Xiao Q, Lyu F L, Luo Y M, et al. Effects of estrogen replacement therapy on myelinated fibers in CA1 of hippocampus in middle-aged ovariectomized rats[J]. J Third Mil Med Univ, 2014, 36(05): 432–436. DOI:10.16016/j.1000-5404.2014.05.015 |
| [20] | Lu W, Yang S, Chen L, et al. Stereological investigation of the age-related changes of the myelinated fibers in the hippocampus of male rats[J]. Anat Rec (Hoboken), 2014, 297(8): 1490–1497. DOI:10.1002/ar.22936 |
| [21] | Xiu Y, Kong X R, Zhang L, et al. The myelinated fiber loss in the corpus callosum of mouse model of schizophrenia induced by MK-801[J]. J Psychiatr Res, 2015, 63: 132–140. DOI:10.1016/j.jpsychires.2015.02.013 |
| [22] |
张蕾. AD早期行为学、Aβ和白质的改变及跑步锻炼能否延缓这些改变进程的探讨[D]. 重庆: 重庆医科大学, 2014.
Zhang L. AD early behavior, A beta and white matter changes and running exercise can delay the process [D]. Chong-qing: Chongqing Medical University, 2014. |
| [23] | Mueller S G, Schuff N, Yaffe K, et al. Hippocampal atrophy patterns in mild cognitive impairment and Alzheimer's disease[J]. Hum Brain Mapp, 2010, 31(9): 1339–1347. DOI:10.1002/hbm.20934 |
| [24] | Frank E, Joly O. Evaluating Alzheimer's disease progression using rate of regional hippocampal atrophy[J]. PLoS ONE, 2013, 8(8): e71354. DOI:10.1371/journal.pone.0071354 |
| [25] |
谢欣, 曹云鹏, 史巍, 等. 阿尔茨海默病海马和齿状回体积的MRI分析[J].
中外医疗, 2009, 28(9): 58–59.
Xie X, Cao Y P, Shi W, et al. MRI analysis of the volume of hippocampus and dentate gyrus in Alzheimer's disease[J]. China Foreign Medical Treatment, 2009, 28(9): 58–59. DOI:10.3969/j.issn.1674-0742.2009.09.047 |
| [26] | Kesner R P, Rolls E T. A computational theory of hippocampal function, and tests of the theory: new developments[J]. Neurosci Biobehav Rev, 2015, 48: 92–147. DOI:10.1016/j.neubiorev.2014.11.009 |
| [27] | Schmued L C, Raymick J, Paule M G, et al. Characterization of myelin pathology in the hippocampal complex of a transgenic mouse model of Alzheimer's disease[J]. Curr Alzheimer Res, 2013, 10(1): 30–37. DOI:10.2174/1567205011310010005 |
| [28] |
顾丽华. 5XFAD小鼠模型中年龄相关性的髓鞘改变[D]. 南京: 东南大学, 2015.
Gu L H. Age-related myelin changes in the 5XFAD mouse model[D]. Nanjing: Southeast University, 2015. |



