肿瘤微环境在肿瘤恶性进展中发挥重要作用[1],纤维粘连蛋白是肿瘤微环境的重要组成部分[2]。纤维粘连蛋白基因Ⅲ型重复序列选择性剪切形成的EDA片段 (fibronectin extra domain A,FN-EDA) 在多种恶性肿瘤特异性表达上调[3-4],促进肿瘤细胞增殖、分化、黏附、迁移,与肿瘤的淋巴管、血管生成密切相关[5-8]。前期研究发现FN-EDA片段在结肠癌中特异性表达上调,在正常结肠、癌旁组织不表达,干扰FN-EDA表达显著促进结肠癌SW480细胞凋亡[5, 9],其具体分子机制尚未阐明。P53抑癌基因是调控细胞凋亡的重要分子,P53功能缺失促进结肠癌发生、发展[10-11],但FN-EDA是否可通过影响P53功能促进结肠癌恶性进展尚少见报道。本研究在前期工作的基础上,探讨FN-EDA通过调控P53功能抑制结肠癌细胞凋亡的机制,进一步阐明其在结肠癌发生、发展中发挥癌基因作用的分子机制。
1 材料与方法 1.1 主要材料与试剂EDA敲低 (EDA-KD) 和对照 (Control) 的结肠癌SW480细胞 (本实验室冻存);RPMI1640培养基 (Hy Clone)、小牛血清 (哈里)、0.25%胰蛋白酶 (HyClone),青链霉素、RIPA蛋白提取试剂盒、BCA蛋白浓度测定试剂盒 (碧云天);细胞凋亡检测试剂盒 (BD),鼠抗人FN-EDA单抗 (#ab6328,Abcam),鼠抗人BAX单抗 (#sc-23959,Santa Cruz),兔抗人P53单抗 (#sc-6243,Santa Cruz),兔抗人Cleaved caspase-3(#9661,cell signal),兔抗人P21(#2947,cell signal),兔抗人p-P53(Ser15)(sc-101762,Santa Cruz),兔抗人p-P53(Ser37)(sc-135633,Santa Cruz),兔抗人p-P53(Ser392)(sc-56173,Santa Cruz),H2A和Tubulin抗体购自Santa Cruz Biotechnology,co-IP试剂盒 (#1007D,Novex),OmniScript RT试剂盒 (Qiagen)。
1.2 细胞模型构建与分组根据GenBank数据库FN-EDA的基因序列和本实验室FN-EDA敲低慢病毒shRNA靶序列 (5′-CCAACTGACCTGAAGTTCA-3′),由上海吉凯基因技术公司合成shRNA匹配序列同义突变的FN-EDA过表达慢病毒 (OE) 和空载病毒 (Vector)。复苏冻存的EDA敲低 (EDA-KD) 和对照 (Control) 的结肠癌SW480细胞,10%小牛血清,1%青链霉素的DMEM培养基37 ℃、5% CO2培养24 h,取对数生长期的细胞接种于6孔板 (2×105个细胞/孔), 12 h后,用2 mL含有6 μg/mL polybrene的新鲜培养基替换原培养基,分别加入FN-EDA过表达慢病毒 (OE) 和空载病毒 (Vector) 悬液,37℃孵育,24 h后FACS检测转染效率和筛选,构建FN-EDA过表达[Control (OE), EDA-KD (OE)]和对照[Control (Vector), EDA-KD (Vector)]结肠癌SW480细胞模型。
1.3 结直肠癌基因芯片获取与数据处理 1.3.1 GEO数据库检索结肠癌基因芯片数据查询截止2015年8月24日GEO (Gene Expression Omnibus) 数据库中结肠癌相关表达芯片,筛选条件:(1) 芯片平台为Affymetrix U133plus 2.0 array;(2) 每个数据集特异针对结直肠癌,排除含有多种肿瘤的数据集;(3) 样本构成为癌与正常组织或癌与癌旁组织;(4) 数据集原始文件能够下载,且能应用于质控和标准化分析;(5) 数据集包含组织病理分期和预后信息,共获取8个数据集 (GSE17538、GSE39582、GSE14333、GSE39084、GSE31595、GSE37892、GSE38832、GSE33113),共1 537例结肠癌基因芯片数据 (表 1)。
| 序列号 | 组织类型 | 癌 | 癌旁 | 总计 | 病理分期 | 预后信息 |
| GSE39582 | 癌和癌旁 | 565 | 19 | 585 | TNM | OS & RFS |
| GSE17538 | 癌 | 232 | 0 | 232 | TNM & GRADE | OS & DFS |
| GSE14333 | 癌 | 290 | 0 | 290 | DUKE | DFS |
| GEE39084 | 癌 | 70 | 0 | 70 | TNM | OS & DFS |
| GSE31595 | 癌 | 37 | 0 | 37 | TNM & GRADE | DFS |
| GSE37892 | 癌 | 130 | 0 | 130 | TNM | DFS |
| GSE38832 | 癌 | 122 | 0 | 122 | TNM | OS & DFS |
| GSE33113 | 癌 | 90 | 0 | 90 | TNM | DFS |
| 合计 | 1 537 | 19 | 1 556 |
1.3.2 基因芯片数据处理
采用R语言 (Version 3.2.0) Bioconductor的Simpleaffy和affyPLM包进行基因芯片质控筛选,根据BioB检出情况,探针组相对标准差 (NUSE)、相对对数表达 (RLE) 和RNA降解情况剔除不合格芯片。合格芯片用RMA算法进行背景矫正、标准化和汇总处理;汇总数据经Combat算法矫正批次效应后用annotate包注释探针组[12]。
1.3.3 FN-EDA mRNA序列与芯片探针组匹配FN-EDA的mRNA序列在NCBI数据库进行BLAST检索,其参考序列 (GenBank Accession No.:X07261,coverage:100%) 与FN1 mRNA探针组212464_s_at匹配,探针组212464_s_at信号强度作为EDA相对表达水平指标。
1.4 流式细胞术检测凋亡取对数生长期Control、EDA-KD、Control (Vector)、EDA-KD (Vector)、Control (OE)、EDA-KD (OE) 结肠癌SW480细胞接种于6孔板,2 mL/孔,细胞浓度2×105/mL,每组3个复孔,细胞贴壁后更换培养基,培养24 h后消化细胞,冷PBS洗涤2次,200 μL细胞标记液 (2 μL Annexin V-APC + 2 μL PI +200 μL Annexin Loading buffer) 冰上孵育15 min,流式细胞仪检测,重复3次。
1.5 Western blot检测蛋白表达取对数生长期Control、EDA-KD、Control (Vector)、EDA-KD (Vector)、Control (OE)、EDA-KD (OE) 组结肠癌SW480细胞按RIPA蛋白提取试剂盒和BCA蛋白浓度测定试剂盒说明书提取蛋白并测定浓度。SDS-PAGE电泳仪120 V恒压3 h分离蛋白,250 mA恒流2.5 h转膜,5%BSA室温封闭2 h,一抗4 ℃摇床孵育过夜,PBST洗3次,每次10 min,二抗室温孵育1 h,PBST洗3次,每次10 min,膜上均匀滴ECL显影液,避光孵育1 min后显影。
1.6 细胞免疫荧光染色观察取对数生长期Control、EDA-KD、Control (OE)、EDA-KD (OE) 结肠癌SW480细胞接种于置入细胞爬片的24孔板,培养48 h,弃培养基,取出细胞爬片,PBS洗3次,4%多聚甲醛4 ℃固定30 min;室温下PBS洗3次,每次5 min,0.1% Triton处理10 min,PBS洗5 min;加山羊血清,室温封闭1 h;加入稀释后两种一抗,4 ℃孵育过夜。室温下,PBS洗3次,每次10 min;加入稀释过的二抗,湿盒中室温反应1 h,PBS洗3次,每次10 min;DAPI染核1 min,PBS洗3次,每次10 min,激光共聚焦显微镜显影。
1.7 荧光定量Real-time PCR检测取对数生长期Control和EDA-KD结肠癌SW480细胞,采用TRIzol法提取总RNA; 采用OmniScript RT试剂盒 (Qiagen) 按说明书合成cDNA[13],梯度稀释的cDNA采用以下列模板进行PCR扩增:P53 (正向序列:5′-CCTCAGCATCTTATCCGAGTGG-3′;反向序列:3′-TGGATGGTGGTACAGTCAGA GC-5′),BAX(正向序列:5′-GTCTTTTTCCGAGTGGCAGC-3′;反向序列:3′-GGAGACAGGGACATCAGTCG-5′),P21 (正向序列:5′-TGCCGAAGTCAGTTCCTTGT-3′;反向序列:3′-CATTA-GCGCATCACAGTCGC-5′),相对表达水平以GAPDH为内参标准化,相对表达水平采用2(-内参标准) 计算。
1.8 蛋白质免疫共沉淀 (co-IP) 检测取对数生长期Control和EDA-KD组结肠癌SW480细胞,按RIPA蛋白提取试剂盒说明书提取蛋白,用100 μL冰上预冷的缓冲液洗涤磁珠,加入抗体结合缓冲液100 μL,将抗体与磁珠旋转孵育30 min,用200 μL缓冲液洗涤磁珠3次,每次5 min,将细胞裂解液与偶联抗体的磁珠在室温下旋转孵育1 h,用200 μL缓冲液洗涤磁珠3次,每次5 min,20 μL洗脱缓冲液洗涤磁珠1次,取上清。
1.9 统计学方法采用Graphpad 5.0软件进行统计分析,x±s表示计量数据,组间均数比较采用t检验,相关系数采用Pearson相关分析, 基因富集分析采用GSEA (Broadinsititute) 软件,检验水准:α=0.05。
2 结果 2.1 结肠癌FN-EDA表达与P53下游凋亡信号基因转录水平相关转录组学分析FN-EDA表达与凋亡通路基因表达相关性,采用Stepminer算法[14]将GEO数据库获取的1 162个Ⅱ/Ⅲ期结肠癌组织基因芯片样本根据EDA表达水平分为EDA低表达组 (EDA_low: 7.012 7~11.720 0;n=562) 和EDA高表达组 (EDA_high: 11.722 2~14.258 5;n=600),基因表达富集分析[15]显示,EDA_low组凋亡信号通路基因富集上调 (KEGG_APOPTOSIS,P < 0.05,图 1),提示FN-EDA表达与凋亡信号通路分子RNA水平负相关,影响P53-BAX凋亡信号可能是FN-EDA调控结肠癌细胞凋亡的分子机制。
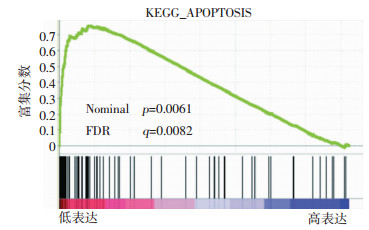
|
| 图 1 EDA_low组与EDA_high组结直肠癌基因芯片FN-EDA表达富集分析 |
2.2 FN-EDA缺失促进结肠癌SW480细胞P53-BAX信号通路激活
敲低结肠癌SW480细胞FN-EDA表达后,流式细胞术检测结果显示EDA-KD组凋亡增加[(2.77±0.4)% vs (0.87±0.3)%,P < 0.05,图 2],RT-PCR检测结果显示,EDA-KD组BAX、P21 RNA水平上调 (P < 0.05,图 3A),组间P53 RNA水平差异无统计学意义 (P > 0.05)。Western blot检测结果显示,与Control组相比,EDA-KD组P53、BAX、P21、Cleaved Caspase-3表达上调 (图 3B)。上述结果提示FN-EDA缺失促进P53-BAX凋亡信号通路激活,FN-EDA可能通过非转录依赖方式调控P53蛋白水平。
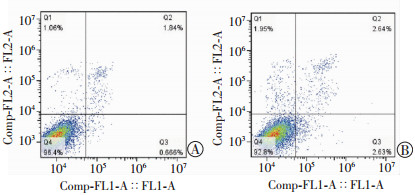
|
| A:Control组;B:EDA-KD组 图 2 流式细胞术检测各组结肠癌SW480细胞凋亡变化 |
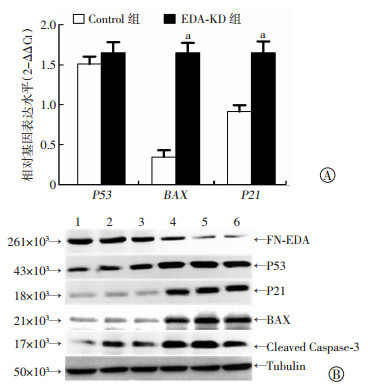
|
| A:RT-PCR检测各组P53、BAX、P21 RNA水平a:P < 0.05,与Control组比较;1-3:Control组;4-6: EDA-KD组B:Western blot检测各组凋亡相关蛋白表达 图 3 RT-PCR与Western blot检测各组P53-BAX通路相关基因RNA水平和蛋白表达 |
2.3 敲低FN-EDA促进P53蛋白Ser15、Ser37、Ser392磷酸化和核转位
磷酸化和核转位是调控P53转录活性的主要方式,其中Ser15、Ser37和Ser392磷酸化激活P53转录活性,促进P53入核。Western blot检测结果显示EDA-KD组P53蛋白和Ser-15、Ser-37和Ser-392磷酸化水平较Control组高 (图 4A)。细胞核浆分离后,Western blot检测结果显示EDA-KD组细胞核内P53表达较Control组高 (图 4B)。免疫荧光染色结果显示EDA-KD组P53蛋白核内转运增加 (图 5)。上述结果提示FN-EDA缺失可能通过调控P53磷酸化修饰和核转位,激活其转录活性,发挥促凋亡作用。

|
| 1-3:Control组;4-6:EDA-KD组 图 4 Western blot检测各组结肠癌SW480细胞P53蛋白磷酸化修饰 (A) 和核转位 (B) |
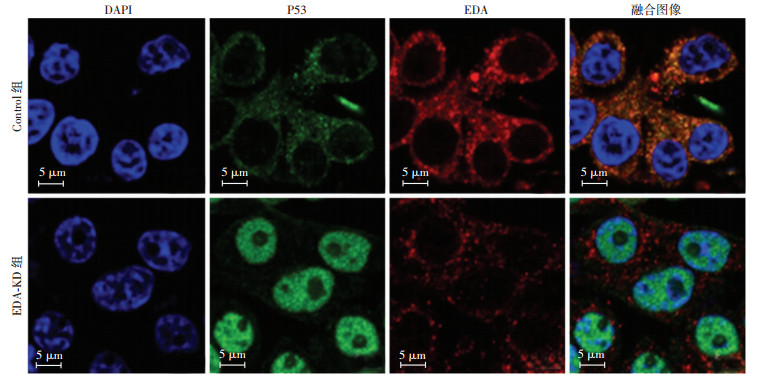
|
| 图 5 激光共聚焦显微镜观察各组P53亚细胞分布情况 |
2.4 过表达FN-EDA抑制EDA-KD组结肠癌SW480细胞凋亡
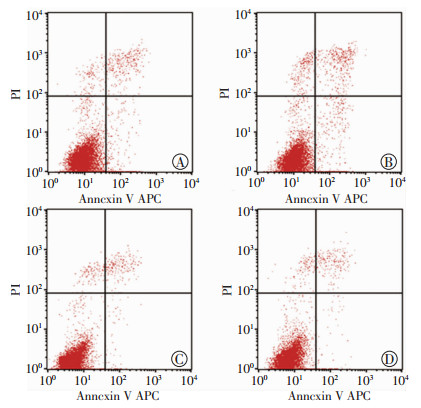
为验证FN-EDA调控凋亡效应,用FN-EDA过表达慢病毒 (OE) 转染EDA-KD结肠癌SW480细胞,恢复FN-EDA表达。过表达FN-EDA后,流式细胞术检测结果显示EDA-KD (OE) 组凋亡率降低[EDA-KD (Vector):(3.7±0.3)%;EDA-KD (OE) 组:(1.1±0.3)%;P < 0.05,图 6]。
|
| A:Control (Vector) 组;B:EDA-KD (Vector) 组;C:Control (OE) 组;D:EDA-KD (OE) 组 图 6 流式细胞术检测过表达FN-EDA后各组细胞凋亡情况 |
2.5 过表达FN-EDA抑制P53-BAX信号激活和P53磷酸化
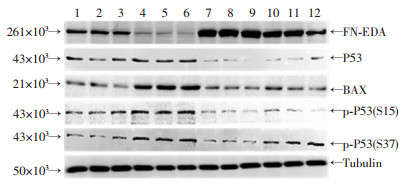
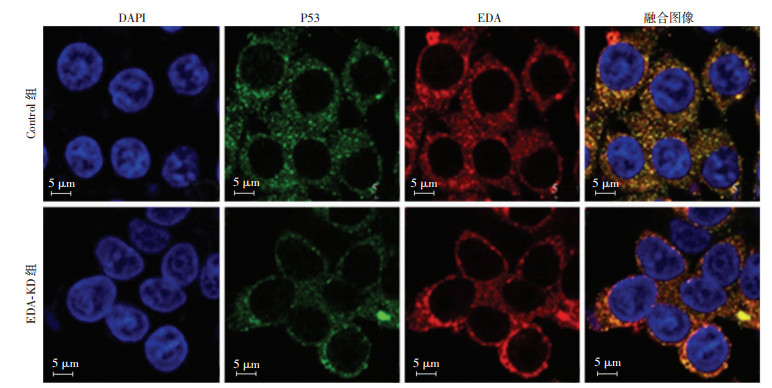
EDA-KD组和Control组结肠癌SW480细胞过表达FN-EDA后,Western blot检测结果显示EDA-KD (OE) 组BAX和P53蛋白表达下调,P53蛋白Ser15、Ser37磷酸化水平下调 (图 7)。免疫荧光染色结果显示,过表达FN-EDA后细胞P53核转位减少 (图 8)。结果表明,过表达FN-EDA抑制P53-BAX凋亡信号通路激活和P53蛋白磷酸化修饰和核转位。
|
| 1-3: Contro组;4-6:EDA-KD组;7-9:Control (OE组);10-12:EDA-KD (OE) 组 图 7 Western blot检测各组结肠癌SW480细胞P53、BAX表达和P53磷酸化水平 |
|
| 图 8 激光共聚焦显微镜观察各组P53亚细胞分布情况 |
2.6 FN-EDA与P53具有相互作用
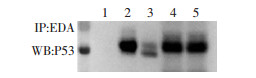
蛋白质间相互作用是影响P53转录后修饰的重要因素,免疫荧光检测结果提示FN-EDA有相同的亚细胞分布,进一步蛋白质免疫共沉淀检测结果显示P53和FN-EDA具有相互作用 (图 9),推测可能是FN-EDA与P53相互作用,影响P53降解和磷酸化修饰,干扰其核转位调控凋亡作用。
|
| 1:IgG;2:Control组共沉淀蛋白;3:EDA-KD组共沉淀蛋白;4:Control组总蛋白;5:EDA-KD组总蛋白 图 9 蛋白质免疫共沉淀检测P53和FN-EDA的相互作用 |
3 讨论
肿瘤细胞分泌的纤维粘连蛋白、胶原蛋白和蛋白多糖等生物大分子分构成的网状结构是肿瘤微环境的重要组成部分,参与调控肿瘤细胞增殖、转移、分化和死亡[4, 16],纤维粘连蛋白基因Ⅲ型重复序列选择性剪切形成的FN-EDA在多种恶性肿瘤组织、快速增殖细胞、创伤修复组织中表达上调[17]。FN-EDA通过诱导结肠癌细胞发生上皮间质转化促进结肠癌转移[5],还和整合素α9共同介导结肠癌淋巴管生成[6, 9]。此外文献[17-18]报道沉默FN-EDA能够促进结肠癌SW480细胞凋亡,增强鼻咽癌CNE-2细胞放疗敏感性。研究表明SAPK-JNK通路是FN-EDA调控细胞凋亡的途径之一[19],P53作为凋亡信号的重要组织者, 其在FN-EDA介导的结肠癌凋亡中的作用尚少见报道。本研究通过转录组分析发现FN-EDA低表达组凋亡信号通路基因富集上调,FN-EDA表达与受P53转录调控的BAX、P21基因表达负相关,影响P53作用可能是FN-EDA调控凋亡的分子机制之一。
P53抑癌基因调控促凋亡因子和细胞周期因子转录发挥抗癌作用,也能够直接激活BAX[20]和BAK[21]发挥促凋亡效应,P53表达缺失或突变会导致肿瘤恶性增生。射线、化学毒物、缺氧和氧自由基等多种刺激能够影响P53稳定性和转录活性[10],P53和MDM2结合位点Ser15、Ser20、Thr18磷酸化抑制MDM2介导的P53蛋白泛素化降解[22],Ser37、Ser46和Ser392磷酸化激活P53~P21和P53-BAX信号通路发挥调控增殖、凋亡作用[23-26]。
我们发现FN-EDA敲低的结肠癌SW480细胞中P53蛋白表达上调,而且P53的Ser-15、Ser-37和Ser-392磷酸化水平上调。然而,RT-PCR检测结果显示Control组和EDA-KD组P53 RNA水平差异无统计学意义,可能Ser15磷酸化抑制MDM2介导的P53泛素化降解;P53蛋白Ser-37和Ser-392磷酸化能够进其核转位增强转录活性,实验结果也证实FN-EDA敲低的结肠癌SW480细胞P53核转位增加,下游受P53转录调控的P21和BAX表达上调,激活P53-BAX信号通路,促进结肠癌SW480细胞凋亡。co-IP检测发现FN-EDA和P53具有直接相互作用,其可能影响了P53磷酸化修饰位点的暴露,抑制P53的激活和核转位,但具体分子机制还需进一步探索。Rochette等[26]发现SW480细胞P53基因发生G273A、C309T双突变,突变的P53基因仍具有与野生型相似功能,能够持续激活P21和凋亡信号通路,提示在P53突变肿瘤细胞中FN-EDA可能也具有调控凋亡效应。
综上所述,本研究探讨FN-EDA对结肠癌细胞凋亡的影响,发现FN-EDA过表达抑制结肠癌细胞凋亡,而FN-EDA缺失可促进结肠癌细胞凋亡,其可能是通过调控P53降解、磷酸化和核转位,影响P53介导的细胞周期阻滞和细胞凋亡发挥作用,我们认为随着对FN-EDA功能研究的不断深入,FN-EDA有望成为结直肠癌治疗的新靶点。
| [1] | Hanahan D, W R. Hallmarks of Cancer: The Next Generation[J]. Cell, 2011, 144(5): 646–674. DOI:10.1016/j.cell.2011.02.013 |
| [2] | Allen M, Louise Jones J. Jekyll and Hyde: the role of the microenvironment on the progression of cancer[J]. J Pathol, 2011, 223(2): 163–177. DOI:10.1002/path.2803 |
| [3] | Zheng M, Jones D M, Horzempa C, et al. The first type Ⅲ domain of fibronectin is associated with the expression of cytokines within the lung tumor microenvironment[J]. J Cancer, 2011, 2: 478–483. DOI:10.7150/jca.2.478 |
| [4] | Wang K, Seo B R, Fischbach C, et al. Fibronectin mechanobiology regulates tumorigenesis[J]. Cel Mol Bioeng, 2016, 9(1): 1–11. DOI:10.1007/s12195-015-0417-4 |
| [5] | Ou J, Peng Y, Deng J, et al. Endothelial cell-derived fibronectin extra domain A promotes colorectal cancer metastasis via inducing epithelial-mesenchymal transition[J]. Carcinogenesis, 2014, 35(7): 1661–1670. DOI:10.1093/carcin/bgu090 |
| [6] | Ou J, Li J, Pan F, et al. Endostatin suppresses colorectal tumor-induced lymphangiogenesis by inhibiting expression of fibronectin extra domain a and integrin α9[J]. J Cell Biochem, 2011, 112(8): 2106–2114. DOI:10.1002/jcb.23130 |
| [7] | Yaqoob U, Cao S, Shergill U, et al. Neuropilin-1 stimulates tumor growth by increasing fibronectin fibril assembly in the tumor microenvironment[J]. Cancer Res, 2012, 72(16): 4047–4059. DOI:10.1158/0008-5472.CAN-11-3907 |
| [8] | Cho C, Kelsh-Lasher R, Ambesi A, et al. Cryptic activity within the Type Ⅲ1 domain of fibronectin regulates tissue inflammation and angiogenesis[J]. Curr Top Pept Protein Res, 2015(16): 37–47. DOI:10.1158/0008-5472.CAN-11-3907 |
| [9] | Ou J, Deng J, Wei X, et al. Fibronectin extra domain A (EDA) sustains CD133+/CD44+ subpopulation of colorectal cancer cells[J]. Stem Cell Res, 2013, 11(2): 820–833. DOI:10.1016/j.scr.2013.05.009 |
| [10] | Millau J, Bastien N, Drouin R. p53 transcriptional activities: A general overview and some thoughts[J]. Mut Res, 2009, 681(2-3): 118–133. DOI:10.1016/j.mrrev.2008.06.002 |
| [11] | Powell E, Piwnica-Worms D, Piwnica-Worms H. Contribution of p53 to metastasis[J]. Cancer Discov, 2014, 4(4): 405–414. DOI:10.1158/2159-8290.CD-13-0136 |
| [12] |
山高, 欧剑虹, 肖凯. R语言与Bioconductor生物信息学应用[M]. 天津: 科技翻译出版有限公司, 2014: 108-150.
San G, Ou J H, Xiao K. R language and Bioconductor bioinformatics application[M]. Tianjin: Science & Technology Translation & Publishing Corp, 2014: 108-150. |
| [13] | Stanley S A, Gagner J E, Damanpour S, et al. Radio-wave heating of iron oxide nanoparticles can regulate plasma glucose in mice[J]. Science, 2012, 336(6081): 604–608. DOI:10.1126/science.1216753 |
| [14] | Sahoo D, Dill D L, Tibshirani R, et al. Extracting binary signals from microarray time-course data[J]. Nucleic Acids Res, 2007, 35(11): 3705–3712. DOI:10.1093/nar/gkm284 |
| [15] | Subramanian A, Tamayo P, Mootha V K, et al. Gene set enrichment analysis: A knowledge-based approach for interpreting genome-wide expression profiles[J]. PNAS, 2005, 102(43): 15545–15550. DOI:10.1073/pnas.0506580102 |
| [16] | Klein R M, Zheng M, Ambesi A, et al. Stimulation of extracellular matrix remodeling by the first type Ⅲ repeat in fibronectin[J]. J Cell Sci, 2003, 22(116): 4663–4674. DOI:10.1242/jcs.00778 |
| [17] |
耿培亮, 欧娟娟, 萨日娜, 等. 纤维粘连蛋白EDA片段调控结肠癌SW480细胞的增殖、凋亡[J].
第三军医大学学报, 2011, 33(9): 920–923.
P L, Ou J J, Sa R N, et al. Fibronectin EDA domain regulates proliferation and apoptosis of colorectal cancer SW480 cells[J]. J Third Mil Med Univ, 2011, 33(9): 920–923. DOI:10.16016/j.1000-5404.2011.09.027 |
| [18] | Ou J, Pan F, Geng P, et al. Silencing fibronectin extra domain A enhances radiosensitivity in nasopharyngeal carcinomas involving an FAK/Akt/JNK pathway[J]. Int J Radiat Oncol Biol Phys, 2012, 82(4): e685–e691. DOI:10.1016/j.ijrobp.2011.09.040 |
| [19] | Je C, T K, L B, et al. Direct activation of Bax by p53 mediates mitochondrial membrane permeabilization and apoptosis[J]. Science, 2004, 303(5660): 1010–1014. DOI:10.1126/science.1092734 |
| [20] | Leu J I, Dumont P, Hafey M, et al. Mitochondrial p53 activates Bak and causes disruption of a Bak-Mcl1 complex[J]. Nat Cell Biol, 2004, 6(5): 443–450. DOI:10.1038/ncb1123 |
| [21] | Lopez-Borges S, Lazo P A. The human vaccinia-related kinase 1 (VRK1) phosphorylates threonine-18 within the mdm-2 binding site of the p53 tumour suppressor protein[J]. Oncogene, 2000, 19(32): 3656–3664. DOI:10.1038/sj.onc.1203709 |
| [22] | Sun P, Yoshizuka N, New L, et al. PRAK is essential for ras-induced senescence and tumor suppression[J]. Cell, 2007, 128(2): 295–308. DOI:10.1016/j.cell.2006.11.050 |
| [23] | Hou X, Liu J E, Liu W, et al. A new role of NUAK1: directly phosphorylating p53 and regulating cell proliferation[J]. Oncogene, 2011, 30(26): 2933–2942. DOI:10.1038/onc.2011.19 |
| [24] | Zeng P Y, Berger S L. LKB1 Is Recruited to the p21/WAF1 Promoter by p53 to Mediate Transcriptional Activation[J]. Cancer Research, 2006, 66(22): 10701–10708. DOI:10.1158/0008-5472.CAN-06-0999 |
| [25] | Iotsova V, Stehelin D. Down-regulation of fibronectin gene expression by the p53 tumor suppressor protein[J]. Cell Growth Differ, 1996, 7(5): 629–634. |
| [26] | Rochette P J, Bastien N, Lavoie J, et al. SW480, a p53 double-mutant cell line retains proficiency for some p53 functions[J]. J Mol Biol, 2005, 352(1): 44–57. DOI:10.1016/j.jmb.2005.06.033 |



