2.400016 重庆,重庆医科大学附属第一医院, 肾脏内科
2. Department of Nephrology, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
炎症与脂代谢紊乱是动脉粥样硬化病变的两个重要病理特征[1]。最新研究表明,炎症与脂代谢紊乱之间存在着显著的交互作用[2]。我们在前期研究中发现:胆固醇敏感器-固醇调节原件结合蛋白裂解激活蛋白(sterol regulatory element binding protein cleavage activating protein,SCAP)功能失调能够促进巨噬细胞中白介素(Interleukin,IL)-1β等促炎症细胞因子的表达与成熟,但具体机制尚不清楚[3]。P2X7受体(P2X7 Receptor,P2X7R)活化介导的炎症小体激活是前体IL-1β(pro-IL-1β)酶解为具有促炎症生物学活性的成熟IL-1β的关键步骤[4]。本研究将采用SCAP基因转染技术模拟SCAP功能失调状态,进一步探讨SCAP功能失调促进巨噬细胞中IL-1β成熟的分子机制。
1 材料与方法 1.1 THP-1源性巨噬细胞的培养THP-1细胞(ATCC,USA)培养与诱导分化参照文献描述进行[3]。实验培养基为含0.2%牛血清白蛋白(BSA,Sigma)的RPMI1640,即无血清培养基(Serum free medium,SF培养基)。P2X7R激动剂-三磷酸腺苷ATP和P2X7R阻断剂-A438079均购自Sigma公司(USA)。
1.2 SCAP过表达质粒的转染将THP-1源性巨噬细胞分为空质粒对照组(pcDNA3.1,由重庆医科大学感染性疾病分子生物学实验室提供)与过表达SCAP组(SCAP过表达质粒pCMV-scap,ATCC,USA)。质粒转染严格按照Effectene Transfection Reagent转染试剂盒(Qiagen,German)说明书进行。16 h后换SF培养基继续孵育8 h。ATP是P2X7R的天然激动剂,A438079是P2X7R的拮抗剂。按照不同组别分别加入新鲜SF培养基、ATP(5 mmol/L)或A438079 (100 μmol/L)处理60 min。
1.3 总RNA提取及Real-time PCR采用TRIzol法分别提取不同处理组THP-1源性巨噬细胞的总RNA。RNA浓度测定与标准化、逆转录及Real-time PCR方法均与我们前期研究报道相同[3]。本研究检测SCAP、P2X7R、NLRP3、pro-IL-1β、pro-caspases1及β-actin mRNA表达水平。SCAP基因上游引物序列:5′-GGGAACTTCTGGCAGAATGAC-3′,下游引物序列:5′-CTGGTGGATGGTCCCAATG-3′,片段大小169 bp;P2X7R基因上游引物序列:5′-GAGGTGAAAGAGGAGATC-3′,下游引物序列:5′-GCGGGTGGGATACTCGG-3′,片段大小168 bp;NLRP3基因上游引物序列:5′-GTCATCGGGTGGAGTCACTGTC-3′,下游引物序列:5′-AAGTGAGGTGGCTGTTCACCAA-3′,片段大小138 bp;pro-IL-1β基因上游引物序列:5′-TCCAGGGACAGGATATGGAG-3′,下游引物序列:5′-TCTTTCAACACGCAGGACAG-3′,片段大小133 bp;caspase-1基因上游引物序列:5′-CCAGACTCCTCTCTGAGGTT-3′,下游引物序列:5′-TGATTGGAGTAGTGTGTGTTCC-3′,片段大小161 bp;β-actin基因上游引物序列:5′-CCTGGCACCCAGCACAAT-3′,下游引物序列:5′-GCCGATCCACACGGAGTACT-3′,片段大小170 bp。反应条件:50 ℃ 120 s,95 ℃ 300 s,然后95 ℃ 20 s,55 ℃ 20 s,共40个循环,最后95 ℃ 60 s,55 ℃ 60 s。PCR结果以Ct值反映初始模板量,采用比较Ct值法(2-△△Ct)计算目的基因表达水平。
1.4 Western blot检测蛋白表达经不同处理后的THP-1源性巨噬细胞,分别提取各组细胞总蛋白或超滤离心法收集上清,测定并标准化蛋白浓度后,取等量各组蛋白样品行Western blot法检测蛋白表达。具体方法与我们前期研究报道相同[3]。抗SCAP单克隆抗体IgG-9D5及其他一抗均购于Santa Cruz(USA)或Abcam(UK)公司。
1.5 流式细胞术检测THP-1源性巨噬细胞表面P2X7R的表达收集不同处理后的THP-1源性巨噬细胞至1.5 mL EP管,PBS洗涤细胞两次,5%多聚甲醛室温固定细胞30 min,10%山羊血清室温封闭1 h,然后兔抗人P2X7R一抗4 ℃孵育过夜,次日PBST洗涤细胞3次,PE-texas Red A标记的抗兔二抗室温孵育30 min,PBST洗涤细胞3次,双蒸水重悬细胞,转入流式管,BD LSR Fortessa流式细胞仪(USA)检测细胞表面P2X7R荧光强度,软件分析并绘图。
1.6 统计学分析统计学分析由SPSS 13.0统计软件处理。数据用x±s表示,多个不同处理组各项定量指标的比较采用单因素方差分析,两个不同处理组间比较采用两样本均数t检验。
2 结果 2.1 过表达SCAP对THP-1源性巨噬细胞pro-IL-1β及P2X7R-NLRP3通路相关蛋白mRNA表达的影响过表达SCAP组pro-IL-1β mRNA水平显著上调(P < 0.01),同时伴随P2X7R mRNA表达水平显著上升(P < 0.01),NLRP3与pro-caspase-1 mRNA表达增高不明显(P >0.05)(图 1)。
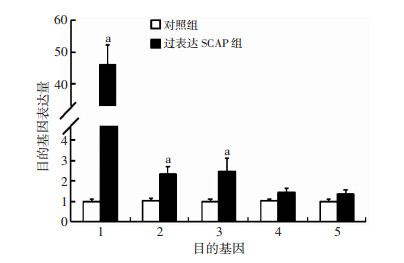
|
| 1:SCAP;2:pro-IL-1β;3:P2X7R;4:NLRP3;5:pro-caspase-1 a:P < 0.01,与对照组比较 图 1 RT-PCR法检测过表达SCAP对THP-1源性巨噬细胞SCAP、pro-IL-1β、P2X7R、NLRP3、pro-caspase-1 mRNA表达水平的影响(n=4,x±s) |
2.2 过表达SCAP对THP-1源性巨噬细胞表面P2X7R表达的影响
流式细胞术检测THP-1源性巨噬细胞表面P2X7R的表达情况,蓝色代表阴性对照染色组(双蒸水替代一抗),黄色代表P2X7R特异性一抗染色空质粒对照组,黑色代表P2X7R特异性一抗染色过表达SCAP组。结果显示:过表达SCAP组THP-1源性巨噬细胞表面P2X7R蛋白荧光强度显著高于空质粒对照组(波形右移)(图 2)。
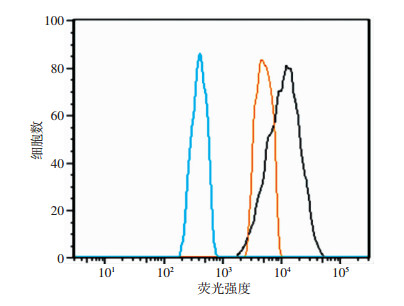
|
| 蓝色示空白对照组;黄色示空质粒组;黑色示过表达SCAP组 图 2 流式细胞术检测过表达SCAP对THP-1源性巨噬细胞表面P2X7R表达的影响 |
2.3 P2X7R激动剂ATP与抑制剂A438079对THP-1源性巨噬细胞SCAP、pro-IL-1β mRNA表达的影响
P2X7R激动剂ATP与抑制剂A438079对THP-1源性巨噬细胞SCAP mRNA表达无影响(P >0.05)。P2X7R激动剂ATP在过表达SCAP组细胞能够显著促进THP-1源性巨噬细胞pro-IL-1β mRNA表达(P < 0.01),P2X7R抑制剂A438079能够抵消ATP的上述促进作用(P < 0.01,图 3)。
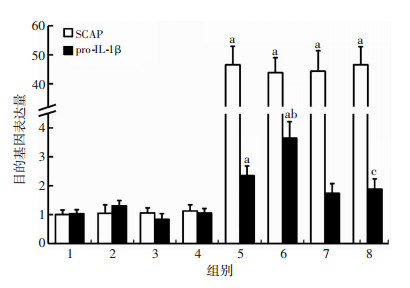
|
| 1:对照组;2:ATP组;3:A438079组;4:ATP+A438079组;5:过表达SCAP组;6:过表达SCAP+ATP组;7:过表达SCAP+A438079组8:过表达SCAP+ATP+A438079组 a:P < 0.01,与对照组比较;b:P < 0.05,与过表达SCAP组比较 c:P < 0.01,与过表达SCAP+ATP组比较 图 3 RT-PCR检测P2X7R激动剂与抑制剂对THP-1源性巨噬细胞SCAP、pro-IL-1β mRNA表达水平的影响(n=4,x±s) |
2.4 P2X7R激动剂ATP与抑制剂A438079对THP-1源性巨噬细胞SCAP、pro-IL-1β以及上清中成熟IL-1β蛋白水平的影响
P2X7R激动剂ATP与抑制剂A438079对THP-1源性巨噬细胞SCAP蛋白表达无影响(P >0.05)。ATP处理后THP-1源性巨噬细胞中pro-IL-1β蛋白水平呈减少趋势,但差异尚无统计学显著性(P >0.05)。过表达SCAP显著上调THP-1源性巨噬细胞中pro-IL-1β蛋白表达(P < 0.01),但这一上调趋势被ATP明显减弱(P < 0.05)。P2X7R抑制剂A438079能够有效抵消ATP对细胞内pro-IL-1β蛋白水平的影响(P < 0.05)。同时,ATP显著增加上清中成熟IL-1β蛋白水平(P < 0.05),且这一作用在过表达SCAP组细胞更为明显(P < 0.01),而P2X7R抑制剂A438079将有效抵消ATP的上述作用(P < 0.01,图 4、5)。
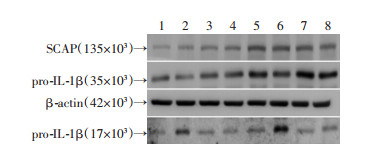
|
| 1:对照组;2:ATP组;3:A438079组;4:ATP+A438079组;5:过表达SCAP组;6:过表达SCAP+ATP组;7:过表达SCAP+A438079组;8:过表达SCAP+ATP+A438079组 图 4 Western blot法检测P2X7R激动剂与抑制剂对THP-1源性巨噬细胞SCAP、pro-IL-1β、IL-1β蛋白水平的影响 |
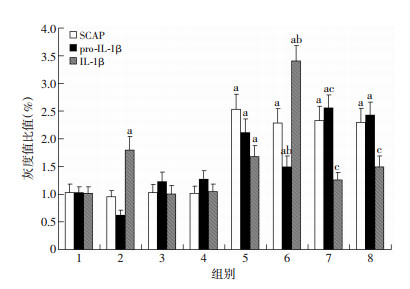
|
| 1:对照组;2:ATP组;3:A438079组;4:ATP+A438079组;5:过表达SCAP组;6:过表达SCAP+ATP组;7:过表达SCAP+A438079组;8:过表达SCAP+ATP+A438079组a:P < 0.05,与对照组比较;b:P < 0.05,与过表达SCAP组比较;c:P < 0.05,与过表达SCAP+ATP组比较 图 5 定量分析P2X7R激动剂与抑制剂对THP-1源性巨噬细胞SCAP、pro-IL-1β、IL-1β蛋白水平的影响(n=4,x±s) |
2.5 P2X7R激动剂ATP与抑制剂A438079对THP-1源性巨噬细胞P2X7R、NLRP3及pro-caspase-1 mRNA表达的影响
过表达SCAP显著上调THP-1源性巨噬细胞P2X7R mRNA表达(P < 0.01),这一上调作用不受其激动剂ATP及抑制剂A438079影响(P >0.05)。同时,与对照组相比,P2X7R激动剂ATP明显增加NLRP3和pro-caspase-1 mRNA表达(P < 0.05),这一作用在过表达SCAP组细胞更加显著(P < 0.01),而P2X7R抑制剂A438079有效抵消了ATP上述作用(图 6)。
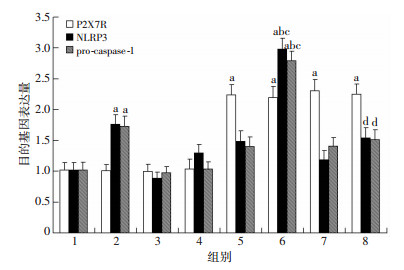
|
| 1:对照组;2:ATP组;3:A438079组;4:ATP+A438079组;5:过表达SCAP组;6:过表达SCAP+ATP组;7:过表达SCAP+A438079组;8:过表达SCAP+ATP+A438079组a:P < 0.05,与对照组比较;b:P < 0.01,与ATP组比较;c:P < 0.01,与过表达SCAP组比较;d:P < 0.01,与过表达SCAP+ATP组比较 图 6 Real Time-PCR法检测P2X7R激动剂与抑制剂对THP-1源性巨噬细胞P2X7R、NLRP3、pro-caspase-1 mRNA表达水平的影响 |
2.6 P2X7R激动剂ATP与抑制剂A438079对THP-1源性巨噬细胞P2X7R、NLRP3以及caspase-1(p20) 蛋白水平的影响
过表达SCAP显著增加THP-1源性巨噬细胞P2X7R蛋白水平(P < 0.01),这一上调作用不受P2X7R激动剂ATP及抑制剂A438079影响(P >0.05)。同时,P2X7R激动剂ATP明显增加NLRP3和caspase-1蛋白表达(P < 0.05),这一作用在过表达SCAP组细胞更加显著(P < 0.01),而P2X7R抑制剂A438079有效抵消了ATP的上述作用(图 7、8)。
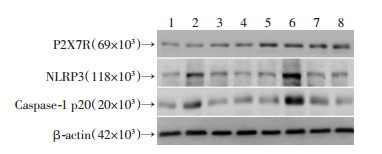
|
| 1:对照组;2:ATP组;3:A438079组;4:ATP+A438079组;5:过表达SCAP组;6:过表达SCAP+ATP组;7:过表达SCAP+A438079组;8:过表达SCAP+ATP+A438079组 图 7 Western blot法检测P2X7R激动剂与抑制剂对THP-1源性巨噬细胞P2X7R、NLRP3、caspase-1 (p20) 表达水平的影响 |
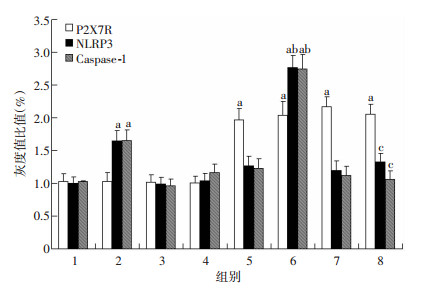
|
| 1:对照组;2:ATP组;3:A438079组;4:ATP+A438079组;5:过表达SCAP组;6:过表达SCAP+ATP组;7:过表达SCAP+A438079组;8:过表达SCAP+ATP+A438079组a:P < 0.05,与对照组比较;b:P < 0.01,与ATP组比较;c:P < 0.01,与过表达SCAP+ATP组比较 图 8 定量分析P2X7R激动剂与抑制剂对THP-1源性巨噬细胞P2X7R、NLRP3、caspase-1(P20) 表达量的影响(n=4,x±s) |
3 讨论
巨噬细胞作为人体内最重要的炎症反应细胞以及泡沫细胞的主要来源细胞,参与动脉粥样硬化病变发生、发展的全过程[5]。SCAP是细胞内的胆固醇敏感器,生理状态下能通过感受细胞内胆固醇水平,负反馈调控细胞内羟甲基戊二酸单酰辅酶还原酶(HMGCoAR)以及细胞表面低密度脂蛋白受体(low density lipoprotein receptor,LDLR)所介导的细胞内源性胆固醇合成与血浆中天然LDL摄入,维持细胞内胆固醇稳态平衡[6]。然而,近年研究发现,胆固醇敏感器SCAP在动脉粥样硬化、慢性肾脏病等多种病理状态下存在功能失调,成为导致血管平滑肌细胞、肾小球系膜细胞、巨噬细胞等外周细胞脂质异常蓄积的关键机制[7-10]。我们之前发现,SCAP不仅是巨噬细胞胆固醇稳态的关键调控分子,同时还参与调节促炎症细胞因子IL-1β的表达与分泌,介导炎症反应[3]。
IL-1β是介导致动脉粥样硬化血管壁炎症微环境的重要因素[11]。少量的IL-1β可通过正反馈效应促进其前体pro-IL-1β的合成,但pro-IL-1β没有促炎症活性,需要依赖于细胞内P2X7R-NLRP3炎性体-caspase-1信号通路调控的信号系统的加工,成为成熟的IL-1β,分泌到细胞外,诱导机体炎症反应[4]。本研究通过基因转染技术在THP-1源性巨噬细胞中模拟SCAP功能失调状态,进一步探讨SCAP功能失调对巨噬细胞IL-1β表达及成熟的影响。结果与前期报道一致,SCAP过表达上调THP-1源性巨噬细胞内pro-IL-1β的表达,但更有意义的是,SCAP过表达显著促进THP-1源性巨噬细胞P2X7R基因转录,同时细胞表面P2X7R蛋白水平明显增加。这一结果提示:P2X7R可能是SCAP调节巨噬细胞炎症反应的重要环节。P2X7R为P2X家族中的一员,是以三磷酸腺苷(ATP)为配体的非选择性阳离子门控通道[12]。近年来,有研究报道:长时间或高浓度激动剂激活后P2X7R具有形成膜孔的特性,可诱导IL-1β、IL-18等炎症因子的释放[13-14]。NLRP3炎性体是位于细胞内的一种蛋白质复合体,组成包括Nod样受体蛋白3(nod-like receptor protein 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和半胱氨酸天冬氨酸蛋白酶-1 (cysteine-requiring aspartate protease-1,caspase-1),是活化caspase-1的分子平台,调控IL-1β等的成熟和分泌[15],诱导和参与炎症反应。NLRP3炎性体的激活需要的两个信号:第一个信号,肿瘤坏死因子受体、IL-1受体等被激活后,活化NF-κB信号通路,生成pro-IL-1β;第二个信号,钾离子外流、活性氧或溶酶体破裂活化ASC,ASC以特定的形式将NLRP3和caspase-1连接起来,促使形成具有酶活性的caspase-1(p20),将无活性的pro-IL-1β剪切为成熟的IL-1β,诱导机体炎症反应[16]。
在NLRP3炎性体激活的第二个信号中,P2X7R的天然激动剂ATP与细胞表面的P2X7R结合诱导钾离子外流是NLRP3炎性体激活的主要机制[17]。因此,在下一步实验中,我们应用P2X7R激动剂ATP与抑制剂A438079分别激动与抑制P2X7R活性。结果证实:在过表达SCAP基础上激动P2X7R能够进一步促进pro-IL-1β基因转录,并有效促进细胞内pro-IL-1β剪切成熟并向细胞外分泌,抑制P2X7R活性并不影响过表达SCAP致pro-IL-1β表达上调的作用,但将减少成熟IL-1β的生成与分泌。这一结果表明P2X7R及其下游NLRP3炎性体活性改变可能是SCAP功能失调促进IL-1β成熟与分泌的关键机制。
通过分别激动与抑制P2X7R活性,我们进一步发现过表达SCAP并不影响NLRP3及caspase-1表达,但在过表达SCAP基础上充分激动P2X7R将显著上调NLRP3及caspase-1基因及蛋白水平,上述变化能够被P2X7R抑制剂A438079抵消。这一重要结果表明:SCAP功能失调可能通过上调P2X7R表达增强其功能,从而激活NLRP3炎性体,为pro-IL-1β剪切成熟及分泌提供充分条件。本研究发现胆固醇敏感器SCAP功能失调不仅上调巨噬细胞中pro-IL-β表达,而且能够通过上调细胞表面P2X7R表达激活NLRP3炎性体,促进IL-1β的成熟。
| [1] | SHAPIRO M D, FAZIO S. From lipids to inflammation: new approaches to reducing atherosclerotic risk[J]. Circ Res, 2016, 118(4): 732–749. DOI:10.1161/CIRCRESAHA.115.306471 |
| [2] | KIDANI Y, ELSAESSER H, HOCK M B, et al. Sterol regulatory element-binding proteins are essential for the metabolic programming of effector T cells and adaptive immunity[J]. Nat Immunol, 2013, 14(5): 489–499. DOI:10.1038/ni.2570 |
| [3] |
欧阳南, 杜晓刚, 陈利群, 等. 胆固醇敏感器SCAP功能失调对THP-1源性巨噬细胞炎症因子表达的影响[J].
第三军医大学学报, 2016, 38(5): 449–455.
OUYANG N, DU X G, CHEN L Q, et al. Dysfunction of sterol regulatory element-binding protein cleavage-activating protein promotes expression of inflammatory cytokines in THP-1 macrophages[J]. J Third Mil Med Univ, 2016, 38(5): 449–455. DOI:10.16016/j.1000-5404.201509029 |
| [4] | KARMAKAR M, KATSNELSON M A, DUBYAK G R, et al. Neutrophil P2X7 receptors mediate NLRP3 inflammasome-dependent IL-1β secretion in response to ATP[J]. Nat Commun, 2016, 7: 10555. DOI:10.1038/ncomms10555 |
| [5] | BOBRYSHEV Y V, IVANOVA E A, CHISTIAKOV D A, et al. Macrophages and their role in atherosclerosis: pathophysiology and transcriptome analysis[J]. BioMed Research International, 2016, 2016: 1–13. DOI:10.1155/2016/9582430 |
| [6] | YE J, DEBOSE-BOYD R A. Regulation of cholesterol and fatty acid synthesis[J]. Cold Spring Harbor Perspectives in Biology, 2011, 3(7): a004754–a004754. DOI:10.1101/cshperspect.a004754 |
| [7] | CHEN Y, KU H, ZHAO L, et al. Inflammatory stress induces statin resistance by disrupting 3-hydroxy-3-methylglutaryl-CoA reductase feedback regulation[J]. Arterioscler Thromb Vasc Biol, 2014, 34(2): 365–376. DOI:10.1161/ATVBAHA.113.301301 |
| [8] | ZHONG S, ZHAO L, LI Q, et al. Inflammatory stress exacerbated mesangial foam cell formation and renal injury via disrupting cellular cholesterol homeostasis[J]. Inflammation, 2014, 38(3): 959–971. DOI:10.1007/s10753-014-0058-0 |
| [9] | CHEN Y, ZHAO L, LI Q, et al. Inflammatory stress reduces the effectiveness of statins in the kidney by disrupting HMGCoA reductase feedback regulation[J]. Nephrol Dial Transplant, 2014, 29(10): 1864–1878. DOI:10.1093/ndt/gfu203 |
| [10] | ZHOU C, LEI H, CHEN Y, et al. Enhanced SCAP glycosylation by inflammation induces macrophage foam cell formation[J]. PLoS ONE, 2013, 8(10): e75650. DOI:10.1371/journal.pone.0075650 |
| [11] | JANOUDI A, SHAMOUN F E, KALAVAKUNTA J K, et al. Cholesterol crystal induced arterial inflammation and destabilization of atherosclerotic plaque[J]. Eur Heart J, 2016, 37(25): 1959–1967. DOI:10.1093/eurheartj/ehv653 |
| [12] | HOWARTH A R, CONWAY B R, BAILEY M A. Vascular and inflammatory actions of P2X receptors in renal injury[J]. Auton Neurosci, 2015, 191: 135–140. DOI:10.1016/j.autneu.2015.05.001 |
| [13] | COTRINA M L, NEDERGAARD M. Physiological and pathological functions of P2X7 receptor in the spinal cord[J]. Purinergic Signal, 2009, 5(2): 223–232. DOI:10.1007/s11302-009-9138-2 |
| [14] | KANG M J, JO S G, KIM D J, et al. NLRP3 inflammasome mediates interleukin-1β production in immune cells in response to Acinetobacter baumannii and contributes to pulmonary inflammation in mice[J]. Immunology, 2017, 150(4): 495–505. DOI:10.1111/imm.12704 |
| [15] | SHAW P J, MCDERMOTT M F, KANNEGANTI T D. Inflammasomes and autoimmunity[J]. Trends Mol Med, 2011, 17(2): 57–64. DOI:10.1016/j.molmed.2010.11.001 |
| [16] | LORENZ G, DARISIPUDI M N, ANDERS H J. Canonical and non-canonical effects of the NLRP3 inflammasome in kidney inflammation and fibrosis[J]. Nephrol Dial Transplant, 2014, 29(1): 41–48. DOI:10.1093/ndt/gft332 |
| [17] | RODRIGUES R J, TOMÉ A R, CUNHA R A. ATP as a multi-target danger signal in the brain[J]. Front Neurosci, 2015, 9: 148. DOI:10.3389/fnins.2015.00148 |



