我国是肝癌大国,以肝细胞癌最常见。根据最新的癌症统计资料,我国肝癌患病率居世界首位,肝癌致死率在我国居于癌症死因的第2位[1]。目前肝癌的主要治疗方法以肝切除和肝移植为主,辅以放、化疗,但是治疗后复发转移率高,预后差的问题仍然亟待解决。近年来,越来越多的研究表明神经支配在癌症的发生、发展过程中起着重要的调控作用[2]。肝脏受迷走神经的支配,迷走神经释放的乙酰胆碱等神经递质通过特异性结合相应的受体使其活化,进而发挥作用。毒蕈碱型胆碱能受体M3(muscarinic cholinergic receptors 3, ChRM3) 在前列腺癌、胃癌、肺癌等肿瘤的发生、发展中起着重要的作用[3-5]。课题组之前的研究已证实乙酰胆碱刺激对肝癌细胞的增殖在短期内 (96 h) 没有影响,即胆碱能受体活化不能促进肝癌细胞的增殖[6]。因此,本研究旨在证实肝癌细胞中ChRM3的存在,以及其活化后对肝癌细胞迁移和侵袭能力的影响,并探讨其中可能的分子机制,以期为肝癌的临床治疗提供新的靶点和理论依据。
1 材料与方法 1.1 主要试剂和仪器氯贝胆碱 (Beth) 和达菲那新 (UK88525,美国Sigma公司);ChRM3兔多克隆抗体 (Bioworld公司);兔抗人N-Cadherin多抗、兔抗人Vimentin多抗和兔抗人GAPDH多抗 (Bioworld公司);小鼠抗人E-Cadherin多抗 (美国Abcam公司);兔抗人Akt多抗和兔抗人p-Akt多抗 (美国CST公司);辣根过氧化酶HRP标记的山羊抗小鼠或山羊抗兔IgG (中杉金桥生物技术公司);BCA蛋白定量试剂盒 (康为世纪公司);Transwell小室 (美国Millipore公司);Matrigel基质胶 (美国BD公司);DMEM培养基 (美国Gibco公司);胎牛血清 (美国Invitrogen公司);Lipofectamine 2000TM(美国Invitrogen公司);干扰质粒shRNA (GenePharma公司)。蛋白质凝胶电泳和成像系统 (美国Bio-Rad公司);荧光显微镜和流式细胞仪 (美国Themo Fisher公司)。
1.2 细胞培养人肝癌细胞株HepG2和SMMC-7721购自美国ATCC细胞库,以DMEM细胞培养液 (含10%胎牛血清) 进行培养。细胞孵箱内温度为37 ℃、CO2浓度为5%。细胞对数生长期换液,每2天换1次液。
1.3 Transwell实验检测细胞迁移和侵袭能力侵袭实验前,在Transwell小室上室底部铺入30 μL Matrigel基质胶,置于细胞孵箱中5 h。迁移和侵袭实验以下步骤相同。将不同分组的细胞经相应的激动剂氯贝胆碱 (10 μmol/L) 和阻滞剂达非那新 (10 μmol/L) 处理48 h后,将含有6×104个细胞的DMEM细胞悬液200 μL加入Transwell小室上室中,下室加入800 μL含10%胎牛血清DMEM,并于小室中加入激动剂和阻滞剂,调整浓度与预处理时一致。置于细胞培养箱中。迁移实验24 h和侵袭实验48 h后取出小室,多聚甲醛中固定30 min,结晶紫中染色3 min并充分擦除小室内面的细胞。将小室倒置于×100显微镜下,每个小室随机选取5个视野观察拍照,计算细胞数目均值并统计分析。实验重复3次。
1.4 shRNA质粒转染转染前24 h在6孔板内种植适量HepG2细胞,待细胞融合度达到30%~50%时进行转染。将shRNA质粒和Lipofectamine 2000TM预混30 min (两者的配置参照说明书),然后按照GenePharma公司质粒转染步骤进行操作,转染后6 h更换含有血清的DMEM培养液,继续培养至48 h。收获细胞,采用流式细胞仪进行3次检测分选及培养,经过25 d的筛选和培养后,使转染效率达到80%以上,得到相对稳定的ChRM3沉默的HepG2细胞株,并采用Western blot检测干扰效率。
1.5 Western blot检测提取各组细胞的总蛋白,用BCA蛋白定量试剂盒测定蛋白浓度,并将各蛋白样品浓度调成一致。各组取等量蛋白样品进行凝胶电泳 (10%SDS-PAGE),采用湿转法恒流电转至NC膜上,5%脱脂牛奶封闭2 h,一抗孵育4 ℃过夜 (稀释比例:ChRM3兔多克隆抗体1 :1 000,N-Cadherin 1 :1 000,Vimentin 1 :1 000,E-Cadherin 1 :1 000,Akt 1 :1 000,p-Akt 1 :1 000,GAPDH 1 :1 000)。HRP标记山羊抗小鼠或山羊抗兔二抗1 :5 000进行稀释并室温孵育2 h,ECL显色液进行显色,在凝胶成像系统中显影。GAPDH为内参,实验重复3次。计算各组蛋白条带灰度值进行半定量分析 (相对表达量=目的条带灰度值/对应GAPDH灰度值)。
1.6 统计学分析数据采用x±s表示,采用SPSS 22.0统计软件行t检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 肝癌细胞株HepG2和SMMC-7721中有ChRM3受体的表达Western blot检测结果显示:HepG2和SMMC-7721细胞中均有ChRM3受体的表达 (图 1),目的条带位于相对分子质量66×103,与抗体说明书上一致,表明该条带即为ChRM3蛋白条带。
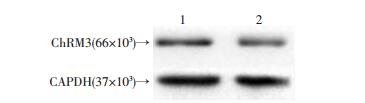
|
| 1:HepG2细胞;2:SMMC-7721细胞 图 1 Western blot检测HepG2和SMMC-7721细胞中ChRM3受体的表达 |
2.2 阻滞ChRM3对肝癌细胞迁移和侵袭能力的影响
两种细胞各分为空白对照组、Beth组、Beth+ UK88525组、UK88525组4组进行Transwell实验。结果显示:Beth组中用M受体的特异性激动剂氯贝胆碱 (Beth) 刺激两种肝癌细胞,相比于空白对照组,均能促进肝癌细胞的侵袭和迁移 (P < 0.05)。Beth+UK88525组中预先加入ChRM3受体特异性阻滞剂达非那新 (UK88525) 处理2 h,再加入Beth处理48 h;检测结果发现:阻滞ChRM3受体能够明显抑制Beth的促肝癌细胞迁移和侵袭作用 (P < 0.05)。而单独加入UK88525组,与空白组对比没有明显的差异 (P>0.05,图 2~5,表 1)。表明ChRM3受体活化能够促进肝癌细胞的迁移和侵袭。
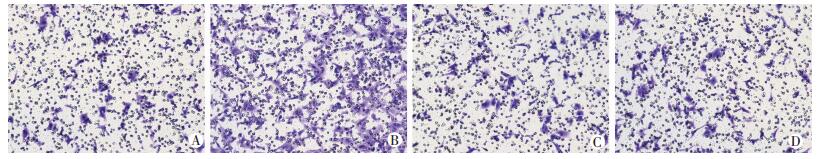
|
| A:空白对照组;B:Beth组;C:Beth+UK88525组;D:UK88525组 图 2 Transwell实验检测阻滞ChRM3受体后肝癌HepG2细胞迁移能力的变化 (×100) |
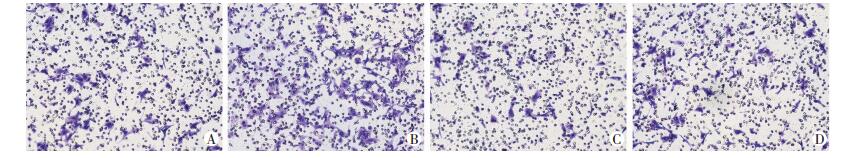
|
| A:空白对照组;B:Beth组;C:Beth+UK88525组;D:UK88525组 图 3 Transwell实验检测阻滞ChRM3受体后肝癌HepG2细胞侵袭能力的变化 (×100) |
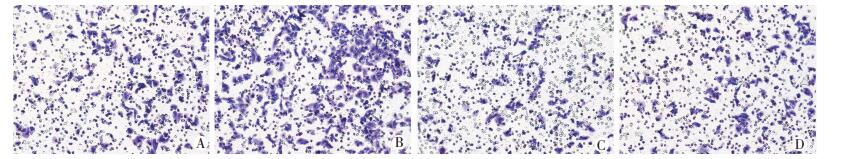
|
| A:空白对照组;B:Beth组;C:Beth+UK88525组;D:UK88525组 图 4 Transwell实验检测阻滞ChRM3受体后肝癌SMMC-7721细胞迁移能力的变化 (×100) |
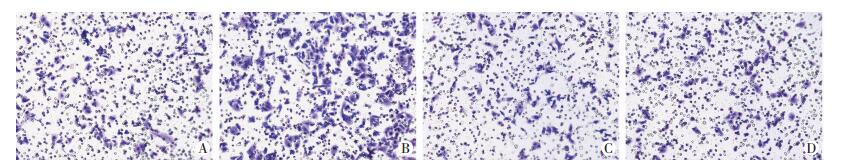
|
| A:空白对照组;B:Beth组;C:Beth+UK88525组;D:UK88525组 图 5 Transwell实验检测阻滞ChRM3受体后肝癌SMMC-7721细胞侵袭能力的变化 (×100) |
| 组别 | HepG2细胞 | SMMC-7721细胞 | |||
| 迁移 | 侵袭 | 迁移 | 侵袭 | ||
| 空白对照组 | 47.00±2.65 | 45.33±4.58 | 64.00±2.77 | 55.33±5.57 | |
| Beth组 | 132.33±7.21a | 124.67±17.24a | 184.33±8.72a | 175.00±9.03a | |
| Beth+UK88525组 | 54.33±7.81b | 50.00±16.09b | 68.00±4.21b | 68.00±9.84b | |
| UK88525组 | 43.67±6.25 | 43.33±8.89 | 69.67±11.05 | 50.67±5.57 | |
| a:P < 0.05,与对照组比较;b:P < 0.05,与Beth组比较 | |||||
2.3 shRNA沉默HepG2细胞中ChRM3的鉴定
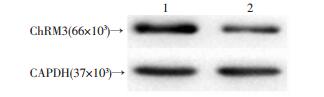
Western blot检测结果显示:ChRM3蛋白在HepG2细胞和shChRM3 HepG2细胞中的相对表达量分别为1.162±0.042、0.520±0.040,差异有统计学意义 (P < 0.05,图 6)。
|
| 1:HepG2细胞;2:shChRM3 HepG2细胞 图 6 Western blot检测质粒转染后的HepG2细胞中ChRM3受体的表达 |
2.4 沉默ChRM3对肝癌细胞迁移和侵袭能力的影响
采用shRNA干扰技术沉默ChRM3受体,通过流式细胞仪筛选出ChRM3沉默的HepG2细胞 (shChRM3)。分为空白对照组、Beth组、Beth+shChRM3组、shChRM3组进行Transwell实验。结果显示:相对于Beth组,干扰ChRM3受体后,能够明显抑制Beth对HepG2细胞迁移和侵袭的促进作用 (P < 0.05,图 7~8,表 2)。进一步证明ChRM3受体在肝癌细胞迁移和侵袭中起到了重要的作用。
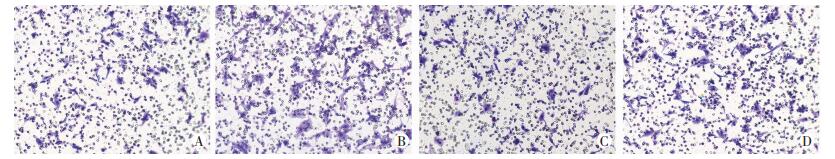
|
| A:空白对照组;B:Beth组;C:Beth+shChRM3组;D:shChRM3组 图 7 Transwell实验检测敲除ChRM3受体后肝癌HepG2细胞迁移能力的变化 (×100) |

|
| A:空白对照组;B:Beth组;C:Beth+shChRM3组;D:shChRM3组 图 8 Transwell实验检测敲除ChRM3受体后肝癌HepG2细胞侵袭能力的变化 (×100) |
| 组别 | 迁移 | 侵袭 |
| 空白对照组 | 65.00±11.67 | 63.67±8.08 |
| Beth组 | 185.67±5.03a | 175.33±7.01a |
| Beth+UK88525组 | 64.33±7.21b | 70.33±6.12b |
| UK88525组 | 59.67±4.58 | 55.00±9.85 |
| a:P < 0.05,与空白对照组比较;b:P < 0.05,与Beth组比较 | ||
2.5 ChRM3受体调控肝癌细胞侵袭、迁移的分子机制
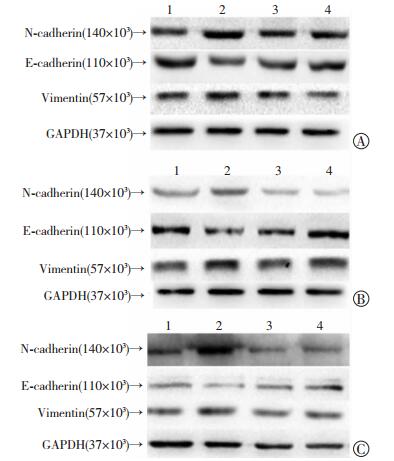
为了探讨ChRM3受体调控肝癌细胞侵袭、迁移的分子机制,分别在药理水平和基因水平抑制ChRM3受体,用Western blot实验检测EMT标志蛋白和PI3K/Akt的表达。结果显示:在两种细胞中,相对于Beth组,UK88525阻滞预处理组能够明显下调间质样细胞标志蛋白N-Cadherin和Vimentin,上调上皮样细胞标志蛋白E-Cadherin (图 9A、B)。在HepG2细胞中,敲除ChRM3受体的Beth+shChRM3组也显示相同的上皮-间质转化 (epithelial-to-mesenchymal transition,EMT) 标志蛋白表达变化 (图 9C)。下游信号通路的检测结果发现:Beth组能够明显上调p-Akt的表达,而阻滞ChRM3受体后能够抑制Akt的磷酸化 (图 10)。对上述各组目的蛋白进行半定量分析,发现Beth组相比于空白对照组、UK88525阻滞预处理组和Beth+shChRM3组差异均有统计学意义 (P < 0.05)。
|
| A:HepG2细胞1:空白对照组;2:Beth组;3:Beth+UK88525组;4:UK88525组;B:SMMC-7721细胞1:空白对照组;2:Beth组;3:Beth+UK88525组;4:UK88525组;C:HepG2细胞1:空白对照组;2:Beth组;3:Beth+shChRM3组;4:shChRM3组 图 9 Western blot检测阻滞ChRM3受体后肝癌细胞EMT标志蛋白的表达 |

|
| A:HepG2细胞1:空白对照组;2:Beth组;3:Beth+UK88525组;4:UK88525组;B:SMMC-7721细胞1:空白对照组;2:Beth组;3:Beth+UK88525组;4:UK88525组;C:HepG2细胞1:空白对照组;2:Beth组;3:Beth+shChRM3组;4:shChRM3组 图 10 Western blot检测阻滞ChRM3受体后肝癌细胞Akt信号通路的表达变化 |
3 讨论
毒蕈碱型胆碱能受体是G蛋白偶联受体家族成员之一,共有5个亚型 (M1~M5)。其中ChRM3在多种肿瘤组织均有表达,并与多种信号通路相关联,在肿瘤的增殖、侵袭、转移等方面起到重要的作用。ChRM3的活化能够激活下游的第二信使,通过调控不同的信号通路而调节细胞的多种功能[7]。近年的研究发现:在前列腺癌发生和远处转移过程中,胆碱能受体的激活起到了重要的促进作用[3]。在结肠癌和胆管癌中,ChRM3活化均能够促进结肠癌或胆管癌细胞的侵袭和转移[8-9]。并且敲除该受体或者抑制该受体的活化能够在小鼠结肠癌的起始和进展阶段抑制肿瘤生长和转移。但是在肝细胞癌中,ChRM3活化对肝癌侵袭、转移影响的研究仍比较少,尚待进一步研究。
本研究结果显示:在HepG2和SMMC-7721两种肝癌细胞中均有ChRM3受体的表达。经Beth (10 μmol/L) 处理后,两种肝癌细胞的迁移和侵袭能力明显提高,并且EMT标志蛋白N-Cadherin和Vimentin上调,E-Cadherin下调,即促进了EMT过程。但是在预处理加入ChRM3特异性阻滞剂达菲那新 (10 μmol/L) 后,能够明显抑制Beth诱导的肝癌细胞的迁移、侵袭作用,并且抑制EMT。同时,通过干扰质粒沉默HepG2细胞中ChRM3受体后,实验结果与药物阻滞该受体的结果是一致的。进一步证明了ChRM3受体活化通过促进EMT而促进肝癌细胞的迁移、侵袭能力。另外,实验结果发现,阻滞ChRM3受体能够降低p-Akt的磷酸化水平,即ChRM3受体与下游的PI3K/Akt信号通路密切相关。PI3K/Akt信号通路在肿瘤细胞的增殖、凋亡、分化、侵袭转移等方面起着重要的调控作用[10]。Akt的激活能够使一系列的底物磷酸化,进而调节细胞的生理状态,包括细胞周期、增殖、分化、凋亡、代谢、迁移等[11-12]。而这些功能的改变会导致EMT。目前PI3K/Akt信号通路调控EMT的机制引起广泛的关注和研究,旨在以此方向作为转移性肿瘤的预防和治疗的潜在靶点[13]。另外,已有研究发现在小鼠胃癌进程中,采用手术切除胃部迷走神经分支、药物阻滞和基因敲除ChRM3受体均能抑制小鼠胃癌的发生和发展[14],证实了迷走神经通过ChRM3受体介导的信号通路促进胃癌的进程。这与本研究的结果是一致的。结合本研究的结果,可以推断迷走神经释放的乙酰胆碱等神经递质能够与肝癌细胞上的ChRM3特异性结合,使该受体活化。活化的ChRM3受体能够激活下游的PI3K/Akt信号通路,诱导肝癌细胞发生EMT,进而促进肝癌细胞的迁移和侵袭。
综上所述,ChRM3在肝癌的侵袭、转移中起着重要的促进作用,这为肝癌的临床治疗策略提供了新的方向,但是ChRM3受体能否作为肝癌的治疗靶点及其下游的具体分子机制仍有待进一步探索。
| [1] | Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | Ondicova K, Mravec B. Role of nervous system in cancer aetiopathogenesis[J]. Lancet Oncol, 2010, 11(6): 596–601. DOI:10.1016/S1470-2045(09)70337-7 |
| [3] | Magnon C, Hall S J, Lin J, et al. Autonomic nerve development contributes to prostate cancer progression[J]. Science, 2013, 341(6142): 1236361. DOI:10.1126/science.1236361 |
| [4] | Wang L, Zhi X, Zhang Q, et al. Muscarinic receptor M3 mediates cell proliferation induced by acetylcholine and contributes to apoptosis in gastric cancer[J]. Tumour Biol, 2016, 37(2): 2105–2117. DOI:10.1007/s13277-015-4011-0 |
| [5] | Xu R, Shang C, Zhao J, et al. Activation of M3 muscarinic receptor by acetylcholine promotes non-small cell lung cancer cell proliferation and invasion via EGFR/PI3K/AKT pathway[J]. Tumour Biol, 2015, 36(6): 4091–4100. DOI:10.1007/s13277-014-2911-z |
| [6] |
吴黎雳. 迷走神经调控对肝癌侵袭转移的影响及其相关机制研究[D]. 重庆: 第三军医大学, 2015.
Wu L L. Effect and mechanisms of vagus nerve on invasion and migration of hepatocellular carcinoma[D]. Chongqing:Third Military Medical University, 2015. |
| [7] | Spindel E R. Muscarinic receptor agonists and antagonists: effects on cancer[J]. Handb Exp Pharmacol, 2012(208): 451–468. DOI:10.1007/978-3-642-23274-9_19 |
| [8] | Raufman J P, Samimi R, Shah N, et al. Genetic ablation of M3 muscarinic receptors attenuates murine colon epithelial cell proliferation and neoplasia[J]. Cancer Res, 2008, 68(10): 3573–3578. DOI:10.1158/0008-5472.can-07-6810 |
| [9] | Feng Y J, Zhang B Y, Yao R Y, et al. Muscarinic acetylcholine receptor M3 in proliferation and perineural invasion of cholangiocarcinoma cells[J]. HBPD INT, 2012, 11(4): 418–423. DOI:10.1016/s1499-3872(12)60201-x |
| [10] | Mundi P S, Sachdev J, McCourt C, et al. AKT in cancer: new molecular insights and advances in drug development[J]. Br J Clin Pharmacol, 2016, 82(4): 943–956. DOI:10.1111/bcp.13021 |
| [11] | Bakin A V, Tomlinson A K, Bhowmick N A, et al. Phosphatidylinositol 3-kinase function is required for transforming growth factor beta-mediated epithelial to mesenchymal transition and cell migration[J]. J Biol Chem, 2000, 275(47): 36803–36810. DOI:10.1074/jbc.M005912200 |
| [12] | Xu Q, Ma J, Lei J, et al. α-Mangostin suppresses the viability and epithelial-mesenchymal transition of pancreatic cancer cells by downregulating the PI3K/Akt pathway[J]. Biomed Res Int, 2014, 2014: 546353. DOI:10.1155/2014/546353 |
| [13] | Xu W, Yang Z, Lu N. A new role for the PI3K/Akt signaling pathway in the epithelial-mesenchymal transition[J]. Cell Adh Migr, 2015, 9(4): 317–324. DOI:10.1080/19336918.2015.1016686 |
| [14] | Zhao C M, Hayakawa Y, Kodama Y, et al. Denervation suppresses gastric tumorigenesis[J]. Sci Transl Med, 2014, 6(250): 250ra115. DOI:10.1126/scitranslmed.3009569 |



