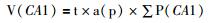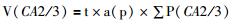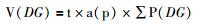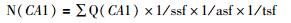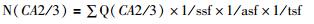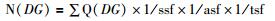阿尔茨海默病 (Alzheimer’s disease,AD) 是一种伴随认知记忆功能下降的神经退行性疾病,是痴呆的常见类型之一。其主要病理特点包括大脑皮层及海马细胞外大量不溶性淀粉样蛋白 (beta-amyloid, Aβ) 的沉积和神经元胞体内Tau蛋白过度磷酸化导致的神经原纤维缠结[1]。既往研究显示:AD大脑内除了存在Aβ淀粉样斑块沉积和神经原纤维缠结的典型病理改变外,还存在胆碱能系统的紊乱[2]。胆碱能神经元在中枢神经系统分布广泛,如基底前脑、大脑皮层和海马[3-4]。海马是空间学习和记忆相关的重要结构区域,在AD中极易受到损伤[5]。既往研究显示:AD晚期海马及大脑皮质内胆碱能纤维长度及胆碱乙酰转移酶 (choline acetyltransferase, ChAT)、乙酰胆碱酯酶 (acetylcholinesterase, AChE) 等胆碱能标志物活性显著下降[2, 6]。然而,DeKosky等[7]发现轻度认知障碍 (mild cognitive impairment, MCI) 患者和早期AD患者海马内ChAT的活性显著升高,但是大脑顶叶、颞叶等区域ChAT的活性却无显著改变。这提示海马内胆碱能系统可能较早受到损伤,且海马内ChAT等胆碱能标志物的活性在AD早期呈现代偿性增加。胆碱能标志物活性的改变与胆碱能神经元的受损程度密切相关,Perez等[8]发现APP/PS1转基因AD小鼠大脑海马内胆碱能神经元2~3月龄就已出现炎性膨胀。那么,AD早期海马胆碱能神经元除了存在形态结构的改变外,是否还存在数量的改变,目前尚不清楚。APP/PS1转基因AD小鼠能模拟AD患者胆碱能系统的改变和认知记忆能力障碍等特征性改变[9-10],因此,本研究选用10月龄雌性APP/PS1双转基因AD小鼠和同月龄、同窝生雌性野生型小鼠作为研究对象,运用现代体视学方法定量研究早期APP/PS1双转基因AD小鼠海马内胆碱能神经元数量的改变情况,为寻找AD早期认知记忆能力下降可能的机制提供理论依据。
1 材料与方法 1.1 实验动物10月龄雌性APP/PS1双转基因AD小鼠 (APP/PS1组) 及同月龄、同窝生野生型雌性小鼠 (Wild-type组) 各12只,饲养于重庆医科大学动物实验中心,饲养环境为SPF级[环境温度 (22±2)℃,湿度55%左右,每日光照12 h]。实验过程中所有操作遵循重庆医科大学的实验动物使用相关伦理要求。
1.2 Morris水迷宫测试空间学习和记忆能力采用Morris水迷宫测试实验小鼠空间学习和记忆能力[11]。Morris水迷宫圆桶直径为0.9 m,高0.5 m,圆桶等分为4个象限,设置4个入水点,将平台随机放置于1个象限中间。由于实验小鼠为黑色或灰色,圆桶内的水用奶粉染成乳白色,水温保持在 (21±1)℃,实验过程中尽量减少实验人员对小鼠的干扰。测试时间为连续7 d。前6 d为定位航行实验,每天每个入水点均需测试1次,随机选择入水点的顺序,测试前将小鼠放置在平台上15 s,使其熟悉周围的环境,然后将小鼠从入水点面朝池壁轻轻地放入水中,记录每只小鼠60 s内寻找平台的时间 (即逃避潜伏期),如果60 s内小鼠未找到平台,则再将小鼠放置于平台上停留15 s,最后将小鼠放置在干净温暖的环境中休息,给予食物和水补充能量,等待下一个入水点的测试。第7天为空间探索实验:定位航行测试结束24 h后进行空间探索测试。撤平台,选择离平台所在象限最远的两个入水点进行测试,记录测试小鼠在平台所在象限游泳的时间以及穿越平台位置的次数。
1.3 标本取材及固定Morris水迷宫测试后,选取APP/PS1组及Wild-type组小鼠各7只。1%戊巴比妥钠 (0.004 mL/g) 经腹腔注射麻醉小鼠,依次灌注生理盐水、4%多聚甲醛后取出大脑,沿纵轴将大脑分成左右半球,用4%多聚甲醛浸泡固定。每只小鼠随机抽取一侧大脑半球依次进入梯度蔗糖水中脱水,然后于低温冷冻切片机中做50 μm连续组织切片。在前5张含有海马组织的切片中随机抽取1张,此后每隔4张抽1张,每只动物平均抽取11张含有海马组织的切片。抽样后,用PBS缓冲液清洗组织切片3次×5 min,然后用75%乙醇缓冲液清洗3次×5 min,清洗完成后用75%乙醇缓冲液浸泡,-20 ℃冰箱保存。
1.4 免疫组织化学染色 1.4.1 胆碱能神经元的免疫组织化学染色从5组切片中随机抽取1组进行胆碱能神经元免疫组织化学染色。切片入PBS溶液中平衡后,0.3% Triton X-100/0.1% Tween-20溶液 (以下所用漂洗试剂均为此溶液) 漂洗2 h;过氧化物酶抑制剂浸泡15 min;漂洗3次×15 min后,枸橼酸盐溶液水浴 (90~100 ℃) 修复30 min;冷却后漂洗3次×15 min;血清封闭液 (5%山羊血清工作液+2%胎牛血清,PBS溶液配制)37 ℃水浴2 h;冷却至室温后,孵育一抗 (英国Abcam公司, ab68984),一抗稀释浓度为1 :1 000,4 ℃冰箱孵育48 h;37 ℃水浴箱中复温2 h后漂洗4次×15 min,然后入山羊抗兔IgG工作液,37 ℃孵育2 h;漂洗4次×15 min,滴加辣根过氧化物酶标记物,37 ℃孵育3 h;漂洗4次×15 min,PBS溶平衡3次×5 min后进行DAB显色 (避光配制DAB显色液,冰上显色2~3 min,自来水终止);贴片晾干后苏木精复染,饱和磷酸氢二钠溶液返蓝,常规梯度脱水,透明,中性树胶封片。
1.4.2 Aβ免疫组织化学染色从剩余的4组切片中随机抽取1组进行Aβ免疫组织化学染色。具体步骤参照胆碱能神经元免疫组织化学染色的方法,其中,修复选用70%的甲酸修复20 min,血清封闭后,孵育一抗 (英国Abcam公司, ab11132),一抗稀释浓度为1 :400,4 ℃冰箱过夜。复温漂洗后入山羊抗小鼠ⅠgG工作液,37 ℃孵育2 h;漂洗后滴加辣根过氧化物酶标记物,37 ℃孵育3 h;显色及后续步骤与胆碱能神经元免疫组织化学染色的方法一致。
1.5 体视学分析 1.5.1 大脑海马各亚区体积的计算在光学显微镜4倍镜下获取Anti-VAChT免疫组织化学染色的完整组织切片图像。按照各亚区细胞形态和排列方式的不同[12],参照小鼠脑图谱,应用体视学软件勾画出海马CA1区、CA2/3区和齿状回 (dentate gyrus,DG) 的边界:①CA1区与下托、CA2区和DG相邻,高倍下 (100×) 可见CA1区由薄层的 (2~3层)、排列紧密的、大小均一的小椎形细胞排列组成可与CA2区 (由大椎体细胞与小锥体细胞共同排列组成,细胞最为密集) 和下托 (细胞排列疏松) 划分开,而低倍下 (10×) 则可通过海马沟将CA1区与DG划分开;②CA2区为CA1和CA3的移行区较狭窄,且与CA3较难划分开,有研究将CA2与CA3合并一起研究,因此,只要能区分CA2/3区与DG,就能较容易画出CA2/3的边界。高倍下 (100×) 可见CA3由大锥体细胞组成,细胞排列疏松,细胞层约有10层,而DG是由小颗粒细胞紧密排列组成的颗粒细胞层且颗粒细胞层内插入多形细胞层 (PoDG),确定好边界后,方可在低倍下 (10×) 勾画出3个区域的边界,然后随机叠加等距测试点,计算落在海马CA1区、CA2/3区和DG上的测点数 (图 1)。通过卡瓦里原理[13-14]计算海马CA1区的体积V (CA1)、CA2/3的体积V (CA2/3) 和DG的体积V (DG):

|
| A:VAChT-ir染色后海马分区图黄色区域为CA1区,黑色区域为CA2/3区,蓝色区域为海马DG;B:计算海马DG体积的方法分区后,叠加等距测试点于切片上,分别计数落在海马CA1、CA2/3和DG内的点数 图 1 海马分区及体视学计算海马各亚区体积示意图 |
t为相邻两张切片的距离,即冰冻切片的厚度 (50 μm) 乘以相隔切片的数量;a (p) 为等距测点框的面积;∑P(CA1)、∑P(CA2/3)、∑P(DG) 分别为落在海马CA1区、CA2/3区和DG上的测点数。
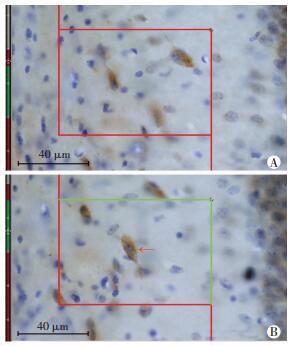
1.5.2 胆碱能神经元的计数应用体视学软件勾画出海马各亚区的边界后,高倍镜 (100×) 下随机抽取3个以上位置测量组织切片的厚度,然后打开体视学无偏计数框设置测试框的面积、高度以及切片的计数高度和面积抽样分数[15-16]。参数设置完成后调节视野,将镜下视野在Z轴上第一次聚焦的位置设为0,即切片的上表面。继续调节显微镜微调,按照体视学的体视框计数原则分别计数海马各亚区内胆碱能神经元的数量 (图 2)。在计数高度以内,细胞膜上有黄色颗粒状阳性着色且核仁聚焦清楚的神经元为胆碱能神经元,方可计数 (保护高度内的阳性胆碱能神经元均不计入总数)。计数每张切片的数目后,按照光学分合法[15-16]计算海马各亚区内胆碱能神经元的总数:
|
| A:保护高度以内,此时计数框为红色,即使核仁聚焦清晰的阳性神经元也不能计数;B:计数框变为绿色,表示已进入计数高度以内,此时核仁聚焦清晰且在保护高度以内未聚焦的阳性神经元可计数↑:被计数阳性胆碱能神经元 图 2 胆碱能神经元计数示意图 |
N (CA1)、N (CA2/3)、N (DG) 分别为每只小鼠单侧海马各亚区内胆碱能神经元总数;∑Q (CA1)、∑Q (CA2-3)、∑Q (DG) 分别为体视框获得的海马各亚区内胆碱能神经元总数;ssf为组织切片的抽样分数 (1/5);asf为面积抽样分数 (10%);tsf为组织切片厚度的抽样分数,即体视框的测试高度 (H=15 μm) 和切片染色后平均厚度 (T) 的比值。
1.6 统计学分析采用SPSS 19.0统计软件。其中,Morris水迷宫定位航行实验数据采用重复测量资料的方差检验分析,空间探索实验及海马DG的体积和胆碱能神经元的定量数据若服从正态分布,则采用独立样本t检验分析;若校正后数据仍不服从正态分布,则采用秩和检验分析。检验水准α=0.05。
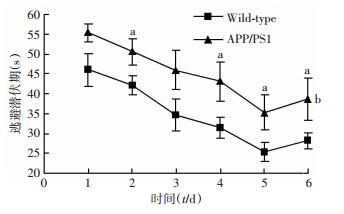
2 结果 2.1 Morris水迷宫定位航行实验结果显示:与Wild-type组相比,APP/PS1组逃避潜伏期显著延长 (P < 0.01),且两组在第2、4、5、6天逃避潜伏期差异均有统计学意义 (P=0.045、0.038、0.044、0.042,图 3)。空间探索实验结果显示:APP/PS1组穿越平台的次数与平台所在象限时间百分比[(1.143±0.476) 次、(29.743±6.855)%]均较Wild-type组显著减少[(3.321±1.804) 次、(39.557±11.536)%,P=0.007、0.041]。
|
| a:P < 0.05,b:P < 0.01,与Wild-type组比较 图 3 定位航行实验观察Wild-type组与APP/PS1组逃避潜伏期 |
2.2 Aβ免疫组织化学染色
Wild-type组海马各亚区内均无Aβ阳性斑块的沉积 (图 4A~C),APP/PS1组海马各亚区内Aβ阳性斑块明显沉积 (图 4D~F)。
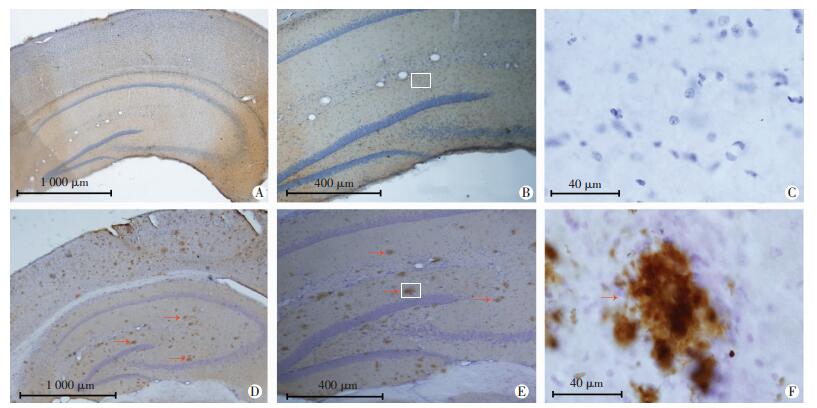
|
| A~C:Wild-type组不同放大倍数的视野下Aβ染色,无Aβ阳性斑块沉积;D~F:APP/PS1组不同放大倍数的视野下Aβ染色结果,海马内可见大量Aβ阳性斑块沉积 (箭头示) 图 4 免疫组织化学染色观察Wild-type组与APP/PS1组海马各亚区内Aβ阳性斑块沉积 (S-P) |
2.3 体视学结果
与Wild-type组相比,APP/PS1组海马DG的体积减小24%(P=0.001);APP/PS1组海马CA1区、CA2/3区的体积与Wild-type组相比差异无统计学意义 (P=0.089、0.059)。APP/PS1组海马CA1、CA2/3区内胆碱能神经元的总数与Wild-type组相比均差异无统计学意义 (P=0.076、0.074);APP/PS1组海马DG内胆碱能神经元的数量较Wild-type组减少34%(P=0.017,表 1)。
| 组别 | 体积 (mm3) | 胆碱能神经元总数 (×104) | |||||
| CA1区 | CA2/3区 | DG区 | CA1区 | CA2/3区 | DG区 | ||
| Wild-type组 | 4.735±0.587 | 4.296±0.659 | 2.885±0.321 | 3.573±0.841 | 3.398±0.593 | 1.968±0.475 | |
| APP/PS1组 | 4.137±0.622 | 3.629±0.532 | 2.202±0.260 | 2.744±0.587 | 2.442±1.015 | 1.294±0.325 | |
| P值 | 0.089 | 0.059 | 0.001 | 0.076 | 0.074 | 0.017 | |
3 讨论
APP/PS1双转基因AD小鼠可以稳定地表达人类突变基因APP和PS1,引起细胞外淀粉样蛋白的沉积[17]。Radde等[18]研究发现6~8月龄APP/PS1双转基因AD小鼠大脑内已出现淀粉样斑块的沉积,且随着年龄的增加,斑块所累积的区域逐渐增加[17]。研究显示APP/PS1双转基因AD小鼠大脑内淀粉样斑块沉积的时间较APP或PS1单转基因AD小鼠更早,且涉及的区域更广[9]。除此之外,APP/PS1转基因小鼠还能模拟AD患者胆碱能系统的改变和认知记忆能力障碍等特征性改变[9-10],有研究显示2~3月龄APP/PS1双转基因AD小鼠大脑皮层和海马区域就已出现胆碱能神经元的炎性膨胀[8],提示APP/PS1转基因小鼠能较好地模拟AD患者的病理性特征和认知记忆能力的渐进性改变。本团队前期分别对4、6、8月龄和10月龄雄性APP/PS1双转基因AD小鼠行为学进行测试后发现仅10月龄APP/PS1双转基因AD小鼠出现空间学习记忆能力缺陷[19],提示10月龄可能是APP/PS1双转基因AD小鼠空间学习记忆能力改变的早期。因此,本研究选用10月龄雌性APP/PS1双转基因AD小鼠和同月龄、同窝生雌性野生型小鼠作为研究对象,并采用Morris水迷宫检测小鼠的空间学习记忆能力。实验结果显示APP/PS1双转基因AD小鼠的逃避潜伏期要明显长于野生型小鼠,而穿越平台的次数以及平台所在象限时间百分比则显著降低,进一步证实10月龄APP/PS1双转基因AD小鼠空间学习记忆能力已出现障碍。
海马与DG构成海马回路,是记忆与空间定位相关的重要区域[20],其形态结构异常与AD空间记忆的丢失密切相关。有研究显示海马加速萎缩是轻微认知障碍患者向AD发展的重要表现[21]。本研究通过体视学精确定量研究,结果显示:10月龄雌性APP/PS1双转基因小鼠海马DG的体积较同月龄、同窝生野生型小鼠明显缩小,而CA1和CA2/3的体积无显著改变。本团队前期对10月龄雄性APP/PS1双转基因小鼠海马内各亚区的体积进行体视学定量发现CA1、CA3区和DG的体积较同月龄、同窝生野生型小鼠均显著萎缩[22]。可见,10月龄的APP/PS1双转基因AD小鼠海马各亚区萎缩的情况存在雌雄差异:雄性小鼠海马各亚区均显著萎缩,而雌性小鼠仅DG发生显著萎缩,可能与雌激素对AD早期有保护作用有关[23-24]。然而,无论雌性还是雄性,我们可以确定的是10月龄APP/PS1转基因小鼠海马DG的体积已出现显著萎缩。以往Redwine等[25]研究也发现3月龄PDAPP转基因AD小鼠海马DG的体积就已出现萎缩 (在Aβ沉积之前)。可见,DG开始出现萎缩的时间较海马其他区域更早,DG的萎缩可能是APP/PS1小鼠早期空间学习和记忆能力下降的重要原因之一。
那么,海马DG出现萎缩的结构基础是什么呢?West等[26]研究发现AD患者海马DG内神经元较对照组显著减少。本团队前期研究发现10月龄雄性APP/PS1双转基因小鼠海马DG内神经元均较同月龄野生型小鼠显著减少[16]。众所周知,神经元由胆碱能神经元、单胺能神经元、谷氨酸能神经元等多种递质类神经元组成,其中AD患者胆碱能神经元选择性受损被认为是AD认知记忆能力障碍的关键因素[2]。DeKosky等[7]分别检测了无认知障碍 (NCI)、轻度认知障碍 (MCI) 和轻度AD患者海马内胆碱能标志物的活性,结果发现MCI组海马内ChAT的活性较NCI组显著升高,而轻度AD组较MCI组海马内ChAT的活性则显著减低。Perez等[8]对APP/PS1双转基因AD小鼠进行研究发现,其海马内ChAT的活性在2~6月龄较对照组有所升高,而10~16月龄则显著下降,且2~3月龄就已出现胆碱能神经元的炎性膨胀。提示在AD前驱期海马胆碱能系统存在代偿性上调,而AD早期海马内胆碱能神经元可能已受损严重。本研究运用体视学的方法精确定量海马各亚区内胆碱能神经元的总数,结果显示10月龄雌性APP/PS1转基因AD小鼠大脑海马DG内胆碱能神经元的数量较同月龄、同窝生野生型小鼠显著减少,而CA1和CA2/3内胆碱能神经元的数量无显著改变。这一研究结果提示AD早期海马内不仅存在胆碱能神经元形态结构的改变和胆碱能标志物活性的改变,还存在胆碱能神经元的显著丢失,其中DG内胆碱能神经元受损最为严重。为什么海马DG胆碱能神经元较CA区受损更严重呢?有研究者认为这可能与DG和CA区神经环路调整有关,CA区神经主要来源于两条通路:嗅皮层的直接投射的单突触通路 (嗅皮层-CA1-嗅皮层) 和经DG的投射三突触通路 (嗅皮层-DG-CA3-CA1-嗅皮层)[27]。DG是神经发生的重要部位,与新记忆形成密切相关,在AD早期极易受到损伤[28]。当DG受损时,最易受到影响的是三突触通路,而单突触通路则成为主要的通路,且有研究证实阻断三突触通路后,单突触通路足够完成学习和记忆相关的多项实验[29]。此外,本研究结果显示:10月龄雌性APP/PS1小鼠海马各亚区内胆碱能神经元的改变 (DG内胆碱能神经元显著丢失,而CA1区和CA2/3区内胆碱能神经元没有显著丢失) 与海马各亚区体积的改变 (DG体积显著减小,而CA1区和CA2/3区体积没有显著改变) 是一致的,提示海马内胆碱能神经元的改变可能是造成10月龄雌性APP/PS1双转基因AD小鼠海马萎缩的重要原因之一。其中,10月龄雌性APP/PS1双转基因AD小鼠海马DG萎缩和DG内胆碱能神经元丢失发生的时间早于CA1区和CA2/3区,可能是10月龄雌性APP/PS1双转基因AD小鼠早期空间学习和记忆能力下降的重要结构基础之一。
综上所述,本研究利用现代体视学方法精确定量分析了10月龄雌性APP/PS1双转基因AD小鼠和同月龄、同窝生雌性野生型小鼠海马各亚区内胆碱能神经元的数量,发现10月龄雌性APP/PS1双转基因AD小鼠海马DG内胆碱能神经元的数量存在丢失,这可能是AD早期行为学改变的结构基础之一,通过早期保护海马DG内胆碱能神经元,或许可以延缓AD的发展进程。
| [1] | Arnold S E, Hyman B T, Flory J, et al. The topographical and neuroanatomical distribution of neurofibrillary tangles and neuritic plaques in the cerebral cortex of patients with Alzheimer's disease[J]. Cereb Cortex, 1991, 1(1): 103–116. DOI:10.1093/cercor/1.1.103 |
| [2] | Davies P, Maloney A J. Selective loss of central cholinergic neurons in Alzheimer's disease[J]. Lancet, 1976, 2(8000): 1403. |
| [3] | McKinney M, Coyle J T, Hedreen J C. Topographic analysis of the innervation of the rat neocortex and hippocampus by the basal forebrain cholinergic system[J]. J Comp Neurol, 1983, 217(1): 103–121. DOI:10.1002/cne.902170109 |
| [4] | Yi F, Catudio-Garrett E, Gábriel R, et al. Hippocampal "cholinergic interneurons" visualized with the choline acetyltransferase promoter: anatomical distribution, intrinsic membrane properties, neurochemical characteristics, and capacity for cholinergic modulation[J]. Front Synaptic Neurosci, 2015, 7: 4. DOI:10.3389/fnsyn.2015.00004 |
| [5] | Barnes J, Fox N C. The search for early markers of AD: hippocampal atrophy and memory deficits[J]. Int Psychogeriatr, 2014, 26(7): 1065–1066. DOI:10.1017/S1041610214000623 |
| [6] | Whitehouse P J, Price D L, Struble R G, et al. Alzheimer's disease and senile dementia: loss of neurons in the basal forebrain[J]. Science, 1982, 215(4537): 1237–1239. DOI:10.1126/science.7058341 |
| [7] | DeKosky S T, Ikonomovic M D, Styren S D, et al. Upregulation of choline acetyltransferase activity in hippocampus and frontal cortex of elderly subjects with mild cognitive impairment[J]. Ann Neurol, 2002, 51(2): 145–155. DOI:10.1002/ana.10069 |
| [8] | Perez S E, Dar S, Ikonomovic M D, et al. Cholinergic forebrain degeneration in the APPswe/PS1DeltaE9 transgenic mouse[J]. Neurobiol Dis, 2007, 28(1): 3–15. DOI:10.1016/j.nbd.2007.06.015 |
| [9] | Jaffar S, Counts S E, Ma S Y, et al. Neuropathology of mice carrying mutant APP (swe) and/or PS1(M146L) transgenes: alterations in the p75(NTR) cholinergic basal forebrain septohippocampal pathway[J]. Exp Neurol, 2001, 170(2): 227–243. DOI:10.1006/exnr.2001.7710 |
| [10] | Ferguson S A, Sarkar S, Schmued L C. Longitudinal behavioral changes in the APP/PS1 transgenic Alzheimer's disease model[J]. Behav Brain Res, 2013, 242: 125–134. DOI:10.1016/j.bbr.2012.12.055 |
| [11] | Morris R G, Garrud P, Rawlins J N, et al. Place navigation impaired in rats with hippocampal lesions[J]. Nature, 1982, 297(5868): 681–683. DOI:10.1038/297681a0 |
| [12] | Zhao Y Y, Shi X Y, Zhang L, et al. Enriched environment induces higher CNPase positive cells in aged rat hippocampus[J]. Neurosci Lett, 2013, 555: 177–181. DOI:10.1016/j.neulet.2013.09.032 |
| [13] | Tang Y, Nyengaard J R, Pakkenberg B, et al. Age-induced white matter changes in the human brain: a stereological investigation[J]. Neurobiol Aging, 1997, 18(6): 609–615. DOI:10.1016/s0197-4580(97)00155-3 |
| [14] | Gundersen H J, Jensen E B, Kiêu K, et al. The efficiency of systematic sampling in stereology—reconsidered[J]. J Microsc, 1999, 193(Pt 3): 199–211. DOI:10.1046/j.1365-2818.1999.00457.x |
| [15] | Tang Y, Janssen W G, Hao J, et al. Estrogen replacement increases spinophilin-immunoreactive spine number in the prefrontal cortex of female rhesus monkeys[J]. Cereb Cortex, 2004, 14(2): 215–223. DOI:10.1093/cercor/bhg121 |
| [16] |
蒋林. 跑步锻炼对早期APP/PS1转基因AD小鼠海马各亚区内神经元数量的影响[D]. 重庆: 重庆医科大学, 2015.
Jiang L. Effects of exercise on the neurons in the hippocampus of early APP/PS1 transgenic mouse[D]. Chongqing:Chongqing Medical University, 2015. |
| [17] | Poisnel G, Dhilly M, Moustié O, et al. PET imaging with[J]. Neurobiol Aging, 2012, 33(11): 2561–2571. DOI:10.1016/j.neurobiolaging.2011.12.024 |
| [18] | Radde R, Bolmont T, Kaeser S A, et al. Abeta42-driven cerebral amyloidosis in transgenic mice reveals early and robust pathology[J]. EMBO Rep, 2006, 7(9): 940–946. DOI:10.1038/sj.embor.7400784 |
| [19] |
张蕾. AD早期行为学、Aβ和白质的改变及跑步锻炼能否延缓这些改变进程的探讨[D]. 重庆: 重庆医科大学, 2014.
Zhang L. The early changes of behavior and amyloid and the white matter in Alzheimer's disease and the effects of exercise on the behavior and the white matter in Alzheimer's disease[D]. Chongqing:Chongqing Medical University, 2014. |
| [20] | Cave C B, Squire L R. Equivalent impairment of spatial and nonspatial memory following damage to the human hippocampus[J]. Hippocampus, 1991, 1(3): 329–340. DOI:10.1002/hipo.450010323 |
| [21] | Wang P N, Liu H C, Lirng J F, et al. Accelerated hippocampal atrophy rates in stable and progressive amnestic mild cognitive impairment[J]. Psychiatry Res, 2009, 171(3): 221–231. DOI:10.1016/j.pscychresns.2008.05.002 |
| [22] |
晁凤蕾. 跑步锻炼对转基因AD小鼠海马作用的研究[D]. 重庆: 重庆医科大学, 2016.
Chao F L. The effects of running exercise on the hippocampus in APP/PS1 transgenic AD mice[D]. Chongqing: Chongqing Medical University, 2016. |
| [23] | Xu H, Gouras G K, Greenfield J P, et al. Estrogen reduces neuronal generation of Alzheimer beta-amyloid peptides[J]. Nat Med, 1998, 4(4): 447–451. DOI:10.1038/nm0498-447 |
| [24] | Hwang C J, Park M H, Choi M K, et al. Acceleration of amyloidogenesis and memory impairment by estrogen deficiency through NF-κB dependent beta-secretase activation in presenilin 2 mutant mice[J]. Brain Behav Immun, 2016, 53: 113–122. DOI:10.1016/j.bbi.2015.11.013 |
| [25] | Redwine J M, Kosofsky B, Jacobs R E, et al. Dentate gyrus volume is reduced before onset of plaque formation in PDAPP mice: a magnetic resonance microscopy and stereologic analysis[J]. Proc Natl Acad Sci USA, 2003, 100(3): 1381–1386. DOI:10.1073/pnas.242746599 |
| [26] | West M J, Kawas C H, Stewart W F, et al. Hippocampal neurons in pre-clinical Alzheimer's disease[J]. Neurobiol Aging, 2004, 25(9): 1205–1212. DOI:10.1016/j.neurobiolaging.2003.12.005 |
| [27] | Amaral D G, Scharfman H E, Lavenex P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies)[J]. Prog Brain Res, 2007, 163: 3–22. DOI:10.1016/S0079-6123(07)63001-5 |
| [28] | Li B, Yamamori H, Tatebayashi Y, et al. Failure of neuronal maturation in Alzheimer disease dentate gyrus[J]. J Neuropathol Exp Neurol, 2008, 67(1): 78–84. DOI:10.1097/nen.0b013e318160c5db |
| [29] | Nakashiba T, Young J Z, McHugh T J, et al. Transgenic Inhibition of Synaptic Transmission Reveals Role of CA3 Output in Hippocampal Learning[J]. Science, 2008, 319(5867): 1260–1264. DOI:10.1126/science.1151120 |