热射病(heat stroke,HS)是最严重的一种重症中暑,是由于高温高湿环境及高强度运动致使体内热蓄积,引起机体核心温度迅速升高超过40 ℃,并伴有中枢神经系统功能障碍(如谵妄、惊厥、昏迷),以及多器官系统损伤的严重临床综合征[1]。中枢神经系统损害是热射病的典型特征之一,也是热射病高死亡率的主要原因。目前热射病的中枢神经损伤机制还未完全研究清楚,既往研究主要集中在高温对神经元的损害[2-4],而小胶质细胞是中枢神经系统中一类重要的免疫细胞,其是否与热射病导致的中枢神经损害有关,目前鲜有文献报道。本课题组前期研究表明热射病小鼠早期大脑出现病理损伤[4]及同期热射病小鼠中枢神经系统发生一过性炎症反应,据此推测小胶质细胞可能参与了热射病导致的中枢神经炎症及损伤。本研究采用小鼠热射病模型,观察高热应激对脑组织中小胶质细胞M1/M2型极化标志物表达的影响,探讨小胶质细胞活化在热射病后中枢神经损伤中的可能作用及机制。
1 材料与方法 1.1 材料 1.1.1 实验动物及分组57只12周龄健康雄性BALB/c小鼠由第三军医大学实验动物中心提供(许可证号:SYXK渝2012-0002),体质量(29.1±0.6)g,采用随机数字表法将动物分为正常对照组及HS组,HS组分为3个观察时相,即热射病1 h组(HS 1 h)、热射病6 h组(HS 6 h)、热射病24 h组(HS 24 h)。对照组12只小鼠,热射病各时相每组15只小鼠(因热应激后约80%存活率,保证每个观察时相组12只)。每组中分别取8只小鼠用于提取RNA和蛋白,4只小鼠用于免疫组织荧光检测。饲养及实验过程中遵守实验动物管理与保护准则。
1.1.2 主要试剂及实验设备Eastep总RNA提取试剂盒(LS1040,Promega公司),PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒(RR047A,TaKaRa公司)、KAPA SYBR FAST qPCR Kit试剂盒(KK4601,Kapa Biosystems公司)、CD45(1 :500,ab10558)及CD11b (1 :1 000,ab133357,Abcam公司)、FIZZ(1 :200,PA1-46244,Life Tech公司)、CD206(1 :80,sc-48758,Santa Cruz公司)、二抗山羊抗兔(1 :1 000,ZB-5301,中杉金桥公司)、组织均质器(FastPrep-24 Instrument,MP Biomedicals)、实时荧光定量PCR仪(CFX connect)、ECL显色成像分析系统(Bio-Rad ChemiDoc MP,Bio-Rad公司)、共聚焦显微镜(LSM780,Carl Zeiss公司)。
1.2 方法 1.2.1 热射病动物模型的建立将小鼠置于特定环境智能型模拟实验舱(天津合普,HOPE-MED 8150E型),温度(41.2±0.5)℃,相对湿度(60±2)%,加热至直肠温度达到(42.4±0.2)℃认为达到热暴露损伤要求,建立热射病小鼠模型[2, 5]。
1.2.2 热射病各时相点小鼠取材于热暴露处理后的各时相点选取对应组动物,腹腔注射1%戊巴比妥(40 mg/kg)麻醉后,开胸暴露心脏,从鼠左心尖插入灌注针头至升主动脉,右心耳剪开,止血钳固定,用加热到37 ℃的生理盐水(0.9% NaCl)快速灌注,直到肝变白。断头取脑,取左侧大脑组织30 mg置入300 μL TRIzol RNA裂解液,取右侧大脑组织50 mg置入300 μL RAPI蛋白裂解液。分别将含有蛋白和mRNA裂解物的2 mL均质管置于组织均质器中,于 1 min震荡均质后,吸取上清放入-80 ℃冰箱保存备用。另取各实验 组动物,行麻醉灌注至肝变白后,用预冷的4%多聚甲醛灌注 固定,先10 mL/min灌注至四肢发硬,再2 mL/min 灌注维持60 min。断头取脑后,置入4%多聚甲醛行后固定16 h。在4 ℃下依次移入4%多聚甲醛配制的20%和30%蔗糖液中直至沉底,包埋后,冷冻制片机上行30 μmol/L冰冻切片,置入4%多聚甲醛于4 ℃保存备用。
1.2.3 实时荧光定量PCR检测于-80 ℃冰箱中取出备用的RNA裂解物,Eastep总RNA提取试剂盒提取总RNA。 按PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒说明进行反转录合成cDNA。按KAPA SYBR FAST qPCR Kit试剂盒进行基因定量分析。20 μL 反应体系:KAPA SYBR FAST qPCR Master Mix (2×) 10 μL,正义链(10 μmol/L)0.4 μL,反义链(10 μmol/L)0.4 μL,无RNAase水8.7 μL,cDNA溶液0.5 μL。实时荧光定量PCR仪上进行两步法检测,扩增条件:95 ℃预变性3 min,40个循环反应:95 ℃ 3 s,59 ℃(TNF-α、CD11b 、CD45和HPRT)或63 ℃(Arg1、FIZZ、CD206和HPRT) 20 s。每个样本设3个复孔。引物序列见表 1。
| 基因 | 正义链(5′→3′) | 反义链(5′→3′) | 片段长度 |
| TNF-α | GACCCTCACATCAGATCATCTTT | CCTCCACTTGGTGGTTTGCT | 80 bp |
| CD11b | AAGGATTCAGCAAGCCAGAA | TAGCAGGAAAGATGGGAGG | 136 bp |
| CD45 | ATCATCGCCAGCATCTATCC | GACGGACACAGTTAGCATCC | 118 bp |
| Arg1 | GACCTGGCCTTTGTTGATGT | CCATTCTTCTGGACCTCTGC | 119 bp |
| FIZZ | TGCCAATCCAGCTAA CTATCC | CAGTAGCAGTCATCC CAGCA | 107 bp |
| CD206 | GGGACTCTGGATTGGACTCA | GGGACTCTGGATTGGACTCA | 114 bp |
| HPRT | GTTAAGCAGTACAGCCCCAAA | AGGGCATATCCAACAACAAACTT | 131 bp |
1.2.4 Western blot检测
于-80 ℃冰箱中取出备用蛋白裂解物,提取总蛋白,CBA法测定各样本蛋白浓度。80 μg蛋白煮沸变性后上样进行聚丙烯酰胺凝胶电泳,再将凝胶中的蛋白电湿转至聚偏二氟乙烯膜(PVDF)膜上,经含5%脱脂奶粉的Tris盐缓冲液(TBS)封闭1 h后,分别移入一抗CD45、CD11b、FIZZ和CD206,4 ℃孵育过夜。TBST洗3次×10 min后,孵育二抗2 h,ECL显色法在成像分析系统中观察拍照。ImageJ 1.48软件测量条带灰度值。
1.2.5 免疫组织荧光检测于4%多聚甲醛中取各组小鼠脑组织切片,经PBS中漂洗后,移入山羊血清工作液中封闭30 min。加入一抗兔来源CD45和山羊来源CD206,4 ℃孵育过夜。PBS洗4次×10 min后,分别孵育FITC标记的山羊抗兔IgG和CF633标记 的鸡抗山羊IgG。室温孵育2 h后,PBS洗4次×10 min。 DAPI染核5 min,PBS洗4次×10 min。抗荧光淬灭剂封片后,于共聚焦显微镜下观察拍照。
1.3 统计学分析采用SPSS 13.0统计软件,计量资料以x±s表示,两组间数据比较进行student-t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 热射病小鼠脑组织小胶质细胞M1型极化标志物mRNA表达水平的变化实时荧光定量PCR实验结果显示,热损伤后,小鼠大脑皮层TNF-α在1~6 h表达明显增加,M1型极化标志物CD45、CD11b表达在1 h达到最高,24 h 后基本恢复至正常对照水平(P<0.01,图 1)。
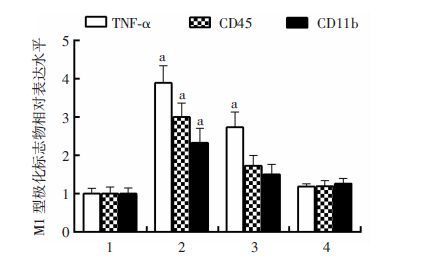
|
| 1:正常对照组;2~4:分别为热射病1、6、24 h组 a: P<0.01,与正常对照组比较 图 1 实时荧光定量PCR检测小鼠大脑皮层M1型极化标志物 |
2.2 热射病小鼠脑组织小胶质细胞M1型极化标志物CD45、CD11b蛋白表达的变化
Western blot检测小鼠脑组织M1型极化标志物CD45及CD11b的蛋白表达量显示,在热损伤后1 h CD45及CD11b均显著升高(P<0.01),6 h后逐渐下降,但仍高于对照组(P<0.01),24 h后基本恢复至对照水平(P>0.05,图 2)。
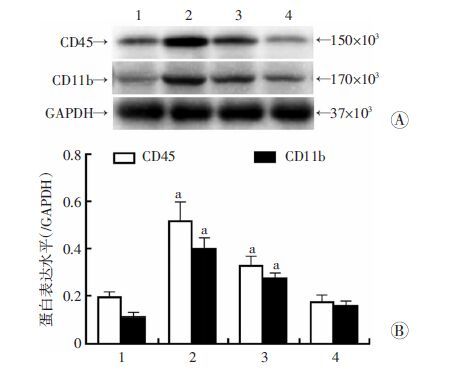
|
| 1:正常对照组;2~4:分别为热射病1、6、24 h组;A:Western blot 检测; B:半定量分析 a: P<0.01,与正常对照组比较 图 2 Western blot检测小鼠大脑皮层小胶质细胞M1型极化标志物 |
2.3 热射病小鼠脑组织小胶质细胞M2型极化标志物CD206、FIZZ、Arg1 mRNA表达水平的变化
实时荧光定量PCR检测显示,大脑海马炎症因子M2型极化标志物CD206、FIZZ在热损伤后1~6 h基本没有明显变化,Arg1在6 h略有降低;3个分子在24 h 后则显著升高,尤其以CD206上升最为明显(P<0.01,图 3)。
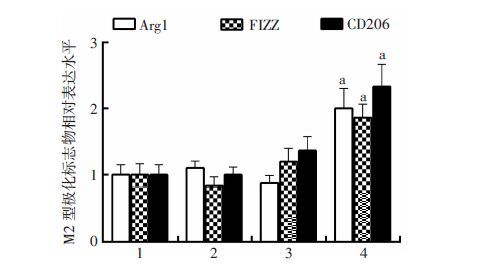
|
| 1:正常对照组;2~4:分别为热射病1、6、24 h组 a: P<0.01,与正常对照组比较 图 3 实时荧光定量PCR检测大脑皮层M2型极化标志物 |
2.4 热射病小鼠脑组织小胶质细胞M2型极化标志物FIZZ、CD206的蛋白表达的变化
Western blot 检测显示,脑组织M2型极化标志物FIZZ的蛋白表达量在热损伤后1~6 h基本没有明显变化(P>0.05),到24 h后则显著增加(P<0.01);CD206的蛋白表达量在热损伤1 h后开始逐渐升高(P<0.01),到24 h后达到峰值(P<0.01,图 4)。
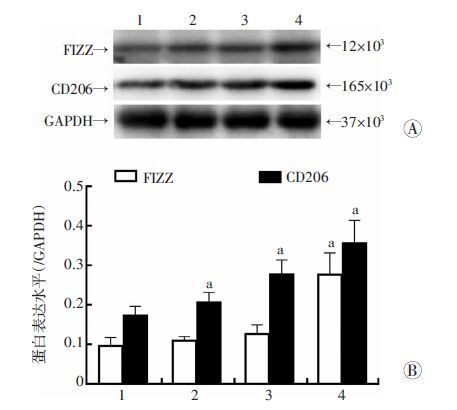
|
| 1:正常对照组;2~4:分别为热射病1、6、24 h组;A:Western blot 检测; B:半定量分析 a:P<0.01,与正常对照组比较 图 4 Western blot检测小鼠大脑皮层小胶质细胞M2型极化标志物 |
2.5 免疫组织荧光标记激光共聚焦观察CD45、CD206表达
免疫荧光镜观察可见,小胶质细胞特异性标志物由绿色荧光标记的CD45和红色荧光标记CD206共定位表达。正常对照组及热射病24 h组基本没有绿色荧光标记,仅在热射病1 h组有明显的标记,表明CD45在热损伤后表达增强;红色荧光在正常对照组标记很少,热射病1 h组红色荧光有所增加,而热射病24 h 组则最为明显,表明CD206在热损伤后热射病1 h 表达有所增加,在热射病24 h后增加最为显著(图 5)。
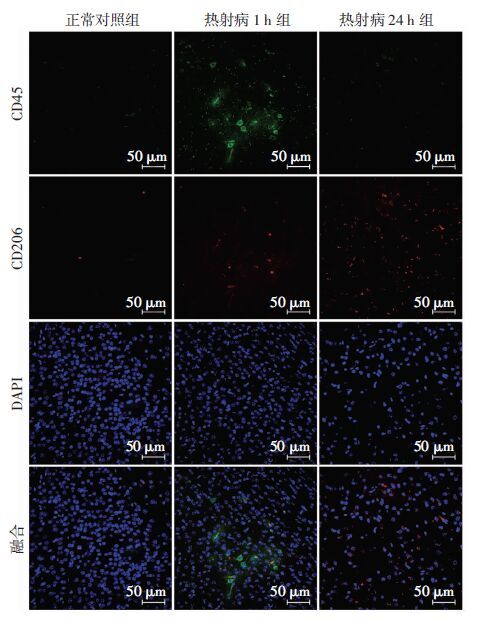
|
| 图 5 激光共聚焦显微镜观察热射病损伤后小鼠大脑皮层小胶质细胞M1/M2极化的共定位表达 |
3 讨论
小胶质细胞是中枢神经系统的免疫细胞,担任警戒任务,在正常脑组织中处于静息状态,当受到外界各种病理刺激时迅速发生活化[6-7]。活化的小胶质细胞既能分泌神经营养因子、吞噬坏死细胞等产生神经保护作用,又能分泌多种促炎因子,促进神经炎症发生,导致神经损伤[8-11]。近年研究表明小胶质细胞这种双重作用主要和小胶质细胞活化后的两种极化方向M1/M2有关[8]。M1型极化(又称经典型活化)的小胶质细胞主要分泌促炎因子如IL-1β、IL-6、TNF-α、NO等,发挥促进炎症反应、 抑制吞噬功能等神经毒性作用[8-11]。M2型极化(又称替代型活化)的小胶质细胞主要分泌抑炎因子IL-4、IL-10、IL-13、TGF-β、Arg1以及神经营养因子等,主要发挥免疫调节、抑制炎症、维持吞噬、促进修复和再生等神经保护作用[8-11]。研究表明,在脑外伤、脑缺血以及阿尔茨海默病(Alzheimer disease,AD)等神经退行性疾病过程中小胶质细胞均表现为M1型活化,参与脑组织损伤的病理过程[12-14]。
本研究采用小鼠暴露于(41.2±0.5)℃热环境,至直肠温度达(42.4±0.2)℃以上,模拟热射病条件的高强度热应激损伤。实时免疫荧光检测结果显示热应激后1~6 h M1型极化标志物TNF-α、CD45、CD11b表达明显增加,24 h 后基本恢复至正常对照组水平;而M2型极化标志物FIZZ、CD206在热损伤后1~6 h基本没有明显变化,Arg1在6 h略有降低,3个分子在24 h后则显著升高,尤其以CD206上升最为明显。采用Western blot检测M1型极化标志物CD45及CD11b的蛋白表达量,其变化趋势类似实时荧光定量PCR结果,在1 h后显著升高,随后逐渐下降,24 h后最低;M2型极化标志物FIZZ与CD206的表达趋势并不完全一致,但二者均在24 h后显著升高并达峰值。免疫组织荧光标记激光共聚焦观察CD45、CD206的表达,结果与蛋白定量检测基本一致。本实验结果证明热应激可明确诱导小鼠脑组织小胶质细胞活化,其活化的规律表现为热射病1 h组主要表现为M1型极化,而在热射病24 h组则主要表现为M2型极化。
本研究还发现热射病后6 h内小鼠存活率进行性降低,至12 h后逐渐稳定,且小鼠海马及皮层脑组织在热射病后12 h内出现明显的炎症反应,而12 h后炎症反应明显减轻。结合热射病后小胶质细胞活化的这种动态变化,分析认为小胶质细胞在热射病致中枢神经损伤中发挥一定作用。热应激后1 h小胶质细胞以M1型极化为主,可高表达很多促炎介质(包括IL-1β、IL-6、TNF-α等),使中枢神经系统产生明显炎症反应,加重脑损害,此时表现为热射病后损伤进行性加重,存活率不断下降。随着时间延长,小胶质细胞M1型极化减弱,而M2型极化增强,到热应激后24 h主要表现为M2型极化,小胶质细胞则可通过分泌抗炎介质及生长因子,使中枢神经炎症明显减轻,并加强对凋亡变性神经元的吞噬,促进受损的中枢神经修复,故热应激后24 h小鼠存活率稳定,且体温恢复至正常[14]。
目前很多学者认为中枢神经系统中小胶质细胞M1型与M2型极化的动态平衡与维持中枢神经系统正常功能密切相关,当发生脑卒中、AD等慢性中枢神经系统疾病时这种动态平衡就被打破[15-16]。以往有研究认为热射病引起的脑损伤与脑缺血引起的脑损伤很相似[17]。近期研究表明,脑缺血后随着时间的推移,脑缺血大脑的小胶质细胞可表现出动态性的极化,主要从短暂的M2型向M1型转化[16, 18-19],这与本研究中热射病后小胶质细胞主要从M1型向M2型转化不一致,说明缺血性脑损伤与热射病脑损伤可能存在不同的机制。因此还需进一步研究影响热射病后大脑中小胶质细胞M1和M2型极化转变的机制,探索调控或阻止小胶质细胞M1型极化,诱导M2型极化,为治疗热射病中枢神经损伤探寻新的思路。
| [1] | 张文武. 急诊内科学[M]. 北京: 人民卫生出版社, 2004 : 12 -22. |
| [2] | Biedenkapp J C, Leon L R. Increased cytokine and chemokine gene expression in the CNS of mice during heat stroke recovery[J]. Am J Physiol Regul Integr Comp Physiol,2013, 305 (9) : R978 –R986. DOI:10.1152/ajpregu.00011.2013 |
| [3] | Rodriguez-Fernandez M, Grosman B, Yuraszeck TM, et al. Modeling the intra- and extracellular cytokinesignaling pathway under heat stroke in the liver[J]. PLoS ONE,2013, 8 (9) : e73393 . DOI:10.1371/journal.pone.0073393 |
| [4] | 易均凤, 何根林, 杨举, 等. 热习服对热射病小鼠中枢神经细胞自噬及凋亡的影响[J]. 第三军医大学学报,2015, 37 (11) : 1059 –1063. DOI:10.16016/j.1000-5404.201502011 |
| [5] | Xia C Y, Zhang S, Gao Y, et al. Selective modulation of microglia polarization to M2 phenotype for stroke treatment[J]. Int Immunopharmacol,2015, 25 (2) : 377 –382. DOI:10.1016/j.intimp.2015.02.019 |
| [6] | Huang B R, Chang P C, Yeh W L, et al. Anti-neuroinflammatory effects of the calcium channel blocker nicardipine on microglial cells: implications for neuroprotection[J]. PLoS ONE,2014, 9 (3) : e91167 . DOI:10.1371/journal.pone.0091167 |
| [7] | Koizumi S, Ohsawa K, Inoue K, et al. Purinergic receptors in microglia:functional modal shifts of microglia mediated by P2 and P1 receptors[J]. Glia,2013, 61 (1) : 47 –54. DOI:10.1002/glia.22358 |
| [8] | Nakagawa Y, Chiba K. Role of Microglial M1/M2 Polarization in Relapse and Remission of Psychiatric Disorders and Diseases[J]. Pharmaceuticals,2014, 7 (12) : 1028 –1048. DOI:10.3390/ph7121028 |
| [9] | Loane D J, Kumar A. Microglia in the TBI brain: The good, the bad, and the dysregulated[J]. Exp Neurol,2016, 275 . DOI:10.1016/j.expneurol.2015.08.018 |
| [10] | Chio C C, Lin M T, Chang C P. Microglial activation as a compelling target for treating acute traumatic brain injury[M]. Curr Med Chem, 2015, 22(6): 759-770. DOI: 10.2174/0929867321666141106124657 |
| [11] | Hu X, Leak R K, Shi Y, et al. Microglial and macrophage polarization-new prospects for brain repair[J]. Nat Rev Neurol,2015, 11 (1) : 56 –64. DOI:10.1038/nrneurol.2014.207 |
| [12] | Hsuan Y C, Lin C H, Chang C P, et al. Mesenchymal stem cell-based treatments for stroke, neural trauma, and heat stroke[J]. Brain Behav,2016, 6 (10) : e00526 . DOI:10.1002/brb3.526 |
| [13] | Udeochu J C, Shea J M, Villeda S A. Microglia communication: Parallels between aging and Alzheimer's disease[J]. Clin Exp Neuroimmunol,2016, 7 (2) : 114 –125. DOI:10.1016/j.bbi.2016.07.003 |
| [14] | Wang W Y, Tan M S, Yu J T, et al. Role of pro-inflammatory cytokines released from microglia in Alzheimer's disease[J]. Ann Transl Med,2015, 3 (10) : 136 . DOI:10.3978/j.issn.2305-5839.2015.03.49 |
| [15] | Varnum M M, Ikezu T. The classification of microglial activation phenotypes on neurodegeneration and regeneration in Alzheimer's disease brain[J]. Arch Immunol Ther Exp (Warsz),2012, 60 (4) : 251 –266. DOI:10.1007/s00005-012-0181-2 |
| [16] | Hu X M, Li P, Guo Y, et al. Macrophage Polarization Dynamics Reveal Novel Mechanism of Injury Expansion After Focal Cerebral Ischemia[J]. Stroke,2012, 43 (11) : 3063 –3070. DOI:10.1161/STROKEAHA.112.659656 |
| [17] | Lin M T, Kao T Y, Chio CC, et al. Dopamine depletion protects striatal neurons from heatstroke-induced ischemia and cell death in rats[J]. Am J Physiol,1995, 269 (2 Pt 2) : H487 –490. |
| [18] | Wang G H, Zhang J, Hu X M, et al. Microglia/macrophage polarization dynamics in white matter after traumatic brain injury[J]. J Cereb Blood Flow Metab,2013, 33 (12) : 1864 –1874. DOI:10.1038/jcbfm |
| [19] | Amantea D, Micieli G, Tassorelli C, et al. Rational modulation of the innate immune system for neuroprotection in ischemic stroke[J]. Front Neurosci,2015, 29 (9) : 147 . DOI:10.3389/fnins.2015.00147 |



