热射病(heat stroke,HS)是一种最严重的重症中暑,是由于暴露在高温高湿环境中导致机体核心温度迅速升高并超过40 ℃,伴有中枢神经系统功能障碍(如谵妄、惊厥、昏迷)等多器官系统损伤的严重临床综合征[1]。目前普遍认为其病理生理机制是一种全身炎症性反应综合征(systemic inflammatory response syndrome,SIRS),类似于全身脓毒血症[2]。但这种全身炎症反应与热射病导致的脑损伤是否有关联,目前还不明确。本研究通过观察热射病恢复早期中枢神经系统(皮层及海马脑区)炎症反应以及外周炎症反应随时间的变化规律,初步探讨热射病发生过程中中枢炎症与外周炎症的关系,为热射病导致脑损伤的救治和防护提供实验依据。
1 材料与方法 1.1 材料 1.1.1 实验动物及分组70只12周龄健康雄性BALB/c小鼠(由第三军医大学实验动物中心提供,许可证号:SYXK渝2012-0002),体质量(29.1±0.6) g,采用随机数字表法将动物分为正常对照组、热射病后各时相(0、1、6、12、24 h)观察组,每组8只;另设正常对照组8只、热射病组14只用于观察直肠温度变化及生存率。饲养及实验过程中遵守实验动物管理与保护准则。
1.1.2 主要试剂及实验设备Eastep总RNA提取试剂盒(货号LS1040)购于美国Promega公司,PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒(货号RR047A)购于天津TaKaRa公司,通用型SYBR快速荧光定量PCR试剂盒(货号KK4601)购于美国Kapa biosystems公司,TNF-α、IL-1β、IL-6、HPRT引物序列由上海Sangon Biotech设计合成,TNF-α、IL-1β和IL-6 ELISA试剂盒(货号依次为88-7324-22、88-7013-22、88-7064-22)均购于美国EBioscience公司,动态浊度法内毒素检测鲎试剂盒(货号SJ-02)购于厦门鲎试剂公司。组织均质器(型号FastPrep®-24 Instrument)购于美国MP Biomedicals,实时荧光定量PCR仪(型号CFX connect)购于美国Bio-Rad公司,连续波长酶标仪(型 号SpectraMax Plus 384)购于美国Molecular Devices公司。
1.2 方法 1.2.1 热射病动物模型的建立小鼠实验前4 h停止饮水饮食,于入舱时测量小鼠直肠温度及体质量。热射病组小鼠置于特定环境智能型模拟实验舱 (天津合普,HOPE-MED 8150E型),设定温度(41.2±0.5) ℃,相对湿度(60±2)%,出舱条件为小鼠直肠温度达 (42.4±0.2 ) ℃[1];正常对照组置于(25.0±0.5) ℃,相对湿度(60±2)%环境中,禁水禁食。
1.2.2 热射病恢复早期小鼠直肠温度监测出舱后置于(25.0±0.5) ℃,相对湿度(60±2)%环境中 恢复,自由饮水饮食。正常对照组8只、热射病组14只连续直肠温度监测,间隔依次为>0~≤2 h内15 min 1次;>2~≤6 h内30 min 1次,>6~≤12 h内60 min 1次,>12~≤24 h内120 min 1次。
1.2.3 各组小鼠取材正常对照组及热射病0、1、6、12、24 h组各8只,正常对照组和热射病0 h组在热射病后即刻、热射病1 h组在热射病后恢复1 h、热射病6 h组在热射病后恢复6 h、热射病12 h组在热射病后恢复12 h、热射病24 h组在热射病后恢复24 h,于相应时相点测量小鼠直肠温度及体质量后,腹腔注射1%戊巴比妥(40 mg/g),待麻醉后固定于塑料板,充分暴露小鼠胸腔,通过右心房取出血液置于冰盒60 min,然后3 000 r/min离心15 min,吸取上清放-80 ℃ 冰箱保存备用。取血后即刻从鼠左心尖插入灌注针头至升主动脉(右心耳剪开),用止血钳固定,用预热37 ℃的生理盐水(0.9% NaCl)快速灌注,直到肝变白。取出小鼠脑组织分离皮层及海马,放入装有TRIzol RNA裂解液的研磨管,置于组织均质器中震荡均质1 min后吸取上清于-80 ℃冰箱保存备用。
1.2.4 Real-time PCR检测皮层和海马炎症因子于-80 ℃冰箱中取出备用的RNA裂解物,Eastep总RNA提取试剂盒提取总RNA。按Prime ScriptTM RT reagent Kit with gDNA Eraser试剂盒说明进行反转录合成cDNA。按KAPA SYBR FAST qPCR Kit试剂盒进行基因定量分析。20 μL反应体系:KAPA SYBR FAST qPCR Master Mix (2X) 10 μL,正义链(10 μmol/L)0.4 μL,反义链(10 μmol/L)0.4 μL,无RNAase水8.7 μL,cDNA溶液0.5 μL。实时荧光定量PCR仪上进行两步法扩增,扩增条件:95 ℃预变性3 min,40个循环反应:95 ℃ 3 s,59 ℃(TNF-α、IL-6和HPRT)或62 ℃(IL-1β和HPRT)20 s,引物序列及大小见表 1。每个样本设3个复孔。
| 基因 | 正义链(5′→3′) | 反义链(5′→3′) | 片段大小(bp) |
| TNF-α | GACCCTCACATCAGATCATCTTT | CCTCCACTTGGTGGTTTGCT | 80 |
| IL-1β | TGGTGTGTGACGTTCCCATTA | CAGCACGAGGCTTTTTTGTTG | 71 |
| IL-6 | ACAACCACGGCCTTCCCTACTT | CACGATTTCCCAGAGAACATGTG | 129 |
| HPRT | GTTAAGCAGTACAGCCCCAAA | AGGGCATATCCAACAACAAACTT | 131 |
1.2.5 动态浊度法检测血清中内毒素
取内毒素工作液标准品,加入检查用水,置旋涡混合器上2 800 r/ min振摇15 min后进一步稀释至2~10倍的稀释系列;按标示量加细菌内毒素检查用水于鲎试剂中,用手轻轻晃动使鲎试剂完全溶解;取除热原微板,在各孔中分别加入100 μL细菌内毒素检查用水、内毒素标准溶液、样品。将微板放置于鲎试仪中,37 ℃反应10 min。结束后,用移液器加入100 μL鲎试剂(避免产生气泡),置旋涡混合器上1 400 r/min振摇10 s混匀,用连续波长酶标仪在630 nm波长处,每30~60秒读1次,读板120 min。计算血清中内毒素。
1.2.6 ELISA检测血清炎症因子标本用标本稀释液1 :1稀释后,加入稀释好的标准品50 μL和待测样品于反应孔内,立即加入50 μL生物素标记的 抗体。盖上膜板,用手轻轻晃动混匀,37 ℃温育1 h。洗涤(甩去孔内液体,每孔加满洗涤液,置旋涡混合器上1 400 r/min振荡30 s,甩去洗涤液,于吸水纸上拍干。重复此操作3次),每孔加入80 μL亲和链酶素-HRP,用手轻轻晃动混匀,37 ℃温育30 min。再次洗涤(方法同上)。每孔加入底物各50 μL,用手轻轻晃动混匀,37 ℃ 温育10 min。避免光照。取出酶标板,迅速加入50 μL终止液,立即测定结果。用连续波长酶标仪测定各孔在450 nm波长处的吸光度值 [D(450)]。
1.3 统计学分析采用SPSS 13.0统计软件,计量资料以x±s表示,组间比较行t检验。
2 结果 2.1 正常对照组与热射病组小鼠生存率变化出舱后观察各组小鼠生存情况发现,正常对照组未出现死亡小鼠,热射病组在37、569、1 020 min各死亡1只。热射病小鼠出舱后24 h生存率78.57%。
2.2 正常对照组与热射病组小鼠直肠温度变化入舱后小鼠直肠温度迅速升高,舱内小鼠活动明显增加,出现躁动,至2 h左右直肠温度达(40.0±0.5) ℃后开始减缓,至3 h肛温达(40.5±0.5) ℃后升温再次加快,直肠温度达(42.4±0.2) ℃出舱,然后直肠温度在1~2 h内迅速下降到(28.0±1.5) ℃,再缓慢平稳恢复,至24 h稍高于正常对照组。正常对照组小鼠直肠温度在(37.0±1.5) ℃波动。见图 1。

|
| a:P<0.01,与正常对照组比较 A:模拟舱内,温度(41.2±0.5 ) ℃,相对湿度(60±2)%,禁水禁食;B:模拟舱外,温度(25.0±0.5 ) ℃,相对湿度 (60±2)%,自由饮水饮食 图 1:正常对照组及热射病组小鼠直肠温度的变化 |
2.3 各组小鼠体质量变化
取材时与入舱时体质量相减得到小鼠热射病后体质量丢失。热射病0、1、6、12、24 h组小鼠热射病后体质量丢失分别为(3.1±0.3)、(4.0±0.3)、(3.3±0.3)、(1.4±0.5)、(2.5±0.4)g,与正常对照组(0 g)比较,差异有统计学意义(P<0.01)。
2.4 正常对照组与热射病各组小鼠中枢神经炎症因子变化与正常对照组比较,热射病0 h组小鼠大脑皮层炎症因子TNF-α、IL-1β和IL-6表达差异无统计学意义(P>0.05),热射病1 h组迅速增加到最高(P<0.01),热射病6 h组亦高于正常对照组(P<0.01),热射病12 h组TNF-α、IL-1β与正常对照组比较差异有统计学意义(P<0.01),热射病24 h组基本恢复正常水平(P>0.05)。海马炎症因子与皮层变化基本一致,仅热射病12 h组IL-1β明显高于正常对照组(P<0.01),热射病24 h组恢复至正常水平(P>0.05,图 2)。
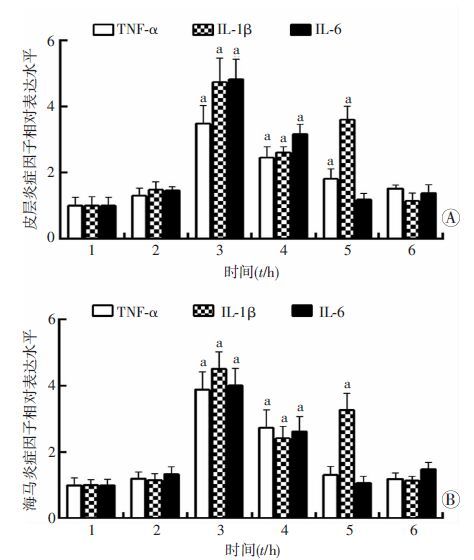
|
| 1:正常对照组;2~6:分别为热射病0、1、6、12、24 h组 A:皮层;B:海马 a:P<0.01,与正常对照组比较 图 2 Real-time PCR检测正常对照组及热射病各组小鼠大脑皮层和海马炎症因子变化 |
2.5 正常对照组与热射病各组小鼠血清炎症因子变化
与正常对照组比较,血清炎症因子TNF-α、IL-1β和IL-6在出舱即刻(0 h)便出现明显变化(P<0.01),热射病1 h组达到最高点,然后缓慢下降,热射病24 h组炎症因子仍明显高于正常对照组(P<0.01,图 3)。

|
| a:P<0.01,与正常对照组比较 1:正常对照组;2~6:分别为热射病0、1、6、12、24 h组 A:血清TNF-α浓度;B: 血清IL-1β浓度;C: 血清IL-6浓度 图 3 ELISA测定正常对照组及热射病各组小鼠血清炎症因子变化 |
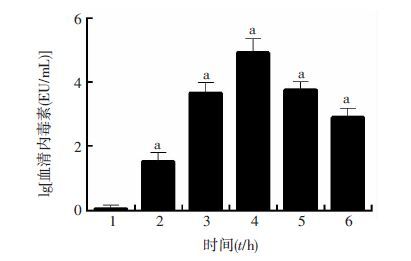
2.6 正常对照组与热射病各组小鼠血清内毒素变化
热射病0 h组血清内毒素出现显著变化(P<0.01),且达到峰值,之后开始缓慢下降,至热射病 24 h 组仍明显高于正常对照组(P<0.01,图 4)。
|
| 1:正常对照组;2~6:分别为热射病0、1、6、12、24 h组 a:P<0.01,与正常对照组比较 图 4 鲎试剂测定正常对照组及热射病各组小鼠血清内毒素变化 |
3 讨论
机体长时间暴露于高热环境会产生热射病,出现一系列精神神经症状,如乏力、瞻望、昏迷、脱水以及共济失调,严重者可致死亡[3]。因此,中枢神经损伤是热射病的主要特征之一。对于损伤机制既往很多学者认为高热可直接损伤细胞,致细胞膜稳定性下降、线粒体酶活性减低,导致脑细胞的死亡引起神经元坏死、脑组织水肿、昏迷等;还可影响浦肯野细胞功能,产生共济失调、震颤[2-3]。但近年有学者提出,热射病的发生并不完全是单纯高热直接引起,而是由于高热所引发的多种炎症因子发生级联放大的致炎作用,产生过度炎症反应,引起中枢神经组织损伤。
本实验中,小鼠暴露于(41.2±0.5)℃模拟舱 4 h,直肠温度达到(42.4±0.2) ℃,热射病小鼠出舱后,直肠温度在1~2 h内迅速降低,表现为热射病特有的低体温状态[4],之后缓慢平稳恢复,至24 h稍高于正常对照组。出舱后小鼠出现困乏、抽搐、昏睡等症状,且平均脱水2.78 g,达到体质量的9.55%,在24 h内热射病小鼠死亡率为21.43%,与文献[4]报道基本一致,说明本实验制备热射病小鼠模型成功。本研究发现热暴露后1 h小鼠皮层及海马脑组织的炎症因子TNF-α、IL-1β、IL-6基因表达显著增加,热暴露后6 h 及12 h大部分炎症因子仍维持高表达,但24 h后基本恢复至正常对照组水平。表明热射病小鼠出现一过性的中枢神经炎症。
SIRS可导致多器官功能衰竭(multiple organ dysfunction syndrome,MODS)[5-7],MODS可使脑、血液电解质、水平衡、肺、肝脏、胃肠道及肾等全身多个器官及系统出现功能障碍,这也是热射病死亡率比较高的一个重要原因[8-9]。本研究发现热暴露结束后即刻,血清中TNF-α、IL-1β、IL-6含量明显增加,到1 h后达到峰值,其后略有降低,但直到24 h仍显著高于正常对照组,表明热射病小鼠可出现明显的全身炎症反应,并可持续24 h。
分析热射病过程中MODS发生的原因,发现肠壁屏障功能受损可促进MODS的发生。肠道中含有多种细菌,而死亡裂解的细菌会释放内毒素。正常情况下少量通过肠壁入血的内毒素会通过门静脉被肝脏清除。热射病发生时高热引起肠壁屏障功能受损,肠道内大量内毒素释放入血,超过肝脏的清除能力,形成肠源性内毒素血症,引起血管扩张、补体激活、凝血障碍,促使炎症因子TNF-α、IL-1β、IL-6等释放,继而引起一系列炎症反应,产生组织和器官的损害[10-13]。Eshel等[14]对热射病动物取材观察发现小肠肠壁出血、黏膜及小肠绒毛出现缺失且伴随炎性细胞的浸润和腺体的破坏[15-17]。本实验检测热射病小鼠外周血中的内毒素含量发现,热射病组血清内毒素在0~6 h明显增加,在6 h达到高峰,24 h后仍明显高于正常对照组,这一变化趋势与血清炎症因子变化基本一致,提示热射病的全身炎症反应与肠道内毒素的入血相关。
热射病所致的中枢和外周的炎症关系尚不完全清楚。文献[17-18]报道血清内毒素与脑血管类疾病相关,通过血脑屏障的内毒素会引起脑组织炎症反应。本研究发现小鼠大脑皮层及海马的炎症因子TNF-α、IL-1β、IL-6的表达出现同步性,说明引发的炎症在脑组织产生广泛反应,而不是集中在特定某一区域。但本研究发现中枢和外周炎症因子TNF-α、IL-1β、IL-6的变化规律并不完全一致,中枢炎症反应主要发生在热暴露后1~12 h内,而外周炎症则为暴露结束后即刻持续至24 h,说明热暴露后12 h发生的外周炎症并没有激发或维持中枢神经炎症,并且血清内毒素含量的变化趋势与外周炎症基本一致,据此推测血清内毒素并没有通过血脑屏障进入中枢神经系统,引起中枢炎症。热射病后早期发生的这种一过性的中枢神经炎症,很有可能是由于高热导致部分神经细胞凋亡或坏死,死亡细胞刺激小胶质细胞激活产生促炎反应;其次,高热也可以直接刺激小胶质细胞活化,从而产生中枢神经炎症。活化的小胶质细胞既可以产生促炎反应,也可以分泌大量抑炎因子,限制中枢炎症的发展,从而表现为一过性的中枢炎症反应[17-19]。由此可认为热射病小鼠早期中枢炎症反应与外周炎症反应可能是相互独立发生。
本研究未做血脑屏障及肠道屏障通透性改变的检测,接下来将进一步研究屏障作用对炎症的影响,以探明中枢和外周炎症的关系。
| [1] | Leon L R, Dubose D A, Mason C W. Heat stress induces a biphasic thermoregulatory response in mice[J]. Am J Physiol Regul Integr Comp Physiol,2005, 288 (1) : 197 –204. DOI:10.1152/ajpregu.00046.2004 |
| [2] | Epstein Y, Roberts W O, Golan R, et al. Sepsis, septic shock, and fatal exertional heat stroke[J]. Curr Sports Med Rep,2015, 14 (1) : 64 –69. DOI:10.1249/JSR.0000000000000112 |
| [3] | Biedenkapp J C, Leon L R. Increased cytokine and chemokine gene expression in the CNS of mice during heat stroke recovery[J]. Am J Physiol Regul Integr Comp Physiol,2013, 305 (9) : 978 –986. DOI:10.1152/ajpregu.00011.2013 |
| [4] | Leon L R, Helwig B G. Heat stroke: role of the systemic inflammatory response[J]. J Appl Physiol,2010, 109 (6) : 1980 –1988. DOI:10.1152/japplphysiol.00301.2010 |
| [5] | Dehbi M, Uzzaman T, Baturcam E, et al. Toll-like receptor 4 and high-mobility group box 1 are critical mediators of tissue injury and survival in a mouse model for heatstroke[J]. PLoS ONE,2012, 7 (9) : e44100 . DOI:10.1371/journal.pone.0044100 |
| [6] | Helwig B G, Leon L R. Tissue and circulating expression of IL-1 family members following heat stroke[J]. Physiol Genomics,2011, 43 (19) : 1096 –1104. DOI:10.1152/physiolgenomics.00076.2011 |
| [7] | Leon L R, Blaha M D, Dubose D A. Time course of cytokine, corticosterone, and tissue injury responses in mice during heat strain recovery[J]. J Appl Physiol,2006, 100 (4) : 1400 –1409. DOI:10.1152/japplphysiol.01040.2005 |
| [8] | Huisse M G, Pease S, Hurtado-Nedelec M, et al. Leukocyte activation: the link between inflammation and coagulation during heatstroke. A study of patients during the 2003 heat wave in Paris[J]. Crit Care Med,2008, 36 (8) : 2288 –2295. DOI:10.1097/CCM.0b013e318180dd43 |
| [9] | Fan H, Zhu J H, Ye J H. Cold Hemodiafiltration for Exertional Heat Stroke Resulting in Multiple Organ Failure[J]. Ther Apher Dial,2015, 19 (5) : 522 . DOI:10.1111/1744-9987.12312 |
| [10] | Carrico C J, Meakins J L, Marshall J C, et al. Multiple-organ-failure syndrome[J]. Arch Surg,1986, 121 (2) : 196 –208. DOI:10.1001/archsurg.1986.01400020082010 |
| [11] | Bouchama A, Roberts G, Al-Mohanna F. Inflammatory, hemostatic, and clinical changes in a baboon experimental model for heatstroke[J]. J Appl Physiol,2005, 98 (2) : 697 –705. DOI:10.1152/japplphysiol.00461.2004 |
| [12] | Liu Z, Sun X, Tang J, et al. Intestinal inflammation and tissue injury in response to heat stress and cooling treatment in mice[J]. Mol Med Rep,2011, 4 (3) : 437 –443. DOI:10.3892/mmr.2011.461 |
| [13] | Phillips N A, Welc S S, Wallet S M, et al. Protection of intestinal injury during heat stroke in mice by interleukin-6 pretreatment[J]. J Physiol,2015, 593 (3) : 739 –775. DOI:10.1113/jphysiol.2014.283416 |
| [14] | Eshel G M, Safar P, Stezoski W. The role of the gut in the pathogenesis of death due to hyperthermia[J]. Am J Forensic Med Pathol,2001, 22 (1) : 100 –104. DOI:10.1097/00000433-200103000-00022 |
| [15] | Lin C Y, Hsu C C, Lin M T, et al. Flutamide, an androgen receptor antagonist, improves heatstroke outcomes in mice[J]. Eur J Pharmacol,2012, 688 (1-3) : 62 –67. DOI:10.1016/j.ejphar.2012.05.002 |
| [16] | Lin C Y, Lin M T, Cheng R T, et al. Testosterone depletion by castration may protect mice from heat-Induced multiple organ damage and lethality[J]. J Biomed Biotechnol,2010 : 485306 . DOI:10.1155/2010/485306 |
| [17] | Shen K H, Lin C H, Chang H K, et al. Premarin can act via estrogen receptors to rescue mice from heatstroke-induced lethality[J]. SHOCK,2008, 30 (6) : 668 –674. DOI:10.1097/SHK.0b013e31817538cb |
| [18] | Chen G M, Xu H N, Gao L F. Effects of continuous haemofiltration on serum enzyme concentrations, endotoxemia, homeostasis and survival in dogs with severe heat stroke[J]. Resuscitation,2012, 83 (5) : 657 –662. DOI:10.1016/j.resuscitation.2011.11.003 |
| [19] | 易均凤, 何根林, 杨学森, 等. 热习服对热射病小鼠中枢神经细胞自噬及凋亡的影响[J]. 第三军医大学学报,2015, 37 (11) : 1059 –1063. DOI:10.16016/j.1000-5404.201502011 |



