蚊是疟疾、登革热、丝虫病、黄热病等多种疾病的传播媒介,其中斯氏按蚊是东南亚地区主要的传疟媒介[1]。全球受疟疾威胁的人口超过30亿,每年约有2.14亿人感染疟疾,死亡人数超过40万,绝大多数发生在非洲5岁以下的儿童,是导致非洲儿童死亡的主要传染病之一[2]。因此,蚊媒控制是疟疾防治的重要措施之一[3-4]。化学杀虫剂在蚊虫防治中发挥了重要作用,但长期大量的使用,不仅导致蚊虫产生抗药性,同时存在对人畜有害和对环境污染、滞留等问题[5-7]。因此不得不探索其他更安全有效的蚊虫防治措施,其中利用球形芽孢杆菌(Bacillus sphaericus,Bs)等生物杀虫剂具有明显的优势,在蚊虫防治中的应用越来越广泛。然而,对于Bs的应用基础研究远远不够,尤其对Bs使用的后续效应尚少见相关研究报道。本研究在前期研究[8]基础上,利用亚致死剂量Bs对斯氏按蚊幼虫进行处理,然后利用约氏疟原虫对其进行攻击感染,比较Bs处理组和正常对照组的疟原虫感染率和感染度,探讨生物杀虫剂Bs对斯氏按蚊传疟能力的影响,旨在了解生物杀虫剂使用后的风险,为生物杀虫剂的推广应用提供参考,为通过蚊虫防制阻断疟疾传播提供新思路。
1 材料与方法 1.1 材料斯氏按蚊(Anopheles stephensi)Hor株,从第三军医大学基础医学部病原生物学教研室引入,由本室常规饲养并保种。约氏疟原虫(Plasmodium yoelii)BY265 RFP荧光株由第三军医大学基础医学部病原生物学教研室馈赠。昆明株小鼠由第三军医大学实验动物中心提供,雌雄各半,体质量16~20 g。球型芽孢杆菌2362株(Bs):水分散颗粒剂,效价为650 IU/mg,由湖北康欣农用药业有限公司生产并提供。
1.2 方法 1.2.1 斯氏按蚊饲养方法采用人工昼夜节律(暗室12 h/光照12 h),在温度28 ℃、相对湿度80%的养蚊室中饲养。幼虫的龄期根据幼虫头的宽度和幼虫大小将其分为Ⅰ、Ⅱ、Ⅲ、Ⅳ龄,其中Ⅰ龄和Ⅱ龄幼虫每天适量喂食1次,Ⅲ龄和Ⅳ龄幼虫每天适量喂食2次。幼虫化蛹后每天吸入小碗内,置于蚊笼中羽化。成蚊喂饲10%糖水。
1.2.2 实验分组和按蚊准备实验分为正常对照组和Bs处理组两组。正常对照组和Bs处理组各随机挑选500条斯氏按蚊Ⅳ龄幼虫置于5只搪瓷盘中(100条/盘),各盘中分别加入1 000 mL去氯自来水。根据本课题组前期研究[8]结果,Bs处理组的各 搪瓷盘中分别加入亚致死剂量Bs制剂(LC50=0.015 mg/L),轻摇混匀,随后正常饲喂。正常对照组不加Bs制剂。每天观察幼虫死亡情况,收集存活幼虫,待羽化后备用。
1.2.3 感染小鼠准备从液氮中取出保种的BY265 RFP荧光株,室温融化后腹腔注射(400 μL/只)感染昆明小鼠;3 d后取少量尾尖血做血涂片,吉姆萨染色,计算原虫密度(红细胞密度按均值8.5×106)。选择原虫密度在5%~15%的小鼠进行传代。以2×106原虫/小鼠的剂量分别感染10只昆明小鼠。3 d后取尾尖血涂片,检查原虫率,根据涂片中配子体的情况判断感染小鼠是否适合饲蚊。每4个视野中至少有1个成熟配子体时,小鼠即可饲蚊。
1.2.4 按蚊感染吸血感染前,取出斯氏按蚊(3~5 d龄)蚊笼内的糖水,进行饥饿处理12 h以上。选取原虫密度和配子体情况相近的2只昆明小鼠,固定后放入蚊笼中供按蚊吸血;每隔30 min对调1次,吸血3 h后即可取出小鼠。饲血后,乙醚轻微麻醉,分离出雌性饱血斯氏按蚊(去除未吸血按蚊及雄蚊),随后常规饲养。饲养环境为温度24 ℃、相对湿度80%。
1.2.5 检查疟原虫感染情况斯氏按蚊雌蚊吸血后9 d,在体视显微镜下解剖两组按蚊。将取出的蚊胃置于滴有生理盐水的载玻片上,盖上盖玻片后轻轻按压,用吸水纸吸掉盖玻片周围多余的水。在荧光显微镜下观察并统计卵囊数量,比较两组之间疟原虫的感染率和感染度。
1.3 统计学分析采用Sigma 3.5统计软件和GraphPad Prism 6.0统计软件进行数据处理和绘图,两组间感染率比较行χ2检验;两组间感染度比较行t检验(符合正态分布)或Mann-Whitney 检验(不符合正态分布),P<0.05表示差异有统计学意义。
2 结果 2.1 约氏疟原虫感染情况小鼠腹腔注射接种约氏疟原虫BY265 RFP荧光株后3 d,尾尖取血涂片染色镜检结果显示,种鼠和供血小鼠均感染约氏疟原虫,且供血小鼠体内可见疟原虫配子体(图 1A、B)。斯氏按蚊饲血后9 d,解剖蚊胃,普通光镜下可见蚊胃基底膜上有大量圆形卵囊,在荧光显微镜下,疟原虫卵囊发红色荧光(图 1C、D)。表明小鼠以及按蚊均成功感染约氏疟原虫。
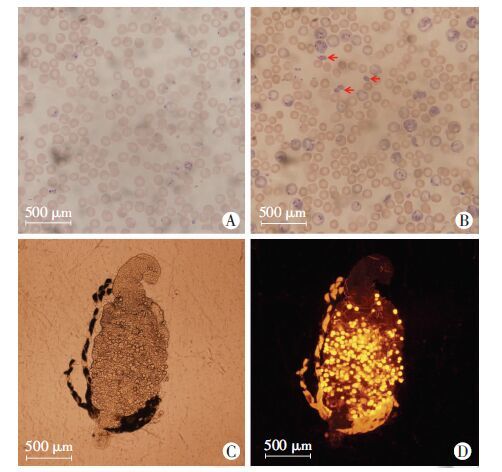
|
| A:种鼠尾静脉血涂片吉姆萨染色;B:供饲血小鼠尾静脉血涂片吉姆萨染色,红色箭头示配子体;C:普通光镜观察斯氏按蚊胃基底膜上的卵囊;D:荧光显微镜观察斯氏按蚊胃基底膜上的卵囊 图 1 约氏疟原虫感染情况观察 |
2.2 饱血按蚊分离结果
斯氏按蚊喂饲约氏疟原虫感染血24 h后,分离饱血按蚊(表 1):正常对照组分离获得饱血雌蚊232只,Bs处理组分离获得饱血雌蚊221只,按蚊饱血率均超过80%,故本次按蚊饲血较成功。
2.3 斯氏按蚊经亚致死剂量Bs处理后卵囊发育情况
感染后9 d,解剖斯氏按蚊胃,计数并统计感染情况。感染率统计结果(表 2)显示,Bs处理组感染率(97.6%)高于正常对照组(92.1%)。χ2检验结果显示自由度为1,χ2=6.50,P=0.011,即两者的差异有统计学意义。利用Mann-Whitney检验对感染度进行统计分析,结果显示Bs处理组的感染度(84.19±75.64)明显高于正常对照组(56.69±69.29),差异有统计学意义(P<0.01,图 2)。提示亚致死剂量Bs处理显著提高了斯氏按蚊对约氏疟原虫的感染率和感染度,增加了按蚊的传疟能力。
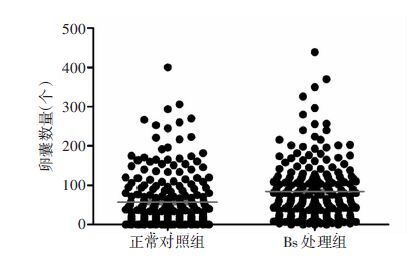
|
| Mann-Whitney检验:P<0.01 图 2 亚致死剂量球形芽孢杆菌处理对约氏疟原虫在斯氏按蚊体内发育的影响 |
3 讨论
蚊虫防治作为虫媒病的重要防治策略[9],一直以来都是疾病防控工作中的重要内容。生物杀虫剂具有高效、低毒、与环境相容性好和安全性强等特点[10],目前越来越受到人们的青睐。其对蚊幼虫的杀伤机制主要是基于其分泌的毒性蛋白通过配体受体的方式与蚊肠上皮细胞结合,破坏上皮细胞,导致蚊幼虫的死亡[11]。Bs是一种在自然界广泛分布、形成亚末端膨大孢子囊和球形芽孢的好气芽孢杆菌。其生长发育过程中能产生两类不同毒素蛋白,一类是存在于所有高毒力菌株中的晶体毒素蛋白[12],另一类是存在于低毒力菌株及部分高毒力菌株中的Mtx毒素蛋白[13]。与苏云金芽孢杆菌相比,Bs的杀蚊谱较窄,在污水中的药效维持时间较长,死亡幼虫体内的Bs能够循环利用。Bs制剂与其他灭蚊制剂和措施的联合应用,可产生协同作用,扩大杀蚊谱,延长药物维持时间,提高杀灭疗效,并预防或延缓蚊幼虫对Bs产生抗性。在蚊虫防治中效果理想[14-15]。
随着生物杀虫剂的不断推广应用,出现了一些负面消息,如抗药性的产生等[16-17]。科学家在抗药性方面投入了大量的研究[18-19],却忽略了Bs等生物杀虫剂的应用基础研究,如生物杀虫剂对存活蚊虫生物特性的影响等。在实际应用中常出现剂量不足、未按时补加药物,以及环境、温度及水质发生急剧变化等情况,会导致杀虫效果降低,部分按蚊在接触生物杀虫剂后得以存活。这种亚致死剂量生物杀虫剂的施用对目标按蚊造成了人为的选择压力,加之生物杀虫剂的接触可能对存活下来的按蚊肠黏膜造成一定损伤,对按蚊肠道菌群的稳定和基础免疫力的水平也可能造成一定影响,最终可能导致存活按蚊免疫和生理状态及肠道微环境发生改变,从而影响疟原虫在按蚊肠道内的发育和入侵,改变按蚊的传疟能力。斯氏按蚊作为东南亚地区重要的传疟媒介,其传疟能力的高低是影响疟疾流行的重要因素。本研究为实际应用中生物杀虫剂的不合理使用敲响了警钟。
本研究利用亚致死剂量生物杀虫剂Bs处理斯氏按蚊幼虫,获得Bs处理按蚊,通过疟原虫攻击感染,观察斯氏按蚊对约氏疟原虫的感染率和感染度,探讨Bs处理是否会对按蚊的传疟能力产生影响。本研究结果显示,Bs处理组按蚊对疟原虫的感染率高达97.6%,明显高于正常对照组(92.1%),χ2检验表明两者差异有统计学意义(P<0.05)。同时,Bs处理组斯氏按蚊对疟原虫的感染度亦高于正常对照组(P<0.05)。因此,亚致死剂量的Bs处理提高了斯氏按蚊对疟原虫的感染率,增强了斯氏按蚊对疟原虫的感染度,导致传疟能力显著增强。本研究结果提示,在Bs的实际应用中,务必做到科学合理,避免亚致死剂量效果的出现。尽管亚致死剂量的Bs仍能在一定程度上降低蚊虫密度,但同时增强了斯氏按蚊的传疟能力,这将不利于疟疾的控制。本研究发现的按蚊传疟能力改变的具体机制尚不清楚,可能与按蚊的生理状态、基础免疫力的改变和肠道菌群等有关,本课题组正在着力于该机制的研究。
| [1] | Bennink S, Kiesow M J, Pradel G. The development of malaria parasites in the mosquito midgut[J]. Cell Microbiol,2016, 18 (7) : 905 –918. DOI:10.1111/cmi.12604 |
| [2] | WH Organization. World Malaria Report 2015[J]. Working Papers,2015, 30 (82) : 189 –192. |
| [3] | Hodson C N, Yu Y, Plettner E, et al. New repellent effective against African malaria mosquito Anopheles gambiae: implications for vector control[J]. Med Vet Entomol,2016, 30 (4) : 369 –376. DOI:10.1111/mve.12188 |
| [4] | Benelli G, Mehlhorn H. Declining malaria, rising of dengue and Zika virus: insights for mosquito vector control[J]. Parasitol Res,2016, 115 (5) : 1747 –1754. DOI:10.1007/s00436-016-4971-z |
| [5] | Quinones M L, Norris D E, Conn J E, et al. Insecticide Resistance in Areas Under Investigation by the International Centers of Excellence for Malaria Research: A Challenge for Malaria Control and Elimination[J]. Am J Trop Med Hyg,2015, 93 (3 Suppl) : 69 –78. DOI:10.4269/ajtmh.14-0844 |
| [6] | Bustamante G M, Goncalves D L, Gorla D E. Distribution of Pyrethroid Resistant Populations of Triatoma infestans in the Southern Cone of South America[J]. PLoS Negl Trop Dis,2016, 10 (3) : e4561 . DOI:10.1371/journal.pntd.0004561 |
| [7] | Mulamba C, Riveron J M, Ibrahim S S, et al. Widespread pyrethroid and DDT resistance in the major malaria vector Anopheles funestus in East Africa is driven by metabolic resistance mechanisms[J]. PLoS One,2014, 9 (10) : e110058 . DOI:10.1371/journal.pone.0110058 |
| [8] | 于莎莎, 王英, 艾国平, 等. 球型芽孢杆菌2 362株对两种按蚊幼虫杀伤效果的比较研究[J]. 中国热带医学,2013 (10) : 1177 –1180. |
| [9] | Li N, Parker D M, Yang Z, et al. Risk factors associated with slide positivity among febrile patients in a conflict zone of north-eastern Myanmar along the China-Myanmar border[J]. Malar J,2013, 12 (1) : 1 –8. DOI:10.1186/1475-2875-12-361 |
| [10] | Mittal P K. Biolarvicides in vector control: challenges and prospects[J]. J Vector Borne Dis,2003, 40 (1-2) : 20 –32. |
| [11] | Charles J F, Nielsen-Leroux C. Mosquitocidal bacterial toxins: diversity, mode of action and resistance phenomena[J]. Mem Inst Oswaldo Cruz,2000, 95 (Suppl 1) : 201 –206. |
| [12] | Smith A W, Camara-Artigas A, Allen J P. Crystallization of the mosquito-larvicidal binary toxin produced by Bacillus sphaericus[J]. Acta Crystallogr D Biol Crystallogr,2004, 60 (Pt 5) : 952 –953. DOI:10.1107/S0907444904006535 |
| [13] | Carpusca I, Jank T, Aktories K. Bacillus sphaericus mosquitocidal toxin (MTX) and pierisin: the enigmatic offspring from the family of ADP-ribosyltransferases[J]. Mol Microbiol,2006, 62 (3) : 621 –630. DOI:10.1111/j.1365-2958.2006.05401.x |
| [14] | Subramaniam J, Kovendan K, Mahesh K P, et al. Mosquito larvicidal activity of Aloe vera (Family: Liliaceae) leaf extract and Bacillus sphaericus, against Chikungunya vector, Aedes aegypti[J]. Saudi J Biol Sci,2012, 19 (4) : 503 –509. DOI:10.1016/j.sjbs.2012.07.003 |
| [15] | Schlein Y, Muller G C. Decrease of larval and subsequent adult Anopheles sergentii populations following feeding of adult mosquitoes from Bacillus sphaericus-containing attractive sugar baits[J]. Parasit Vectors,2015, 8 (1) : 1 –7. DOI:10.1186/s13071-015-0845-y |
| [16] | Ranson H, Lissenden N. Insecticide Resistance in African Anopheles Mosquitoes: A Worsening Situation that Needs Urgent Action to Maintain Malaria Control[J]. Trends Parasitol,2016, 32 (3) : 187 –196. DOI:10.1016/j.pt.2015.11.010 |
| [17] | Poopathi S, Thirugnanasambantham K, Mani C, et al. Hexamerin a novel protein associated with Bacillus sphaericus resistance in Culex quinquefasciatus[J]. Appl Biochem Biotechnol,2014, 172 (5) : 2299 –2307. DOI:10.1007/s12010-013-0681-5 |
| [18] | Paris M, Tetreau G, Laurent F, et al. Persistence of Bacillus thuringiensis israelensis (Bti) in the environment induces resistance to multiple Bti toxins in mosquitoes[J]. Pest Manag Sci,2011, 67 (1) : 122 –128. DOI:10.1002/ps.2046 |
| [19] | Stalinski R, Tetreau G, Gaude T, et al. Pre-selecting resistance against individual Bti Cry toxins facilitates the development of resistance to the Bti toxins cocktail[J]. J Invertebr Pathol,2014, 119 (119) : 50 –53. DOI:10.1016/j.jip.2014.04.002 |



