动脉粥样硬化(atherosclerosis,AS)是心血管疾病的病理基础,已成为全世界的主要致死病因[1],其在我国的发病率也成逐年上升的趋势。AS是一种慢性炎症性血管疾病,氧化损伤-炎性反应学说认为氧化应激损伤血管内皮细胞是AS的发生的始动因素,而炎性反应促进AS的发生和发展[2]。细胞焦亡(pyroptosis)是一种程序性炎性细胞坏死,其发生依赖于半胱天冬酶-1(caspase-1),并伴有大量促炎症因子的释放,其形态特征及调控机制不同于细胞坏死(necrosis),焦亡细胞出现核DNA片段化,并依赖于caspase-1的激活,也不似于细胞凋亡(apoptosis)形成凋亡小体,焦亡细胞细胞膜完整性消失,形成孔隙(1~2 nm)[3],促进细胞器及细胞质肿胀破裂、细胞内容物释放到胞外引起局部炎症反应。研究表明,细胞焦亡广泛参与感染性疾病、神经系统相关疾病,2型糖尿病和动脉粥样硬化性疾病[4]等的发生发展,有报道称细胞焦亡参与动脉粥样硬化形成并且影响斑块的稳定性[5]。棕榈酸(palmitic acid)是人体血浆中含量最多的一种游离脂肪酸,可促进内皮细胞活性氧的产生[6, 7],诱导骨骼肌胰岛素抵抗、葡萄糖摄取障碍[8]和肝细胞脂肪变性[9]等,研究发现棕榈酸通过诱导人胎盘细胞活性氧的产生进而激活caspase-1[10],亦可增强肝细胞活性氧的产生进激活caspase-1[11],由此推测棕榈酸也能通过活化caspase-1进而诱导血管内皮细胞发生焦亡。
二氢杨梅素(dihydromyricetin)是藤茶等植物茎叶中提取的一种二氢黄酮醇类化合物,在藤茶中含量极为丰富(25%左右)[12],具有清除自由基,保肝,抗炎症,抗肿瘤等生物活性,据报道二氢杨梅素能够剂量依赖地抑制脂多糖诱导RAW264.7细胞释放NO和促炎因子如白介素1β、白介素6以及肿瘤坏死因子-α,并有效抑制脂多糖诱导的诱导型一氧化氮合酶(iN0S)的表达,进而发挥抗炎抗氧化作用[13],因此我们推测二氢杨梅素对棕榈酸诱导的内皮细胞炎性死亡也具有重要作用。本研究以人血管内皮细胞为研究对象,旨在探讨二氢杨梅素对棕榈酸诱导的人血管内皮细胞焦亡的影响,并揭示其可能的作用机制。
1 材料与方法 1.1 材料人血管内皮细胞株EA. hy926购自美国ATCC。二氢杨梅素购于成都曼斯特生物技术有限公司(溶于 二甲基亚砜DMSO,配成1 mmol/L的储备液)。DMEM 培养基和胰蛋白酶为美国Gibco公司产品;胎牛血清 购自美国HyClone公司。棕榈酸、二甲基亚砜(DMSO)、 碘化丙啶(PI)购自美国Sigma公司。细胞增殖及细胞毒性检测试剂盒Cell counting kit-8(CCK-8)试剂盒购于日本同仁化学研究所。乳酸脱氢酶细胞毒性检测试剂盒(CytoTox 96 Non-Radioactive Cytotoxicity Assay kit)购于美国Promega公司。兔抗人caspase-1抗体购自美国Novus公司。兔抗人白介素1β(Interleukine-1 beta,IL-1β)抗体购自美国 Cell Signaling Technology公司。Caspase-1活性检测试剂盒购自碧云天生物技术有限公司。鼠抗人细胞间黏附分子-1(Intercellular Adhesion Molecule 1,ICAM-1)抗体购自美国Santa Cruz公司。兔抗人β-actin抗体购自北京中杉金桥公司。
1.2 细胞培养EA. hy926细胞用含体积分数10% 胎牛血清的高糖DMEM培养基于37 ℃、5% CO2、100%饱和湿度培养,当细胞融合达80%~90%时,用胰蛋白酶消化传代。
1.3 细胞增殖活力测定取对数增长期的EA. hy926细胞以每孔100 μL接种于96孔板中,细胞密度 1×104/孔。接种24 h细胞贴壁后,以不同浓度(10、100、200、300、400、500 μmol/L)棕榈酸处理,并设置背景对照组,及正常 对照组,每组各设置6个平行。处理24 h后,用CCK-8 评估细胞增殖活力,即每孔加入10 μL CCK-8溶液,再培养1.5 h,用酶标仪在450 nm处测定各组细胞的吸光度值。以正常对照组细胞增殖活力减去背景对照组细胞增殖活力为100%,其他各组细胞增殖活力={[处理组D(450)-背景对照组D(450)]/[正常对照组D(450)-背景对照组D(450)]}×100%。以同样的方法检测不同浓度(0.1、0.5、1 μmol/L)二氢杨梅素预处理12 h后再以棕榈酸(200 μmol/L)作用24 h的细胞增殖活力。
1.4 乳酸脱氢酶释放水平检测取对数增长期的EA. hy926细胞以1×104/孔的密度接种于96孔板,每孔100 μL。接种24 h细胞贴壁后,以不同浓度(10、100、200、300、400 μmol/L)棕榈酸处理24 h,同时设立背景对照组及正常对照组。培养结束后,根据试剂盒操作步骤加入试剂,最后酶标仪检测光密度值,波长为490 nm。以同样的方法检测不 同浓度(0.1、0.5、1.0 μmol/L)二氢杨梅素预处理12 h 后再以棕榈酸(200 μmol/L)作用24 h的细胞毒性。
1.5 caspase-1 活性检测取对数增长期的EA. hy926细胞以1×106/孔的密度接种于6孔板,每孔2 mL。培养24 h贴壁,以不同浓度(0、10、100、200 μmol/L)棕榈酸处理24 h。处理结束之后,根据试剂盒说明书测定caspase-1活性,同时采用BCA法测定各自蛋白浓度,据此计算单位重量蛋白中所含的caspase-1的酶活力单位。以同样的方法检测不同浓度(0.1、0.5、1.0 μmol/L)二氢杨梅素预处理12 h后再以棕榈酸(200 μmol/L)作用24 h的细胞caspase-1活性。
1.6 PI染色取对数生长期的EA. hy926细胞接种于铺有盖玻片的24孔板,不同组药物处理之后,用37 ℃预热过的PBS洗两次,加入PBS配制的PI(5 ng/mL)染液,37 ℃ 避光孵育30 min;孵育结束后,用37 ℃预热的PBS洗 两次,吸弃多余的液体,再利用抗荧光猝灭封片剂Dako 封片,最后利用荧光显微镜观察,并拍照保存。
1.7 Western blot消化收集细胞,提取总蛋白,利用BCA法进行蛋白定量。根据蛋白浓度,以40 μg蛋白煮沸变性后,15%(质量分数)聚丙烯酰胺凝胶电泳,用湿性转膜法将蛋白转移至PVDF膜上。5%的脱脂奶粉(TBST配制)封闭2 h,用一抗稀释液1 :1000比例稀释的兔抗人caspase-1、兔抗人IL-1β、鼠抗人ICAM-1、兔抗人β-actin一抗4 ℃孵育过夜,TBST振摇洗膜3次,各10 min,加入1 :5 000稀释的羊抗兔辣根过氧化酶标记的二抗,室温振荡孵育1 h,TBST振摇洗膜3次后,加入化学发光液,采用 VILBER FUSION FX7成像系统自动曝光。利用Quantity One软件进行条带分析。
1.8 统计学分析以x±s表示计量数据,应用GraphPad Prism 6软件对两组间数据进行t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 棕榈酸对内皮细胞形态的影响正常EA. hy 926细胞呈梭形、椭圆形,细胞贴壁生长,呈“铺路石”状整齐镶嵌排列,胞膜完整并有明显折光性,增殖状态良好。浓度为10 μmol/L的棕榈酸处理24 h,细胞形态开始发生变化,细胞膨胀,部分脱壁死亡;当棕榈酸浓度高于100 μmol/L后,细胞发生明显的形态学改变,细胞形态不规则,膨胀变型破裂,胞膜折光性变弱,胞核浓缩,并见明显的死亡细胞及细胞碎片(图 1)。
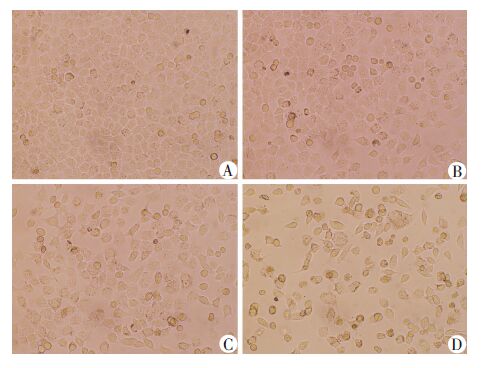
|
| A:空白对照组;B-D:分别为10、100、200 μmol/L 棕榈酸处理组 图 1 不同浓度棕榈酸处理EA. hy 926细胞24 h后的形态变化(倒置显微镜 ×200) |
2.2 棕榈酸对内皮细胞增殖活力及乳酸脱氢酶释放水平的影响
在较低浓度(≤10 μmol/L)棕榈酸处理时,棕榈酸对内皮细胞活力及乳酸脱氢酶(lactate dehydrogenase)释放水平的影响不明显(P>0.05,图 2A、B),并且当棕榈酸低于10 μmol/L时,与对照组相比,细胞活力有增高趋势,而乳酸脱氢酶释放水平有轻微的下降趋势,这可能是因为细胞处于一种应激保护状态;在较高处理浓度时(≥100 μmol/L)时,与对照组相比,内皮细胞活力明显下降(P<0.05),相对应的乳酸脱氢酶释放水平明显增强。当棕榈酸浓度为200 μmol/L时,与对照组相比,细胞活力下降约60%,乳酸脱氢酶释放水平增加了约25.5%。棕榈酸(≥100 μmol/L)处理导致PI染色增加(图 2C)。
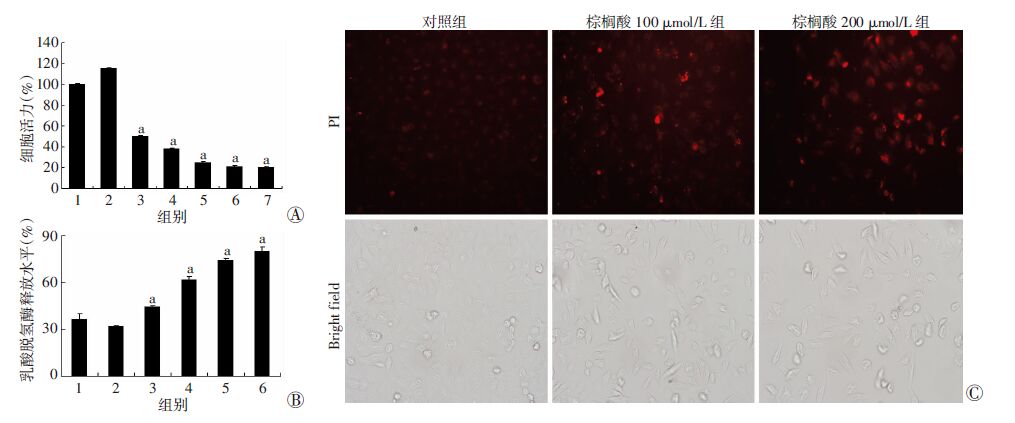
|
| 1:对照组;2~7:分别为10、100、200、300、400、500 μmol/L棕榈酸处理组; a:P<0.05,与空白对照组比较 A:CCK-8检测不同浓度棕榈酸对EA. hy 926细胞活力的影响;B:CytoTox 96检测不同浓度棕榈酸对EA. hy 926细胞乳酸脱氢酶释放水平的影响;C:荧光显微镜观察不同浓度棕榈酸处理EA.hy 926细胞后PI染色的情况 图 2 不同浓度棕榈酸对EA. hy 926细胞活力、乳酸脱氢酶释放水平及PI染色的影响 |
2.3 棕榈酸对内皮细胞caspase-1活性的影响
在较低浓度(≤100 μmol/L)棕榈酸处理时,棕榈酸对内皮细胞caspase-1活性没有明显影响。但当棕榈酸浓度为200 μmol/L以上时,caspase-1活性明显增强(P<0.05,图 3),说明棕榈酸能明显增强caspase-1活性。
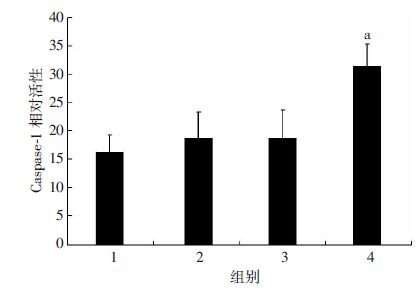
|
| 1:对照组;2~4:分别为10 、100、200 μmol/L棕榈酸处理组; a:P<0.05,与空白对照组比较 图 3 不同浓度棕榈酸对EA. hy 926细胞caspase-1 活性的影响 |
2.4 棕榈酸对内皮细胞caspase-1、IL-1β及ICAM-1蛋白表达的影响
与对照组相比,在较低浓度(≤10 μmol/L)棕榈酸处理时,caspase-1、IL-1β及ICAM-1蛋白表达变化不明显(P>0.05)。而当棕榈酸浓度高于100 μmol/L时,caspase-1、IL-1β及ICAM-1表达显著增加(P<0.05),并呈剂量依赖关系。
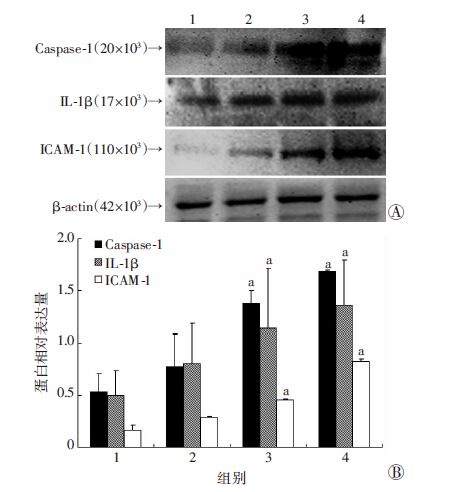
|
| 1:对照组;2~3:分别为10、100、200 μmol/L棕榈酸组; a:P<0.05,与空白对照组比较 A:Western blot检测caspase-1、IL-1β及ICAM-1蛋白表达;B:半定量分析 图 4 Western blot检测不同浓度棕榈酸对EA. hy 926细胞caspase-1、IL-1β及ICAM-1蛋白表达的影响 |
2.5 二氢杨梅素对棕榈酸诱导的内皮细胞增殖活力下降及乳酸脱氢酶释放的影响
如图 5所示,与对照组相比,棕榈酸(200 μmol/L)处理可以显著抑制细胞活力(P<0.05,图 5A),同时增强乳酸脱氢酶释放水平(P<0.05,图 5B);不同浓度(0.1、0.5、1 μmol/L)二氢杨梅素预处理后再以棕榈酸(200 μmol/L)处理后发现,与棕榈酸(200 μmol/L)单独处理相比,细胞活力明显增加(P<0.05,图 5A),同时乳酸脱氢酶释放水平明显减少(P<0.05,图 5B)。
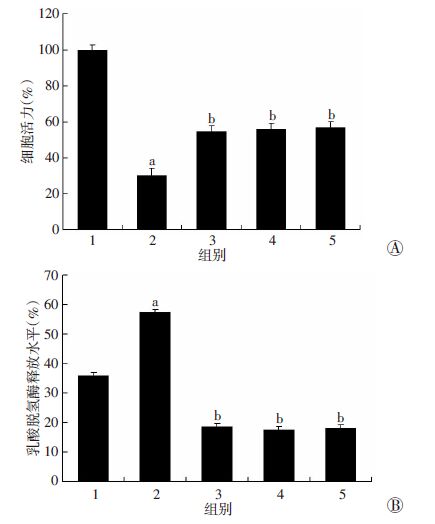
|
| 1:对照组;2:200 μmol/L棕榈酸处理组;3:0.1 μmol/L二氢杨梅素+200 μmol/L棕榈酸处理组;4:0.5 μmol/L二氢杨梅素+200 μmol/L棕榈酸处理组;5:1 μmol/L二氢杨梅素+200 μmol/L棕榈酸处理组; a:P<0.05,与空白对照组比较;b:P<0.05,与棕榈酸(200 μmol/L)处理组比较; A:CCK-8检测各组EA. hy 926细胞活力;B:CytoTox 96检测各组EA. hy 926细胞乳酸脱氢酶释放水平 图 5 二氢杨梅素对棕榈酸处理的EA. hy 926细胞活力及乳酸脱氢酶释放水平的影响 |
2.6 二氢杨梅素对棕榈酸刺激引起的内皮细胞caspase-1活性的影响
与对照组相比,棕榈酸处理可以显著增加caspase-1活性(P<0.05);而与棕榈酸(200 μmol/L)单独处理相比,不同浓度(0.1、0.5、1 μmol/L)二氢杨梅素预处理可明显降低caspase-1活性(P<0.05,图 6)。

|
| 1:对照组;2:200 μmol/L棕榈酸处理组;3:0.1 μmol/L二氢杨梅素+200 μmol/L棕榈酸处理组;4:0.5 μmol/L二氢杨梅素+200 μmol/L棕榈酸处理组;5:1 μmol/L二氢杨梅素+200 μmol/L棕榈酸处理组;a:P<0.05,与空白对照组比较;b:P<0.05,与棕榈酸(200 μmol/L)处理组比较 图 6 二氢杨梅素对棕榈酸处理的EA. hy 926细胞 Caspase-1活性的影响 |
2.7 二氢杨梅素对棕榈酸刺激引起的内皮细胞caspase-1、IL-1β及ICAM-1蛋白表达的影响
与对照组相比,棕榈酸(200 μmol/L)处理可以显著增加caspase-1、IL-1β及ICAM-1蛋白表达水平(P<0.05)。不同浓度(0.1、0.5、1 μmol/L)二氢杨梅素预处 理组,与棕榈酸单独处理相比,可明显抑制细胞caspase-1、 IL-1β及ICAM-1的蛋白表达(P<0.05,图 7)。
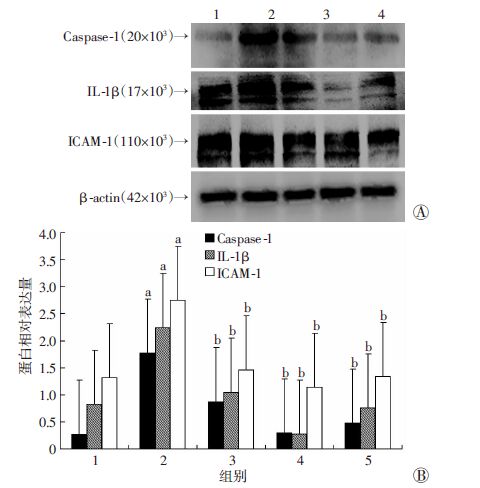
|
| 1:对照组;2:200 μmol/L棕榈酸处理组;3:0.1 μmol/L二氢杨梅素+200 μmol/L棕榈酸处理组;4:0.5 μmol/L二氢杨梅素+200 μmol/L棕榈酸处理组;5:1 μmol/L二氢杨梅素+200 μmol/L棕榈酸处理组; a:P<0.05,与空白对照组比较;b:P<0.05,与棕榈酸(200 μmol/L)处理组比较 A:Western blot检测caspase-1、IL-1β及ICAM-1蛋白表达;B:半定量分析 图 7 Western blot检测各组细胞中caspase-1、IL-1β 及ICAM-1的蛋白表达 |
3 讨论
细胞焦亡的发生依赖于caspase-1,其加工pro-IL-1β、 pro-IL-18等炎症因子使其成熟并释放。血管炎症在AS 斑块的发生发展中均发挥重要作用,棕榈酸是体内主要的游离脂肪酸,可浓度依赖地促进人脐静脉内皮细胞死亡[14],Tripathy等在AS健康受试者中发现升高体内游离脂肪酸水平可导致活性氧簇生成增加、核因子κB(NF-κB)的活性增强以及血浆促炎因子水平升高[15]。本研究发现棕榈酸浓度依赖(≥100 μmol/L)地诱导细胞焦亡关键蛋白caspase-1表达,以及IL-1β、ICAM-1的表达,同时导致细胞发生膨胀、破裂,细胞活力降低,乳酸脱氢酶释放增加,说明棕榈酸能够诱导内皮细胞发生焦亡,进而促进动脉粥样硬化的发生发展。对细胞焦亡的深入研究有助于认识其在心血管等慢性疾病发生发展和转归中的作用,为临床防治提供新思路。
二氢杨梅素为植物藤茶中提取的一种黄酮醇类化合物,已经证实具有多种生物学活性,包括改善骨骼肌胰岛素抵抗[8],改善葡萄糖、脂质代谢、抗炎症反应[16]等功能,研究报道二氢杨梅素通过线粒体通路保护内皮细胞免受过氧化氢诱导的氧化应激损伤[17],并显著抑制促炎症因子IL-1β,IL-6及肿瘤坏死因子-α的表达[13],因此我们推测二氢杨梅素对内皮细胞炎性焦亡也发挥重要作用。本研究发现二氢杨梅素预处理能明显降低细胞焦亡关键蛋白caspase-1表达及活性增加,并抑制棕榈酸诱导的促炎症因子IL-1β和ICAM-1的表达,同时改善棕榈酸诱导的细胞活力下降,降低棕榈酸导致的乳酸脱氢酶释放,提示二氢杨梅素可通过抑制caspase-1的激活从而抑制棕榈酸诱导的内皮细胞焦亡,进而发挥抗AS的作用。该研究对于进一步揭示二氢杨梅素抗炎及抗氧化作用机制具有重要意义,对于探究动脉粥样硬化防治新策略具有潜在的应用价值,但对其抑制焦亡作用机制仍需深入研究。因此,下一步研究将重点围绕二氢杨梅素的体内效应展开,采用二氢杨梅素纯品或者富含二氢杨梅素的藤茶进行体内干预试验,以深入探讨二氢杨梅素的抗动脉粥样硬化作用。
| [1] | Lloyd-Jones D, Adams R J, Brown T M. Executive summary: heart disease and stroke statistics--2010 update: a report from the American Heart Association[J]. Circulation,2010, 121 (7) : 948 –954. DOI:10.1161/CIRCULATIONAHA.109.192666 |
| [2] | Ross R. Atherosclerosis--an inflammatory disease[J]. N Engl J Med,1999, 340 (2) : 115 –126. DOI:10.1056/NEJM199901143400207 |
| [3] | Kepp O, Galluzzi L, Zitvogel L. Pyroptosis - a cell death modality of its kind[J]. Eur J Immunol,2010, 40 (3) : 627 –630. DOI:10.1002/eji.200940160 |
| [4] | Duewell P, Kono H, Rayner K J. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals[J]. Nature,2010, 464 (7293) : 1357 –1361. DOI:10.1038/nature08938 |
| [5] | Chang W, Lin J, Dong J. Pyroptosis: an inflammatory cell death implicates in atherosclerosis[J]. Med Hypotheses,2013, 81 (3) : 484 –486. DOI:10.1016/j.mehy.2013.06.016 |
| [6] | Pleiner J, Schaller G, Mittermayer F. FFA-induced endothelial dysfunction can be corrected by vitamin C[J]. J Clin Endocrinol Metab,2002, 87 (6) : 2913 –2917. DOI:10.1210/jcem.87.6.8596 |
| [7] | 张丹, 韩玲玲, 纪红梅. 棕榈酸对体外培养的人血管内皮细胞凋亡及活性氧的影响[J]. 医学临床研究,2012, 29 (2) : 198 –200. Zhang Dan, Han Lingling, Ji Hong-mei. Effect of Palmitate on Apoptosis and Reactive Oxygen Species in Human Endothelial Cells cultured in vitro[J]. J Clin Res,2012, 29 (2) : 198 –200. DOI:10.3969/j.issn.1671-7171.2012.02.003 |
| [8] | Shi L, Zhang T, Liang X. Dihydromyricetin improves skeletal muscle insulin resistance by inducing autophagy via the AMPK signaling pathway[J]. Mol Cell Endocrinol,2015, 409 : 92 –102. DOI:10.1016/j.mce.2015.03.009 |
| [9] | Zhang Y, Chen M L, Zhou Y. Resveratrol improves hepatic steatosis by inducing autophagy through the cAMP signaling pathway[J]. Mol Nutr Food Res,2015, 59 (8) : 1443 –1457. DOI:10.1002/mnfr.201500016 |
| [10] | Shirasuna K, Takano H, Seno K. Palmitic acid induces interleukin-1β secretion via NLRP3 inflammasomes and inflammatory responses through ROS production in human placental cells[J]. Journal of Reproductive Immunology,2016, 116 : 104 –112. DOI:10.1016/j.jri.2016.06.001 |
| [11] | Xu W, Guo YB, Li X. Palmitic acid induces hepatocellular oxidative stress and activation of inflammasomes[J]. Journal of Southern Medical University,2016, 36 (5) : 655 –659. |
| [12] | 何桂霞, 裴刚, 杜方麓, 等. 藤茶化学成分的研究[J]. 中国现代中药,2007, 9 (12) : 11 –13. He Guixia, Pei Gang, Du Fanglu. Studies on the Chemical Constituents of Ampelopsis grossedentata[J]. Modern Chinese Medicine,2007, 9 (12) : 11 –13. DOI:10.3969/j.issn.1673-4890.2007.12.004 |
| [13] | Qi S, Xin Y, Guo Y. Ampelopsin reduces endotoxic inflammation via repressing ROS-mediated activation of PI3K/Akt/NF-κB signaling pathways[J]. Int Immunopharmacol,2012, 12 (1) : 278 –287. DOI:10.1016/j.intimp.2011.12.001 |
| [14] | 江海龙, 苏海明, 甘继宏, 等. 软脂酸通过上调还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶表达促进血管内皮细胞凋亡[J]. 中华老年心脑血管病杂志,2012, 14 (4) : 421 –424. Jiang Hailong, Su Haiming, Gan Jihong. Palmitic acid promotes apoptosis of vascular endothelial cells by up-regulating expression of reduced form of NADPH oxidase[J]. Chin J Geriatr Heart Brain Ves Dis,2012, 14 (4) : 421 –424. |
| [15] | Tripathy D, Mohanty P, Dhindsa S, et al. Elevation of free fatty acids induces inflammation and impairs vascular reactivity in healthy subjects[J]. Diabetes,2003, 52 (12) : 2882 –2887. DOI:10.2337/diabetes.52.12.2882 |
| [16] | Chen S, Zhao X, Wan J. Dihydromyricetin improves glucose and lipid metabolism and exerts anti-inflammatory effects in nonalcoholic fatty liver disease: A randomized controlled trial[J]. Pharmacol Res,2015, 99 : 74 –81. DOI:10.1016/j.phrs.2015.05.009 |



