在我国,IgA肾病占原发性肾小球疾病的45%~50%,也是引起慢性肾衰竭(chronic renal failure,CRF)的首要原因[1]。早期观点认为多数IgA肾病表现为良性转归,预后较好,但相当一部分患者病程呈进展性,高达50%的患者会在20~25年内进入终末期肾病(end stage renal disease,ESRD),提示要对部分IgA肾病进行更为积极主动的治疗[2]。越来越多的研究已经证实蛋白尿是预示IgA肾病进展的独立危险因素。而临床治疗中对表现为中等量蛋白尿(1.0~3.5 g/24 h)的患者是否使用及如何使用特殊免疫抑制剂仍存在较大争议[3]。本研究回顾性分析我院经肾活检和临床确诊为中等量蛋白尿的IgA肾病患者在使用小剂量TAC+激素或单用足量激素治疗6个月间的临床疗效及不良反应,为该类IgA肾病探寻更优的治疗方案。
1 资料与方法 1.1 临床资料选取2012年1月-2015年1月在我院肾科住院并经肾穿刺活检和临床确诊为中等量蛋白尿的IgA肾病患者64例为研究对象。患者年龄在14~55岁之间,其中男性29例,女性35例。所有患者在使用免疫抑制剂治疗前均被告知并签署了知情同意书。根据治疗方案将患者分为小剂量TAC+激素组[n=34,他克莫司0.02~0.05 mg/(kg·d),分两次口服,血药谷浓度维持在3~5 ng/mL,强的松起始剂量0.5 mg/( kg·d)(最大剂量不超过40 mg/d)口服。]和激素组[n=30,强的松起始剂量1 mg/(kg·d)(最大剂量不超过70 mg/d)口服]。纳入标准:①依据临床表现及病理结果确诊为IgA肾病;②治疗前尿蛋白定量在1.0~3.5 g/24 h,肾活检病理结果符合Lee氏Ⅲ~Ⅴ级,基础血肌酐<155 μmol/L 或eGFR>50 mL/(min·1.73 m2);③治疗过程中在ARB(ACEI)的基础上使用了他克莫司+激素或单用激素。排除标准:①合并糖尿病、肝病、肿瘤或各种感染性疾病;②狼疮性肾炎、过敏性紫癜等继发性IgA肾病;③治疗前1个月内使用过免疫抑制剂,或本研究开始后使用了其他特殊免疫抑制剂,如:硫锉嘌呤、吗替麦考酚酯、环孢素A、来氟米特等;④用药不规范或随访时间不足6个月。具体筛选流程见图 1。
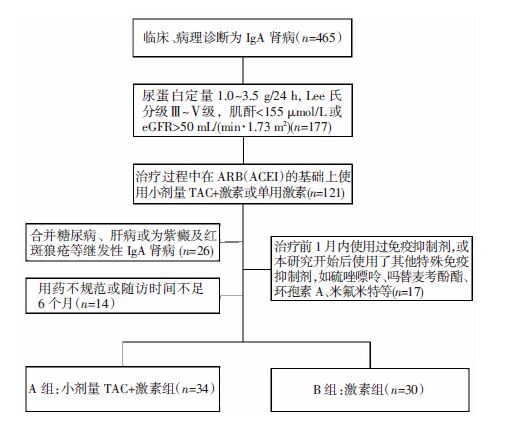
|
| 图 1 纳入和排除患者流程图 |
1.2 治疗方案
部分患者因病理活检提示增生性病变或活动性病变较重而予以甲强龙(0.25~0.5 g/d,静脉滴注),或 加用环磷酰胺(cyclophosphamide,CTX)(0.2~0.6 g/d,静脉滴注),连续3 d冲击治疗。冲击治疗完成后,小 剂量TAC+激素组给予他克莫司(商品名称普乐可复,FK506,安斯泰来制药公司,国药准字号为:J20090142)初始剂量0.02~0.05 mg/(kg· d),分两次口服,检查12 h血药浓度,并调整用药剂量,使谷浓度维持在3~ 5 ng/mL,同时给予强的松起始剂量0.5 mg/(kg·d)(最大剂量不超过40 mg/d)口服,并于8周后每4周减5 mg,减至15 mg/d后维持。激素组给予强的松1 mg/(kg·d)起始剂量(最大剂量不超过70 mg/d)口 服,于8周后每4周减5 mg,减至15 mg/d后维持。两组患者均给予了包括ARB或ACEI在内的基础支持治疗。
1.3 观察指标小剂量TAC+激素组随访(6.34±0.82)个月,激素组随访(6.60±0.75)个月,两组间随访时间比较差异无统计学意义(P>0.05)。利用我院病例检索系统和电话随访的方式回顾收集所有患者治疗前及治疗后1、3、6个月内的临床资料。观察患者各时间点血肌酐(Scr)、血白蛋白(ALB)、24 h尿蛋白定量情况,同时采用改良MDRD公式[4]计算肾小球滤过率(eGFR),并记录治疗期间发生的不良反应。
1.4 疗效评定标准参照国内外研究及中华中医药学会肾病分会2007年发布的《IgA肾病的诊断、辨证分型和疗效评定》制定疗效标准[5-6]:①完全缓解:尿蛋白定量<0.3 g/24 h,血白蛋白(ALB)恢复至正常水平,血肌酐(Scr)波动≤15%;②显著缓解:24 h尿蛋白定量较治疗前降低50%以上,但仍≥0.3 g/24 h,且血肌酐波动≤15%;③部分缓解:24 h尿蛋白定量较前减少≥25%、<50%,且血肌酐波动≤15%。④无效:24 h尿蛋白定量较治疗前降低未达25%,或血肌酐较治疗前上升超过15%。总有效率为完全缓解、显著缓解及部分缓解之和。
1.5 统计学方法采用Excel 2007和SPSS 18.0进行数据的收集和统计分析。呈正态分布的计量资料,用x±s表示,两组间比较采用成组t检验,组内治疗前后比较采用配对t检验;呈偏态分布的计量资料以中位数及全距表示,两组间比较采用Wilcoxon秩和检验,组内治疗前后比较采用Wilcoxon符号秩检验。计数资料以例(%)表示,采用χ2检验、连续校正卡方检验或Fisher精确检验进行假设检验。以α为检验水准。
2 结果 2.1 基线资料两组患者的性别、年龄分布相似,治疗前基线血压、肝功、血脂、 血糖、血肌酐、血尿酸、血白蛋白、24 h 尿蛋白定量、eGFR及冲击治疗情况差异均无统计学意义(P>0.05,表 1)。
| 组别 | 年龄(岁) | 性别(男/女) | SBP(mmHg) | DBP(mmHg) | MAP(mmHg) | Hb(g/L) | 尿蛋白定量(mg/24 h) | 血肌酐(μmol/L) | 血白蛋白(g/L) | ALT(U/L) | AST(U/L) | Chol(mmol/L) | TG(mmol/L) | 血糖(mmol/L) | eGFR(mL/min/1.73 m2) | 甲强龙[例(%)] | 甲强龙+CTX[例(%)] | 未冲击[例(%)] | UA(μmol/L) | BUN(mmol/L) | HDL(mmol/L) | LDL(mmol/L) |
| TAC组 | 30.76±10.54 | 14/20 | 123.94±17.66 | 79.82±13.71 | 94.53±14.27 | 123.32±19.19 | 2 237.41±770.53 | 87.29±23.28 | 32.01±6.54 | 15.5(6~48) | 21(13~41) | 4.91(2.58~16.61) | 1.57(.67~6.62) | 4.56(3.84~6.21) | 88.44±28.14 | 5(7.8) | 9(14.1) | 20(31.3) | 353.85±107.25 | 5.77±1.50 | 1.24(0.57~3.10) | 2.87(1.47~8.40) |
| 激素组 | 34.07±11.43 | 15/15 | 123.93±17.08 | 79.90±11.85 | 94.58±12.44 | 129.00±18.83 | 1 938.20±672.90 | 85.86±27.53 | 36.41±5.51 | 17(6~78) | 20(12~43) | 4.83(3.59~12.37) | 1.41(0.56~4.46) | 4.70(3.76~7.73) | 88.38±24.10 | 4(6.3) | 6(9.4) | 20(31.3) | 366.20±108.68 | 5.42±1.14 | 1.12(0.65~2.52) | 3.12(2.04~8.78) |
| P值 | 0.234 | 0.479 | 0.999 | 0.981 | 0.989 | 0.238 | 0.105 | 0.819 | 0.540 | 0.741 | 0.363 | 0.830 | 0.563 | 0.174 | 0.993 | 0.792 | 0.649 | 0.311 | 0.303 | 0.160 | ||
2.2 治疗前病理资料特点比较
我院肾科主要依据Lee氏分级系统对IgA肾病进行分级,并根据病理结果中肾小球、肾小管及间质和新月体病变情况,参照Katafuchi半定量标准对肾脏病变进行评分[7]。两组间病理分级及各指标评分比较差异无统计学意义(P>0.05,表 2)。
| 组别 | Lee氏分级 | 系膜-内皮细胞增生 | 细胞新月体 | 球性硬化 | 节段硬化 | 肾小管萎缩 | 间质纤维化 |
| TAC组 | 3(3~5) | 1(1~2) | 0(0~4) | 1(0~3) | 2(0~3) | 1(0~3) | 1(0~2) |
| 激素组 | 4(3~5) | 1(1~2) | 0(0~4) | 1(0~3) | 1(0~3) | 1(1~2) | 1(0~2) |
| P值 | 0.293 | 0.492 | 0.525 | 0.407 | 0.286 | 0.225 | 0.841 |
2.3 治疗前后各指标变化
小剂量TAC+激素组治疗期间他克莫司平均血药谷浓度3.97(3~5)ng/mL。在治疗1、3、6个月时,两组患者24 h尿蛋白定量下降,血白蛋白升高且与治疗前比较差异均有统计学意义(P<0.05)。在3个时间点,小剂量TAC+激素组24 h尿蛋白定量下降值与单激素组比较差异均有统计学意义,血白蛋白升高值两组间比较差异亦均有统计学意义(P<0.05,表 4)。两组患者治疗前与治疗6个月后血肌酐及eGFR变化比较差异无统计学意义(P>0.05,表 3)。
| 组别 | 1个月 | 3个月 | 6个月 | |||
| /M+Ra | Pb值 | /M+Ra | Pb值 | /M+Ra | Pb值 | |
| 尿蛋白定量(mg/24 h) | ||||||
| TAC组 | 850.56 ±683.32 | 0.000 | 639.94±655.90 | 0.000 | 217.5(22~2901) | 0.000 |
| 激素组 | 821.27±489.77 | 0.000 | 691.03±462.01 | 0.000 | 383(29~1762) | 0.000 |
| 血肌酐(μmol/L) | ||||||
| TAC组 | 85.44±21.79 | 0.452 | 85.29±21.63 | 0.46 | 83.09±21.02 | 0.077 |
| 激素组 | 86.46 ±24.62 | 0.206 | 86.26±25.62 | 0.871 | 88.33±25.91 | 0.39 |
| 血白蛋白(g/L) | ||||||
| TAC组 | 39.88±4.38 | 0.000 | 42.61 ±8.69 | 0.000 | 42.8(34.4~79.0) | 0.000 |
| 激素组 | 40.68±3.23 | 0.000 | 41.48±2.84 | 0.000 | 43.9(35.3~47.3) | 0.000 |
| eGFR(mL/min/1.73 m2) | ||||||
| TAC组 | - | - | - | - | 87.38±26.44 | 0.267 |
| 激素组 | - | - | - | - | 86.44±25.72 | 0.594 |
| a:表中正态分布的数据用 表示,非正态分布的数据用M(中位数)+R(全距)表示;b:各指标前后自身对照的P值 | ||||||
| 组别 | Δ尿蛋白定量(mg/24h) | Δ血肌酐(μmol/L) | Δ血白蛋白(g/L) | ||||||
| 1个月 | 3个月 | 6个月 | 1个月 | 3个月 | 6个月 | 1个月 | 3个月 | 6个月 | |
| TAC组 | -1 487(397~-2 694) | -1 667.5(329~-2 710) | -1 872.5(112~-2 998) | 1(21~-52) | -2.01±15.67 | -4.21±13.42 | 7.87±3.69 | 8.55(51~3) | 9.2(43~1.6) |
| 激素组 | -976(-157~-2 391) | -1 062(-57~-2 645) | -1 220.5(-584~-3 116) | 5(20.2~-44) | 0.4±13.41 | 2.47±15.49 | 4.27±4.69 | 4(25.2~-4.5) | 6.7(27.5~-1.6) |
| P值 | 0.034 | 0.019 | 0.021 | 0.201 | 0.514 | 0.070 | 0.001 | 0.000 | 0.003 |
2.4 疗效比较
在治疗1、3、6个月时,小剂量TAC+激素组和单激素组在完全缓解率和总有效率上比较差异均无统计学意义(P>0.05,表 5)。在对不同Lee氏分级疗效分析中也未发现两种治疗方式完全缓解率及总有效率的差异(P>0.05,表 6)。
| 项目 | 完全缓解(例) | 显著缓解(例) | 部分缓解(例) | 无效(例) | 完全缓解率(%) | P值 | 总有效率(%) | P值 |
| 治疗1个月时 | 0.413 | 0.791 | ||||||
| TAC组 | 7 | 13 | 7 | 7 | 20.59 | 79.41 | ||
| 激素组 | 3 | 14 | 6 | 7 | 10.00 | 76.67 | ||
| 治疗3个月时 | 0.055 | 0.573 | ||||||
| TAC组 | 13 | 13 | 2 | 6 | 38.24 | 82.35 | ||
| 激素组 | 5 | 13 | 5 | 7 | 16.67 | 76.67 | ||
| 治疗6个月时 | 0.093 | 0.244 | ||||||
| TAC组 | 16 | 10 | 2 | 6 | 47.06 | 82.35 | ||
| 激素组 | 8 | 12 | 1 | 9 | 26.67 | 70 |
| 组别 | Lee氏分级 | |||||||||
| Ⅲ级 | Ⅳ~Ⅴ级 | |||||||||
| n | 有效率(%) | P值 | 完全缓解率(%) | P值 | n | 有效率(%) | P值 | 完全缓解率(%) | P值 | |
| TAC组 | 20 | 85 | 0.213 | 50 | 0.310 | 14 | 85.71 | 0.664 | 57.14 | 0.075 |
| 激素组 | 13 | 61.54 | 30.77 | 17 | 76.47 | 23.53 | ||||
2.5 不良反应
在对小剂量TAC+激素组患者治疗前后白细胞、血红蛋白及血小板变化的观察中未发现骨髓抑制的现象,也没有明确感染事件的发生。其他不良反应:小剂量TAC+激素组新发血糖升高4例,肝功能损害3例,胃肠道反应1例,反复口腔溃疡1例,激素组新发血糖升高5例,肝功能受损4例,胃肠道反应2例。两组间比较差异无统计学意义(P=0.380)。血糖升高在药物减量后可以得到控制,肝功能受损主要表现在转氨酶升高,在使用保肝药物后均有所缓解,无因不良反应改变治疗方案或停药患者。
3 讨论尿蛋白水平与IgA肾病进展最为密切,降低IgA肾病患者的蛋白尿可以改善预后[8-9]。目前临床上对表现为中等量蛋白尿、肾脏病理改变较重的IgA肾病患者,常用的治疗方案是在使用ARB(ACEI)和激素的基础上加用一种特殊免疫抑制剂[10-12]。以往使用较多的特殊免疫抑制剂为硫唑嘌呤、环孢素A、吗替麦考酚酯、环磷酰胺及来氟米特等。他克莫司(tacrolimus,FK506)作为一种钙调磷酸酶抑制剂(calcineurin inhibitors,CNI),不仅可以抑制钙调蛋白依赖的蛋白磷酸酶活性,降低IL-2的转录水平,从而抑制T细胞的活化,还可通过对IL-10、IL-8、VPF的抑制,达到对B细胞的抑制作用[13-14]。进一步的研究发现他克莫司除了免疫抑制作用外还可在肾脏与TRPC6结合,起到抑制足细胞损伤及缓解蛋白尿的作用,同时还可使突触极蛋白(synaptopodin)磷酸化,稳定足细胞actin细胞骨架,从而达到降低尿蛋白的作用[15-16]。
目前他克莫司用于各种肾小球疾病特别是难治性 肾病综合征已经取得了良好的疗效[17-18]。Zhang等[19]研究 发现其在降低IgA肾病患者大量蛋白尿(>3.5 g/24 h)中有着很好的效果。Kim等[20]的随机双盲对照研究也显示他克莫司能够有效降低表现为轻中度蛋白尿IgA肾病患者的蛋白尿水平。然而,现有研究中他克莫司的起始剂量均为0.075~0.1 mg/(kg·d),维持血药谷浓度也在5~10 ng/mL,在联合使用激素的情况下,不仅增加了肾毒性、骨髓抑制及感染等副作用,也带来了治疗成本的上升,降低了患者的治疗依从性。我们发现采用小剂量他克莫司[0.02~0.05 mg/(kg·d)] 起始,低血药浓度(3~5 ng/mL)维持的用药方式一样可以起到有效降低患者蛋白尿水平的作用,且小剂量TAC+激素的用药方案在治疗1、3、6个月时表现出了更强的降低患者蛋白尿水平的作用。但两种治疗方式在完全缓解率及总有效率上比较差异均无统计学意义(P>0.05)。在针对不同Lee氏分级患者疗效的分析中,也未发现两种治疗方式存在统计学差异(P>0.05)。
不良反应方面。在Zhang等[19]的研究中有35.71%(5/14)的患者在使用他克莫司治疗6个月时血肌酐升高达到30%以上。Kim等[20]的研究也指出长期大量使用他克莫司可能引起肾毒性,并带来血肌酐的上升。本组研究中,患者使用小剂量TAC+激素治疗6个月后,血肌酐及eGFR没有出现明显上升(P>0.05),白细胞、血红蛋白及血小板相对平稳,未发现骨髓抑制的现象,也没有明确感染事件的发生。其他不良反应发生例数及总的不良反应发生率,两组比较亦无明显差异(P=0.380)。所有这些均提示小剂量、低浓度的使用他克莫司是安全的。
不足之处:首先,本研究为回顾性研究,且样本量不大,更确切的疗效可能需要更大样本,更长观察时间的前瞻对照研究来进一步证实。再者,如有重复肾活检来比较两种用药方式治疗前后肾脏病理变化情况会更好。
综上所述,通过我们研究发现,小剂量TAC[0.02~0.05 mg/(kg·d)]起始,低血药浓度(3~5 ng/mL)维持的用药方法在治疗中等量蛋白尿IgA肾病中依然有效。对比单纯使用足量激素,小剂量TAC+激素的治疗方案表现出了更好的降低患者蛋白尿水平的作用,且不会增加不良反应,但并没有带来临床完全缓解率和总有效率的上升。
| [1] | Li L S, Liu Z H. Epidemiologic data of renal diseases from a single unit in China: analysis based on 13,519 renal biopsies[J]. Kidney Int,2004, 66 (3) : 920 –923. DOI:10.1111/j.1523-1755.2004.00837.x |
| [2] | Wyatt R J, Julian B A. IgA nephropathy[J]. N Engl J Med,2013, 368 (25) : 2402 –2414. DOI:10.1056/NEJMra1206793 |
| [3] | Kidney Disease Improving Global Outcomes. KDIGO Clinical Practice Guideline for Glomerulonephritis[J]. Kidney Int,2012, 2 (Suppl 2) : 143 –153. |
| [4] | Ma Y C. Modified Glomerular Filtration Rate Estimating Equation for Chinese Patients with Chronic Kidney Disease[J]. Journal of the American Society of Nephrology,2006, 17 (10) : 2937 –2944. DOI:10.1681/asn.2006040368 |
| [5] | Floege J, Eitner F. Current therapy for IgA nephropathy[J]. J Am Soc Nephrol,2011, 22 (10) : 1785 –1794. DOI:10.1681/ASN.2011030221 |
| [6] | Li X, Liu Y, Lv J, et al. Progression of IgA nephropathy under current therapy regimen in a Chinese population[J]. Clin J Am Soc Nephrol,2014, 9 (3) : 484 –489. DOI:10.2215/CJN.01990213 |
| [7] | 蒋镭, 吕继成, 陈文芳, 等. IgA肾病简明半定量病理评分方法及其与预后的关系[J]. 中华肾脏病杂志,2007, 23 (5) : 278 –282. Jiang Lei Lv Jicheng Chen Wenfang, et al. A concise semi-quantitative pathological scoring method for IgA nephropathy and it's relation to renal outcome[J]. Chin J Nephrol,2007, 23 (5) : 278 –282. DOI:10.3760/j.issn:1001-7097.2007.05.002 |
| [8] | 乐伟波, 梁少珊, 邓康平, 等. 1126例中国汉族成人IgA肾病患者的长期预后及危险因素分析[J]. 肾脏病与透析肾移植杂志,2011, 20 (2) : 101 –108. Le Weibo Liang Shaoshan Deng Kangping, et al. Long-term renal survival and related risk factors of patients with IgA nephropathy: results from a cohort of 1 126 cases in a Chinese adult population[J]. Chin J Nephrol, Dial Transpl,2011, 20 (2) : 101 –108. DOI:10.3969/j.issn.1006-298X.2011.02.001 |
| [9] | Reich H N, Troyanov S, Scholey J W, et al. Remission of proteinuria improves prognosis in IgA nephropathy[J]. J Am Soc Nephrol,2007, 18 (12) : 3177 –3183. DOI:10.1681/ASN.2007050526 |
| [10] | Xu L, Liu Z C, Guan G J, et al. Cyclosporine A combined with medium/low dose prednisone in progressive IgA nephropathy[J]. Kaohsiung J Med Sci,2014, 30 (8) : 390 –395. DOI:10.1016/j.kjms.2014.04.002 |
| [11] | Shin J H, Lee J E, Park J H, et al. The effects of cytotoxic therapy in progressive IgA nephropathy[J]. Ann Med,2016, 48 (3) : 171 –181. DOI:10.3109/07853890.2016.1153805 |
| [12] | Wang W, Chen N. Treatment of progressive IgA nephropathy: an update[J]. Contrib Nephrol,2013, 181 : 75 –83. DOI:10.1159/000348460 |
| [13] | Scott L J, McKeage K, Keam S J, et al. Tacrolimus: a further update of its use in the management of organ transplantation[J]. Drugs,2003, 63 (12) : 1247 –1297. DOI:10.2165/00003495-200363120-00006 |
| [14] | Kr?mer BK, Schweda F. Differing proteinuria control with cyclosporin and tacrolimus[J]. Lancet,1997, 349 (9056) : 953 –954. DOI:10.1016/S0140-6736(05)62731-6 |
| [15] | Winn M P. 2007 Young Investigator Award: TRP'ing into a new era for glomerular disease[J]. J Am Soc Nephrol,2008, 19 (6) : 1071 –1075. DOI:10.1681/ASN.2007121292 |
| [16] | Faul C, Donnelly M, Merscher-Gomez S, et al. The actin cytoskeleton of kidney podocytes is a direct target of the antiproteinuric effect of cyclosporine A[J]. Nat Med,2008, 14 (9) : 931 –938. DOI:10.1038/nm.1857 |
| [17] | Butani L, Ramsamooj R. Experience with tacrolimus in children with steroid-resistant nephrotic syndrome[J]. Pediatr Nephrol,2009, 24 (8) : 1517 –1523. DOI:10.1007/s00467-009-1220-z |
| [18] | Seibert F S, van der Giet M, Zidek W, et al. Tacrolimus in steroid-resistant and steroid-dependent nephrotic syndrome revisited[J]. Clin Nephrol,2012, 77 (4) : 345 –346. DOI:10.5414/cn107172 |
| [19] | Zhang Q, Shi S F, Zhu L, et al. Tacrolimus improves the proteinuria remission in patients with refractory IgA nephropathy[J]. Am J Nephrol,2012, 35 (4) : 312 –320. DOI:10.1159/000337175 |
| [20] | Kim Y C, Chin H J, Koo H S, et al. Tacrolimus decreases albuminuria in patients with IgA nephropathy and normal blood pressure: a double-blind randomized controlled trial of efficacy of tacrolimus on IgA nephropathy[J]. PLoS ONE,2013, 8 (8) : e71545 . DOI:10.1371/journal.pone.0071545 |



