2. 400038 重庆,第三军医大学西南医院:全军烧伤研究所,创伤、烧伤与复合伤国家重点实验室
2. State Key Laboratory of Trauma, Burns and Combined Injury, Institute of Burns, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
缺血性脑卒中因其高发病率、高致残率和高死亡率而严重威胁人类健康[1]。炎症反应是加重脑缺血继发性脑损伤的关键因素之一[2]。近年研究发现,γδT细胞分泌的白细胞介素-17A(IL-17A)是引发脑缺血炎症级联放大反应的关键因素,其可诱导中性粒细胞、单核细胞前往缺血缺氧组织增强炎症反应[3]。Gelderblom等[4]在小鼠脑缺血3 h后给予抗白细胞介素-17A抗体(anti-IL-17A)可显著抑制炎症反应和减少脑梗死体积,同时促进神经功能恢复。干细胞因子(stem cell factor,SCF)是一种重要的造血生长因子,Zhao等[5]研究显示,在小鼠脑缺血后3 h至7 d连续每天给予SCF,可促进缺血缺氧区神经干细胞的增殖分化,以及梗死灶周围血管的增生。但脑缺血导致脑损伤的过程相当复杂,针对任何单一环节的治疗,不能充分有效地阻止神经细胞缺血损伤。如何有效治疗脑梗死,降低致残率仍是临床研究的一大课题。因目前尚少见联合应用anti-IL-17A和SCF治疗脑缺血相关报道,且anti-IL-17A和SCF在脑缺血治疗上发挥的修复机制不同,所以本研究旨在通过观察anti-IL-17A联合SCF对小鼠脑缺血的治疗效果,为更好地治疗脑缺血提供新的研究思路。
1 材料与方法 1.1 实验动物与分组实验动物为SPF级雄性C57BL/6小鼠,体质量25~30 g,由第三军医大学实验动物中心提供。实验过程严格遵循第三军医大学动物实验管理使用规定。小鼠用随机数字法分成假手术组(n=5)、生理盐水(normal saline,NS)组(n=30)、anti-IL-17A组(n=30)、SCF组(n=30)和anti-IL-17A+SCF组(n=30)。在小鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)术后各组分别给予不同处理因素。
1.2 主要试剂2,3,5-氯化三苯基四氮唑(TTC,Sigma,美国),TUNEL试剂盒(Roche,瑞士),RNA提取试剂盒(Qiagen,德国),cDNA合成试剂盒(Toyobo,日本),重组小鼠SCF(PeproTech,美国),重组小鼠单克隆抗白细胞介素-17A抗体(clone 17F3,BioXCell,美国)。
1.3 实验方法 1.3.1 脑缺血再灌注模型建立参考Sugimori等[6]的方法建立小鼠MCAO模型。术前小鼠采用5%水合氯醛7 mL/kg腹腔注射麻醉。整个手术过程用取暖灯保持小鼠体温维持在36 ℃左右。经右侧颈总动脉用7-0的尼龙线栓闭塞小鼠大脑中动脉,线栓尖端距颈总动脉分叉处约9 mm。60 min后取出线栓,恢复右侧大脑中动脉血流。
1.3.2 神经功能评分参考Longa评分法[7],采用盲法评估方式分别于小鼠MCAO术后1、3、7 d进行评分。0分:无神经功能损伤;1分:左侧前肢不能完全伸展;2分:行走时小鼠身体向左侧转圈;3分:行走时小鼠身体向左侧倾倒;4分:不能自发行走,有意识丧失。
1.3.3 TTC染色采用TTC染色法检测脑梗死体 积。MCAO术后7 d取出脑组织并冠状位切成1 mm厚度的脑片,置于2%的TTC溶液中37 ℃孵育20 min。 然后经4%多聚甲醛固定12 h后照相,用Image J软件计算脑梗死体积。
1.3.4 HE染色采用HE染色行脑组织病理学检查,MCAO术后7 d小鼠深度麻醉后,给予NS和4%多聚甲醛心脏灌流后取脑,脱水并石蜡包埋,将脑组织冠状切为5 μm厚的切片,然后进行常规HE染色,并在显微镜下观察各组切片的组织形态学。
1.3.5 脑组织含水量测定深度麻醉小鼠后取脑,分别将小脑及两个大脑半球快速用电子天平称量得湿质量,置于100 ℃烤箱24 h后称量得干质量,脑组织水含量=(湿质量-干质量)/湿质量×100%。
1.3.6 神经细胞凋亡检测小鼠MCAO术后7 d取脑进行石蜡切片,按照TUNEL凋亡检测试剂盒说明书步骤染色,分别选择缺血半暗带3个0.1 mm×0.1 mm区域计数TUNEL阳性细胞,取平均值。
1.3.7 RT-PCRMCAO术后7 d提取脑组织IL-17A和IL-1β总RNA。通过RT-PCR制备cDNA,利用PCR检测目的基因表达情况。所用引物见表 1。
| 基因 | 引物序列(5 →3 ) | 产物长度(bp) |
| IL-17A | 上游 CTCCAGAAGGCCCTCAGACTAC
下游 AGCTTTCCCTCCGCATTGACACAG | 143 |
| IL-1β | 上游 CAACCAACAAGTGATATTCTCCATG
下游 GATCCACACTCTCCAGCTGCA | 152 |
| GAPDH | 上游 CGTGCCGCCTGGAGAAAC
下游 AGTGGGAGTTGCTGTTGAAGTC | 138 |
1.3.8 给药方法
按参考文献[3, 5]的研究方法给药。SCF组:术后3 h给予SCF皮下注射,给药剂量为200μg/(kg·d),连续给药7 d。anti-IL-17A组:每只单次腹腔注射anti-IL-17A抗体50 μg,MCAO术后3、12 h各1次;anti-IL-17A+SCF组:按anti-IL-17A组和SCF组处理方法同时给予;NS组:给予等体积生理盐水腹腔注射。
1.4 统计学分析数据使用Graph Pad Prism 6.0c统计软件进行统计学分析。结果用x±s表示,多组间差异比较行单因素方差分析。检验水准α=0.05。
2 结果 2.1 各组小鼠生存率观察接受不同处理因素后,观察各组小鼠MCAO术后1、3、7 d各时间点的生存率,在术后第1天时,各组生存率无差异,但在第3、7天时,anti-IL-17A+SCF组生存率最高,其次是anti-IL-17A组和SCF组,NS组生存率最低(表 2)。
| 组别 | 1 d | 3 d | 7 d |
| NS组 | 100 | 86.7 | 66.7 |
| anti-IL-17A组 | 100 | 90.0 | 83.4 |
| SCF组 | 100 | 90.0 | 80.0 |
| anti-IL-17A+SCF组 | 100 | 93.4 | 90.0 |
2.2 对脑梗死体积和脑组织病理损伤的影响
MCAO术后7 d观察到各组小鼠均出现不同程度的脑梗死灶和组织病理损伤。与NS组相比较,anti-IL-17A、SCF和anti-IL-17A+SCF组脑梗死体积均显著减少(P<0.05),且anti-IL-17A+SCF组显著小于anti-IL-17A组和SCF组(P<0.05,图 1A、B)。脑梗死区HE染色显示病理损伤最严重的为NS组,可见大量神经细胞水肿坏死,炎症细胞浸润明显,其次是anti-IL-17A、SCF组,损伤程度最轻的为anti-IL-17A+SCF组(图 1C)。
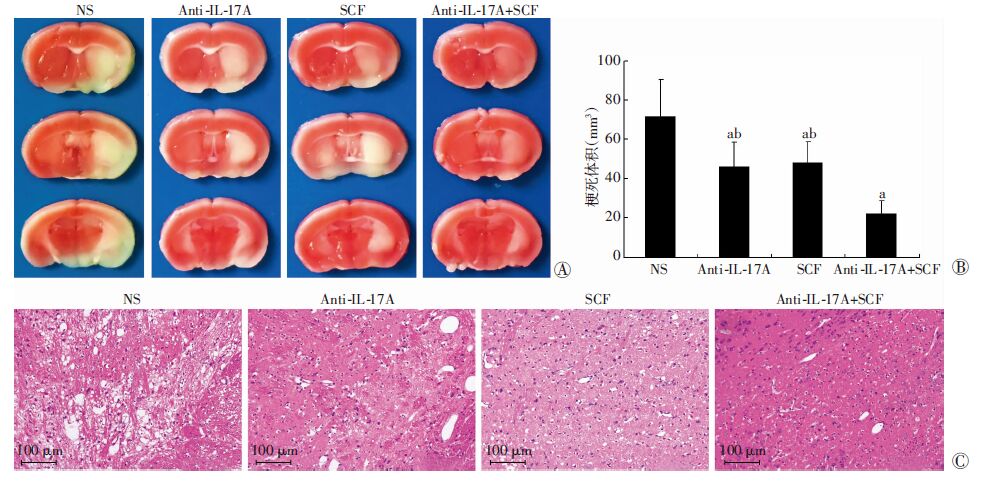
|
| A:小鼠脑组织TTC染色结果;B:脑梗死体积分析结果;C:脑梗死区HE染色结果( 200) a:P<0.05,与NS组比较;b:P< 0.05,与anti-IL-17A+SCF组比较(n=5) 图 1 MACO术后7 d各组脑组织TTC染色、梗死体积分析和HE染色 |
2.3 神经功能评分
MCAO术后1、3、7 d进行神经功能评分,结果显示,各模型组均表现出了严重的神经功能损伤。在第7天时,与NS组相比较,经anti-IL-17A、SCF和anti-IL-17A+SCF干预后的小鼠神经功能症状得到明显缓解(P<0.05),且anti-IL-17A+SCF组缓解程度优于anti- IL-17A组和SCF组(图 2A)。
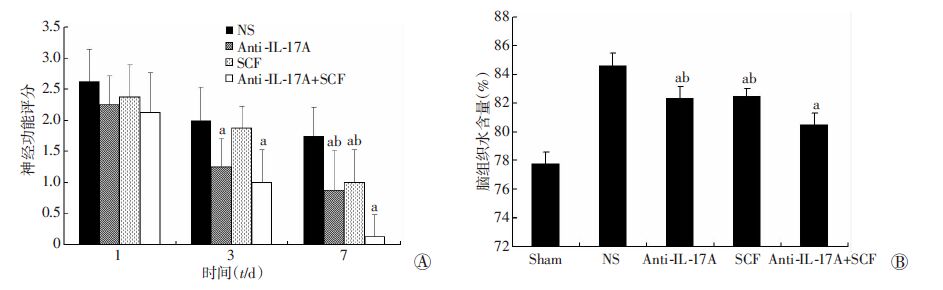
|
| A:神经功能评分结果(n=8);B:脑组织水含量检测结果(n=4); a: P<0.05,与NS组比较;b:P<0.05,与anti-IL-17A+SCF组比较 图 2 各组小鼠MCAO术后神经功能评分和脑组织水含量检测 |
2.4 脑水肿检测
MCAO术后各组均出现不同程度的脑水肿,于术后3 d达高峰。在第3天时与NS组相比较,anti-IL-17A、SCF和anti-IL-17A+SCF组脑水肿得到明显缓解(P<0.05),且anti-IL-17A+SCF组比anti-IL-17A组和SCF组缓解更明显(P<0.05,图 2B)。
2.5 脑缺血半暗带区神经凋亡细胞检测MCAO术后7 d采用TUNEL染色法检测各组缺血半暗带区神经细胞凋亡情况(图 3A)。与NS组比较,anti-IL-17A、SCF和anti-IL-17A+SCF组TUNEL阳性细胞均显著减少(P<0.05),且anti-IL-17A+SCF组显著少于anti-IL-17A组和SCF组(P<0.05,图 3B)。

|
| A:TUNEL染色检测结果(×400);B:各组TUNEL阳性细胞数分析结果 a:P<0.05,与NS组比较;b: P<0.05,与 anti-IL-17A+SCF组比较(n=5) 图 3 MCAO术后7 d小鼠脑梗死缺血半暗带区神经细胞凋亡检测 |
2.6 炎症因子IL-17A、IL-1β检测
RT-PCR检测小鼠MCAO术后7d时IL-17A和IL-1β 表达情况。与NS组相比,IL-17A和IL-1β在anti-IL-17A组和anti-IL-17A+SCF组均明显减少(P<0.05),在SCF组无显著变化(P>0.05,图 4A、B)。
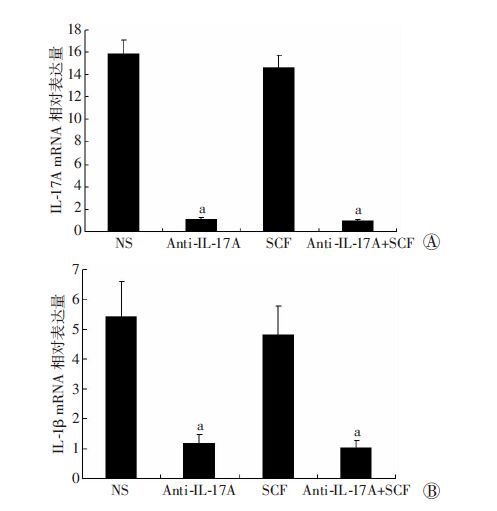
|
| A:IL-17A;B:IL-1β a:P<0.05,与NS组比较(n=6) 图 4 RT-PCR检测各组IL-17A和 IL-1βmRNA的表达情况 |
3 讨论
缺血性脑卒中已成为患者死亡和残疾的主要原因之一,且发病率在逐年上升[8]。炎症反应在脑缺血继发性脑损伤的发生发展过程中发挥着重要的作用[9]。脑缺血在发生数分钟内就启动了炎症级联反应,并最终导致了缺血核心区域不可逆地损伤。然而梗死核心区周围的缺血半暗带并未完全坏死,如果及时地给予抗炎,促进血管、神经元的修复等治疗可减轻脑缺血损伤[10]。因此,该实验联合应用anti-IL-17A和SCF,从不同的修复机制联合治疗脑缺血,观察能否得到更佳的治疗效果。已有研究发现,产生IL-17A的细胞很多,包括γδT细胞、αβ T细胞、小神经胶质细胞等[11]。Shichita等[12]证实,参与脑缺血损伤的IL-17A主要来自γδT细胞。IL-17A是脑缺血炎症反应中起重要作用的炎症因子之一,脑缺血发生后开始逐渐增多,第3天达高峰[13],其可诱导单核细胞、中性粒细胞透过血脑屏障进入脑组织释放大量炎症因子,引发炎症级联放大反应导致过度炎症,且可增强神经毒性因子如IL-1β、TNF-α和基质金属蛋白酶等的产生,从而破坏血脑屏障和促进神经元凋亡。Gelderblom等[4]研究发现小鼠脑缺血抗IL-17A单克隆抗体治疗或IL-17A基因敲除均可减轻脑梗死体积和改善神经功能。
SCF是一种造血生长因子,在缺血性脑卒中后大量上调。SCF与受体c-Kit结合可促进骨髓内皮祖细胞的生存、黏附和动员。内皮祖细胞在缺血性脑卒中后可促进血管再生、神经发生及改善神经功能[14]。体外实验研究表明缺氧情况下SCF可诱导小鼠皮质培养细胞神经发生,还可刺激培养细胞和整体动物皮质侧脑室外侧壁的室下带和海马齿状回的颗粒下层的神经发生[15]。在动物体内实验中,Zhao等[5]在大鼠脑缺血后给予SCF,术后7 d时观察到脑梗死体积减轻和神经功能改善。但SCF促进血管、神经发生的作用相对缓慢,所以我们选择MCAO术后7 d为本实验观察终点。
本研究分别应用SCF和anti-17A均可减轻脑损伤,但单独应用SCF和anti-17A脑保护作用有限,联合应用SCF和anti-17A可更有效地减轻脑梗死体积和神经细胞凋亡,更好地促进神经功能恢复。
综上所述,联合应用SCF和anti-17A既可抑制脑缺血后的炎症反应,又可促进梗死灶周围神经干细胞的增殖分化和血管的增生,起到了协同的作用,最终更好地减少了脑梗死体积和促进了神经功能的恢复,但SCF+anti-17A在脑保护过程中的相互作用机制以及对脑缺血远期恢复效果仍待进一步研究。
| [1] | Macrez R, Ali C, Toutirais O, et al. Stroke and the immune system: from pathophysiology to new therapeutic strategies[J]. Lancet Neurol,2011, 10 (5) : 471 –480. DOI:10.1016/S1474-4422(11)70066-7 |
| [2] | Fu Y, Liu Q, Anrather J, et al. Immune interventions in stroke[J]. Nat Rev Neurol,2015, 11 (9) : 524 –535. DOI:10.1038/nrneurol.2015.144 |
| [3] | Shichita T, Sugiyama Y, Ooboshi H, et al. Pivotal role of cerebral interleukin-17-producing gammadeltaT cells in the delayed phase of ischemic brain injury[J]. Nat Med,2009, 15 (8) : 946 –950. DOI:10.1038/nm.1999 |
| [4] | Gelderblom M, Weymar A, Bernreuther C, et al. Neutralization of the IL-17 axis diminishes neutrophil invasion and protects from ischemic stroke[J]. Blood,2012, 120 (18) : 3793 –3802. DOI:10.1182/blood-2012-02-412726 |
| [5] | Zhao L R, Singhal S, Duan W M, et al. Brain repair by hematopoietic growth factors in a rat model of stroke[J]. Stroke,2007, 38 (9) : 2584 –2591. DOI:10.1161/STROKEAHA.106.476457 |
| [6] | Sugimori H, Yao H, Ooboshi H, et al. Krypton laser-induced photothrombotic distal middle cerebral artery occlusion without craniectomy in mice[J]. Brain Res Brain Res Protoc,2004, 13 (3) : 189 –196. DOI:10.1016/j.brainresprot.2004.06.001 |
| [7] | Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989, 20 (1) : 84 –91. DOI:10.1161/01.str.20.1.84 |
| [8] | 李惠允. 短暂性脑缺血发作患者的相关危险因素及引起脑梗死的风险预测. 第三军医大学, 2015. Li Huyun, The risk factors of transient ischemic attack patients and its risk of stroke. Third Military Medical University, 2015 |
| [9] | Brea D, Agulla J, Rodríguez-Yáñez M, et al. Regulatory T cells modulate inflammation and reduce infarct volume in experimental brain ischaemia[J]. J Cell Mol Med,2014, 18 (8) : 1571 –1579. DOI:10.1111/jcmm.12304 |
| [10] | Perez-de-Puig I, Miró-Mur F, Ferrer-Ferrer M, et al. Neutrophil recruitment to the brain in mouse and human ischemic stroke[J]. Acta Neuropathol,2015, 129 (2) : 239 –257. DOI:10.1007/s00401-014-1381-0 |
| [11] | Iwakura Y, Ishigame H, Saijo S, et al. Functional specialization of interleukin-17 family members[J]. Immunity,2011, 34 (2) : 149 –162. DOI:10.1016/j.immuni.2011.02.012 |
| [12] | Shichita T, Konoeda F, Yoshimura A. Role of T lymphocytes in ischemic brain injury[J]. Clinical neurology,2010, 50 (11) : 878 –880. DOI:10.5692/clinicalneurol.50.878 |
| [13] | Zhang J, Mao X, Zhou T. IL-17A contributes to brain ischemia reperfusion injury through calpain-TRPC6 pathway in mice[J]. Neuroscience,2014, 274 : 419 –428. DOI:10.1016/j.neuroscience.2014.06.001 |
| [14] | Doycheva D, Shih G, Chen H, et al. Granulocyte-colony Stimulating Factor in Combination with Stem Cell Factor Confers Greater Neuroprotection after Hypoxic-Ischemic Brain Damage in the Neonatal Rats than a Solitary Treatment[J]. Translational Stroke Research,2012, 4 (2) : 171 –178. DOI:10.1007/s12975-012-0225-2 |
| [15] | Jin K, Mao X O, Sun Y. Stem cell factor stimulates neurogenesis in vitro and in vivo[J]. J Clin Invest,2002, 110 (3) : 311 –319. DOI:10.1172/JCI15251 |



