基质金属蛋白酶(matrix metalloproteinases,MMPs) 是一类活性依赖锌离子的蛋白水解酶,主要参与组织重塑和细胞外基质降解[1]。据文献报道,人体内至少有23个MMPs家族成员。正常情况下,MMPs的表达及活性是由MMPs的激动剂和抑制剂相互作用而精密调节的,一旦这些因素失衡将导致MMPs的活性失调,从而引起多种疾病,包括心血管疾病,关节炎,神经退行性变以及癌症[2]。MMP21基因是MMPs家族中的一员。研究发现MMP21基因在多个物种胚胎早期发育过程中均有表达,并且其表达具有严格的时间和空间特异性,提示其在胚胎发育过程中可能发挥重要作用[3],但目前关于 MMP21 基因的研究主要集中在肿瘤的侵袭转移方面,关于其在胚胎早期发育中的作用少有研究。
先天性心脏病是最常见的出生缺陷,全球范围其发生率高达9‰[4],是5岁以下儿童死亡的主要原因。心脏环化是心脏发育过程中的关键事件。早期心脏呈一个直线型的管状心泵,随着胚胎发育,管状心泵逐渐扭转成一个螺旋的环状结构,此过程称为心脏环化(cardiac looping)[5]。心脏环化不仅打破了胚胎左右对称的局面,还与后续心脏结构的形成密切相关,异常的心脏环化可能会引起多种先天性心脏病,如:房室间隔缺损、右室双出口、左室双入口、大动脉转位和永存动脉干等[6]。斑马鱼在胚胎发育研究特别是在心脏发育方面有独特的优势,被称为“心脏发育的窗口”[7-8] 。本研究拟以斑马鱼为模式动物,通过显微注射MMP21-MO建立MMP21基因敲低模型,研究MMP21基因在斑马鱼胚胎发育过程中的作用。
1 材料与方法 1.1 材料 1.1.1 实验动物实验用鱼为AB系野生型斑马鱼,由重庆医科大学基础医学院发育生物学研究室提供。斑马鱼饲养于循环水系统中,保持水温28.5℃左右,雌雄分开饲养,每天3次按时喂以丰年虫,给予14 h 光照/10 h黑暗的人工光照周期。斑马鱼胚胎置于Holtfreter培养液中,在28.5℃恒温箱中培育。
1.1.2 主要试剂TRIzol 购自 Invitrogen 公司(美国);逆转录试剂盒购自Takara公司(大连);2×Taq PCR Master Mix购自北京强欣博瑞生物技术有限公司;pGEM-T easy载体系统购自promega公司(美国);RNeasy Mini Kit购自QIAGEN公司(德国); T7 RNA polymerase,Dig-RNA labeling kit,Anti-Digoxigenin-AP,Fab fragments和BM Purple AP Substrate均购自Roche公司(瑞士);低熔点琼脂糖购自Genview(美国);引物合成及测序由上海英骏生物技术有限公司合作完成。
1.1.3 主要仪器设备NARISHIGE显微注射装置(日本);SUTTER P-97 拉针仪(美国);GSG-2000 核酸/蛋白凝胶图像分析管理系统(珠海黑马医学仪器有限公司);蔡司体视显微镜SteREO Discovery.V20(德国)。
1.2 方法 1.2.1 吗啉反义寡核苷酸及显微注射本研究设置4个不同浓度梯度的MMP21注射组(0.5、0.75、1 mmol/L 和1.5 mmol/L),以标准对照吗啡啉反义寡核苷酸(Con-MO)注射组和野生型(WT)组为对照。本研究所用的MMP21-MO是针对MMP21基因4号外显子/4号内含子剪切位点设计[9],其与目标位点特异性结合会阻断MMP21基因4号内含子的剪切,从而达到下调MMP21基因表达的目的。本文所用MO均由Gene-Tool公司合成,Con-MO序列:5′-CCTCTTACCTCAGTTACAATTTATA-3;MMP21-MO序列:5′-GTTGTATATTTGTTCACTGACCCGT-3。注射前一天将雌雄以1 :1比例放于透明鼠笼,中间以隔板隔开,次日早上,光照开始后将隔板抽离,雄鱼追逐雌鱼,见产卵后,及时收集鱼卵,选择1~2细胞期胚胎进行注射。
1.2.2 RT-PCR为了验证MMP21-MO的有效性,本研究在10体节期收集注射 MMP21-MO的胚胎,并以相同时期野生型胚胎为对照,以RT-PCR方法检测 MMP21基因mRNA的表达。正向引物设计于3号外显子,反向引物设计于5号外显子,序列见表 2。 TRIzol法提取胚胎总RNA,按逆转录试剂盒说明书将其逆转录为cDNA,以cDNA为模板进行PCR扩增。反应条件: 94 ℃预变性 1 min;94 ℃变性 10 s,55 ℃退火 15 s,72 ℃ 延伸45 s,30 个循环;72 ℃延伸 5 min。扩增产物经琼脂糖凝胶电泳,溴乙啶染色,凝胶成像仪成像。
| 组别 | n | 畸形数(%) | 死亡数(%) |
| WT组 | 206 | 5(2.4) | 7(3.4) |
| Con-MO组(1 mmol/L) | 202 | 33(16.3)a | 13(6.4) |
| MMP21-MO组 | |||
| 0.5 mmol/L | 213 | 45(21.1)a | 21(9.9)a |
| 0.75 mmol/L | 339 | 137(40.0)ab | 82(24.2)ab |
| 1.0 mmol/L | 330 | 183(55.4)ab | 106(32.1)ab |
| 1.5 mmol/L | 334 | 140(41.9)ab | 170(50.9)ab |
| a:P<0.05,与WT组比较;b:P<0.05,与1 mmol/L Con-MO组比较 | |||
1.2.3 整胚原位杂交
整胚原位杂交技术检测受精后28 h(hours post fertilization,hpf)和受精后48 h时cmlc 2 的表达以观察抑制MMP21基因对斑马鱼心脏环化前期阶段以及心脏环化的影响。 收集各组受精后28 h 和受精后48 h胚胎,4%新鲜多聚甲醛4 ℃过夜固定,双氧水脱色素,4%多聚甲醛固定20 min,甲醇梯度脱水,保存于-20℃。PBST梯度水化胚胎,4%多聚甲醛固定20 min。蛋白酶K消化,4%多聚甲醛固定20 min。HYB-溶液,60 ℃水浴5 min,HYB+溶液预杂交4 h。吸出HYB+,加入适量探针溶液,60℃过夜。回收探针,梯度SSCT溶液洗脱,MABT溶液洗2次。封闭液封闭1 h,加入抗地高辛抗体,4 ℃过夜。10%热灭火山羊血清置换25 min,MABT溶液洗脱3次,时间分别为25 min、1 h和25 min。染色缓冲液洗2次,BM Purple AP Substrate染色。达到染色效果后,PBST漂洗2次,4%多聚甲醛固定以终止染色。
1.2.4 斑马鱼心率记数胚胎发育至受精后24、48 h和72 h时,各组随机挑选20枚胚胎于解剖镜下计数15秒斑马鱼心跳数,再乘以4得到斑马鱼心率。
1.2.5 斑马鱼心室收缩分数的测量各组斑马鱼胚胎发育至受精后72 h时,将其固定于低熔点琼脂糖中,体视显微镜拍摄胚胎心动周期。按以下公式计算心室收缩分数(ventricular shortening fraction,VSF): VSF=(舒张期心室长径-收缩期心室长径)/舒张期心室长径×100%
1.3 统计学分析实验均重复3次,数据以x±s表示,采用SPSS 21.0统计软件。多组间均数比较采用单因素方差分析,两组间率的比较采用χ2检验。
2 结果 2.1 MMP21-MO的效率验证WT组PCR扩增产物大小为500 bp左右,MMP21-MO组不但有正常条带(wt),还出现异常扩增条带(mo),其大小为750 bp左右(图 1)。MMP21-MO注射组中出现的异常条带说明4号内含子(261 bp)剪切受到抑制,因此验证了该MMP21-MO能够有效地抑制MMP21基因的表达。
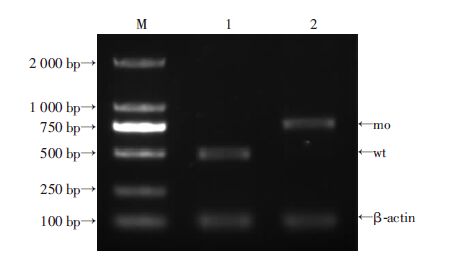
|
| M:DL 2000标准;1:WT组;2:MMP21-MO组;wt:正常条带;mo:异常条带;β-actin:内参基因 图 1 RT-PCR检测WT组和MMP21-MO注射组MMP21基因表达情况 |
2.2 不同剂量MMP21-MO对斑马鱼胚胎发育的影响
在胚胎发育至受精后72 h时解剖显微镜下观察各组胚胎发育情况,并统计各组胚胎死亡率和畸形率(表 1)。0.5、0.75、1 mmol/L MMP21-MO注射组随着注射浓度增加斑马鱼胚胎死亡率及畸形率逐渐增加。1 mmo/L MMP21-MO组具有最高的畸形率和较低的死亡,为最适的注射浓度。该组大部分胚胎畸形表型一致,主要表现为不同程度心前区水肿、心脏环化异常、心脏搏动减弱、心率减慢(图 2)。1.5 mmol/L注射组胚胎死亡率最高,畸形最严重,除上述表型外还出现近心端卵黄缺损,尾部向背部弯曲等表型。
| 引物 | 序列 | 产物大小(bp) |
| MMP21 | 正义链 5′-GGCGTTATGGATGACGAT-3′
反义链 5′-TGGGACGGTGAAATGTTC-3′ | 496 |
| β-actin | 正义链 5′-ATGCCCCTCGTGCTGTTTTC-3′
反义链 5′-GCCTCATCTCCCACATAGGA-3′ | 100 |

|
| A:WT组;B:1 mmol/L Con-MO注射组;C:1 mmol/L MMP21-MO注射组;箭头示心前区水肿 图 2 1 mmol/L MMP21-MO注射组受精后72 h斑马鱼 胚胎发育异常情况(体视显微镜 ×45) |
2.3 MMP21基因表达下调对斑马鱼心脏环化的影响
受精后28 h时期原位杂交结果显示心脏环化前期阶段(cardiac jogging)的情况:野生型斑马鱼线性心管偏向中线左侧(图 3A)。1 mmol/L MMP21-MO注射组出现两种异常表型:线性心管位于中线(图 3B)和线性心管位于中线右侧(图 3C),所占比例分别为14.3%和25.0%(图 3D)。受精后48 h时期原位杂交结果显示心脏环化(cardiac looping)的情况:此时野生型斑马鱼心室位于心房右侧(图 3E);1 mmol/L MMP21-MO注射组环化方向出现异常,心房心室未发生环化,均位于中线(图 3F);心房心室反向环化使心室位于心房左侧(图 3G),所占比例分别为25.5%和20.3%(图 3H)。
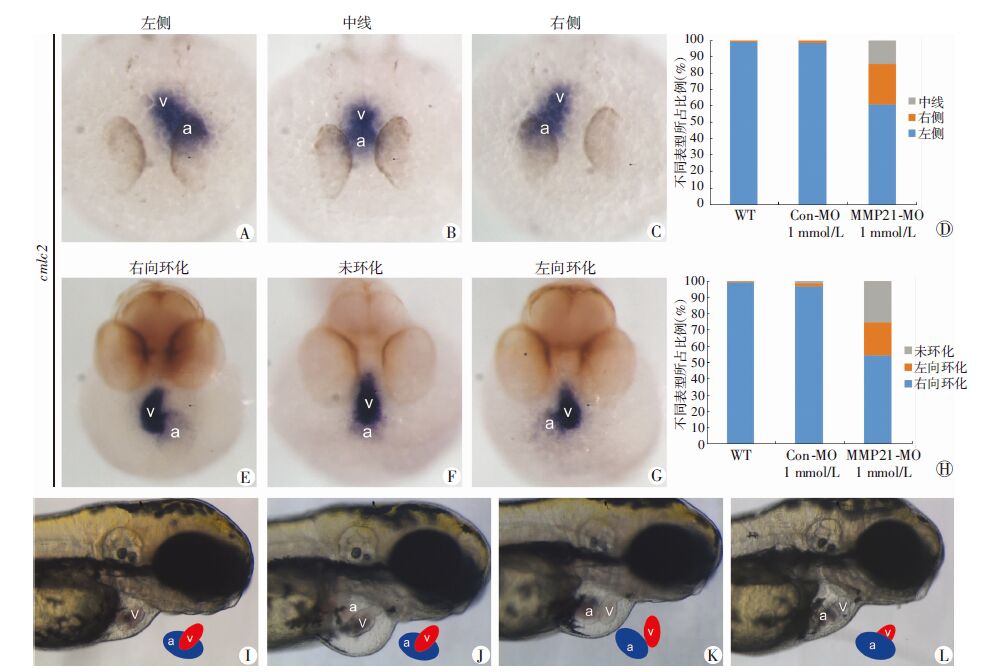
|
| A、B、C、E、F、G:整胚原位杂交;A~C:受精后28 h时cmlc 2 的表达;D:受精后28 h时各组胚胎cmlc 2 表达分类统计;E~G:受精后48 h时cmlc 2 的表达;H: 受精后48 h时各组胚胎cmlc 2 表达分类统计;I、J、K、L:受精后72 h活体胚胎(体视显微镜×150)及心房、心室位置示意图;a:心房;v:心室 图 3 MMP21基因下调后斑马鱼心脏异常表型 |
受精后72 h时野生型斑马鱼心脏形态及功能基本发育完全,野生型斑马鱼胚胎心脏形态如图所示(图 3I),心房位于右侧,心室位于左侧,右面观见心房心室部分重叠。本研究于受精后72 h在体视显微镜下观察斑马鱼胚胎心脏形态,同样证实MMP21基因表达下调会导致斑马鱼心脏环化异常。1 mmol/L MMP21-MO注射组胚胎心脏分为3种表现:心房心室位置正常(图 3J)、心房心室位于1条直线(图 3K)和心房位于右侧心室位于左侧(图 3L),同时伴有不同程度心前区水肿。
2.4 MMP21基因表达下调引起斑马鱼心脏功能障碍于受精后24 、48、72 h 3个时间点分别计数WT组、Con-MO组和MMP21-MO组斑马鱼心率。3组胚 胎心率随着发育时间延长逐渐增加。Con-MO各时间点胚胎心率与WT组比较,差异无统计学意义。MMP21-MO组 分别与WT组和Con-MO组比较,MMP21-MO组胚胎各时间点心率均明显降低,且差异具有统计学意义(图 4)。
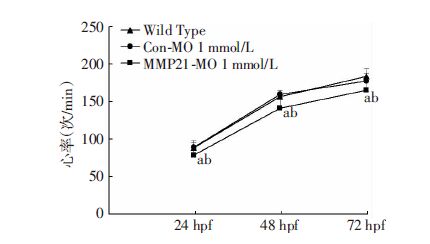
|
| a:P<0.05,与WT组比较;b:P<0.05,与Con-MO比较 图 4 MMP21基因下调对斑马鱼心率的影响(n=20) |
VSF是评价心脏收缩功能的重要指标之一。Con-MO组与WT组[(24.52±9.38)%]比较,Con-MO组VSF[(20.64±8.62)%]略有降低,但差异无统计学意义(P=0.46); MMP21-MO组[(10.25±7.39)%]分别与WT组和Con-MO组比较,MMP21-MO组 VSF明显降低,且差异具有统计学意义(P<0.05)。
3 讨论心脏环化是心脏形态发生过程中的一个重要步骤,心脏环化异常可能导致房室间隔发育延迟以及位置异常,因而导致心腔和血管之间组装出现问题,最终引起右室双出口、左室双入口和法洛四联征等先天性心脏病。受精后28 h时cardiac jogging基本完成,斑马鱼心脏呈一个前后走向的管状结构,心管心室端靠后且位于中线位置,心房端靠前并偏向左侧。随后心房心室结构形成,在受精后36 h开始心脏环化,于受精后48 h心脏环化基本完成,此时心室位于右侧,心房位于左侧[8, 10]。斑马鱼cardiac jogging过程与哺乳动物心脏环化前期阶段高度相似,有文献报道心脏环化早期阶段原始心管的方向预示着心脏环化的方向[11]。心脏环化过程精确且复杂,其相关机制并未阐明。
人类胚胎大脑、肾脏和肝脏组织中能检测到MMP21基因的表达,小鼠体内检测MMP21基因发现其在胚胎7 d内呈低表达,于11 d表达量增加,15 d或17 d表达量又降低,MMP21基因表达的时间和空间特异性提示其在胚胎发育过程中可能发挥重要作用[3]。近期,有文献报道人类MMP21基因的突变会导致内脏异位综合征,出现包括完全大动脉转位、房室间隔缺损和肺动脉异位连接等心脏缺陷[9]。MMP21基因结构中含有Tcf-4转录因子结合位点,荧光素酶报告基因实验证实其可能是wnt信号通路的靶基因[3]。多项研究发现wnt信号通路参与心脏环化过程。在斑马鱼体内敲低wnt信号通路中的重要基因β-catenin 1和β-catenin 2 发现心脏环化前期线性心管方向和心脏环化方向异常[12]。除此之外,小鼠体内wnt3a缺失发现45%胚胎出现心脏反向环化[13]。MMPs于1962年首次被发现,其主要依靠降解细胞外基质(extracellular matrix,ECM)以及参与组织重塑过程发挥生物学效应。鸡胚在7体节期暴露广谱MMPs抑制剂抑制了MMPs对ECM的降解出现心脏环化方向异常[14]。在斑马鱼的研究中发现敲低细胞表面存在的ECM受体整合素αV和β1b出现Kupffer′s vesicle发育异常以及心脏环化异常[15-16]。
本研究通过显微注射MO的方法敲低MMP21基因,发现MMP21-MO注射组胚胎发育畸形,主要表现为心前区水肿,心脏环化异常,心功能缺陷。并用整胚原位杂交方法检测心脏特异标志物cmlc 2 ,证实下调MMP21基因的表达会使心脏环化早期阶段(cardiac jogging)和心脏环化(cardiac looping)阶段出现异常。随着心脏发育进入尾声,在体视显微镜下观察受精后72 h时期胚胎,表型仍然存在。此外,通过计数斑马鱼心率和测量VSF评估斑马鱼心脏功能发现MMP21下调导致斑马鱼心功能受损。本研究初步证实了MMP21基因参与心脏环化过程,但其相关机制还有待进一步研究。
综上所述,本研究成功建立斑马鱼MMP21基因敲低模型,发现MMP21基因参与调节心脏环化过程。本研究为进一步探讨MMP21基因在心脏环化中的作用奠定了基础,同时丰富了先天性心脏病发病病因,为早期诊断和治疗先天性心脏病提供了新思路。
| [1] | Mittal R, Patel A P, Debs L H, et al. Intricate Functions of Matrix Metalloproteinases in Physiological and Pathological Conditions[J]. J Cell Physiol,2016, 231 (12) : 2599 –2621. DOI:10.1002/jcp.25430 |
| [2] | Tokito A, Jougasaki M. Matrix Metalloproteinases in Non-Neoplastic Disorders[J]. International Journal of Molecular Sciences,2016, 17 (7) : 1178 . DOI:10.3390/ijms17071178 |
| [3] | Marchenko G N, Marchenko N D, Strongin AY. The structure and regulation of the human and mouse matrix metalloproteinase-21 gene and protein[J]. Biochem J,2003, 372 (Pt 2) : 503 –515. DOI:10.1042/BJ20030174 |
| [4] | 余章斌, 韩树萍, 陈小慧, 等. 系统评价国内外围产儿先天性心脏病的发生率[J]. 中国循证儿科杂志,2014, 9 (4) : 252 –259. Yu Zhangbin Han Shuping Chen Xiaohui, et al. Systematic review of the prevalence of perinatal congenital heart disease[J]. Chin J Evid Based Pediatr,2014, 9 (4) : 252 –259. DOI:10.3969/j.issn.1673-5501.2014.04.003 |
| [5] | Männer J. The anatomy of cardiac looping: a step towards the understanding of the morphogenesis of several forms of congenital cardiac malformations[J]. Clin Anat,2009, 22 (1) : 21 –35. DOI:10.1002/ca.20652 |
| [6] | Ramsdell AF. Left-right asymmetry and congenital cardiac defects: getting to the heart of the matter in vertebrate left-right axis determination[J]. Dev Biol,2005, 288 (1) : 1 –20. DOI:10.1016/j.ydbio.2005.07.038 |
| [7] | Liu J, Stainier D Y. Zebrafish in the study of early cardiac development[J]. Circ Res,2012, 110 (6) : 870 –874. DOI:10.1161/CIRCRESAHA.111.246504 |
| [8] | Bakkers J. Zebrafish as a model to study cardiac development and human cardiac disease[J]. Cardiovasc Res,2011, 91 (2) : 279 –288. DOI:10.1093/cvr/cvr098 |
| [9] | Guimier A, Gabriel G C, Bajolle F, et al. MMP21 is mutated in human heterotaxy and is required for normal left-right asymmetry in vertebrates[J]. Nat Genet,2015, 47 (11) : 1260 –1263. DOI:10.1038/ng.3376 |
| [10] | Stainier D Y. Zebrafish genetics and vertebrate heart formation[J]. Nat Rev Genet,2001, 2 (1) : 39 –48. DOI:10.1038/35047564 |
| [11] | Khodiyar Varsha K, Howe Doug, Talmud Philippa J, et al. From zebrafish heart jogging genes to mouse and human orthologs: using Gene Ontology to investigate mammalian heart development.. F1000Res, . DOI:10.12688/f1000research.2-242.v2 |
| [12] | Zhang M, Zhang J, Lin S C, et al. β-Catenin 1 and β-catenin 2 play similar and distinct roles in left-right asymmetric development of zebrafish embryos[J]. Development,2012, 139 (11) : 2009 –2019. DOI:10.1242/dev.074435 |
| [13] | Nakaya M A, Biris K, Tsukiyama T, et al. Wnt3a links left-right determination with segmentation and anteroposterior axis elongation[J]. Development,2005, 132 (24) : 5425 –5436. DOI:10.1242/dev.02149 |
| [14] | Linask K K, Han M, Cai D H, et al. Cardiac morphogenesis: matrix metalloproteinase coordination of cellular mechanisms underlying heart tube formation and directionality of looping[J]. Dev Dyn,2005, 233 (3) : 739 –753. DOI:10.1002/dvdy.20377 |
| [15] | Gao W, Xu L, Guan R, et al. Wdr18 is required for Kupffer′s vesicle formation and regulation of body asymmetry in zebrafish[J]. PLoS ONE,2011, 6 (8) : e23386 . DOI:10.1371/journal.pone.0023386 |
| [16] | Ablooglu A J, Tkachenko E, Kang J, et al. Integrin V is necessary for gastrulation movements that regulate vertebrate body asymmetry[J]. Development,2010, 137 (20) : 3449 –3458. DOI:10.1242/dev.045310 |



