星形胶质细胞活化(astrogliosis)是中枢神经系统损伤的重要病理生理学过程,主要表现为星形胶质细胞增殖、肥大、分泌各种炎症因子及细胞外基质[1]。星形胶质细胞的过度活化是中枢神经系统损伤过程中造成二次损伤的主要因素之一[2-4],尤其是星形胶质细胞活化后期所形成的胶质瘢痕是阻碍神经元轴突再生的主要障碍[2, 5-6]。研究表明,炎症是导致星形胶质细胞增殖活化和胶质瘢痕形成的主要原因[5]。目前,如何减少中枢神经系统损伤后过度的炎症反应和星形胶质细胞的活化是中枢神经系统损伤的主要研究方向之一。
莱菔硫烷又名萝卜硫素,是在西兰花等十字花科植物中提取出的天然生物活性物质,具有显著的抗氧化、抗肿瘤、抗炎等广泛作用[7-9];作为常见的抗氧化、抗炎物质,我们的前期研究已证实莱菔硫烷可以抑制小鼠脊髓损伤后损伤部位炎症因子的分泌,抑制胶质瘢痕的形成[10]。本实验通过体外LPS刺激星形胶质细胞活化增殖并施以莱菔硫烷干预,利用CCK8实验、Ki67免疫荧光染色、流式细胞仪分析细胞周期、Western blot检测细胞周期相关蛋白表达等方法,进一步探讨莱菔硫烷对星形胶质细胞活化增殖的作用及可能的机制。
1 材料与方法 1.1 实验动物与材料 1.1.1 实验动物健康雌性及雄性ICR小鼠由第三军医大学大坪医院野战外科研究所实验动物中心提供,饲养于西南医院SPF级动物房,出生1~3d的ICR乳鼠均由该小鼠繁殖而来。实验严格遵照第三军医大学实验动物实验管理规定进行。
1.1.2 主要试剂及药品山羊源GFAP抗体(Abcam,英国),兔源S100β抗体(Sigma,美国),兔源Cyclin D1抗体(Boster,中国),兔源Ki67抗体(Abcam,英国),兔源PCNA抗体(Boster,中国),小鼠源P27kip1抗体(Boster,中国),小鼠源β-actin抗体(Santa Cruz,中国),Cy3 驴抗兔二抗(Santa Cruz,美国),FITC驴抗羊二抗(Santa Cruz,美国),DMEM/F12(HyClone,美国),0.25%胰蛋白酶(HyClone,美国),胎牛血清(Gibico,美国),莱菔硫烷(LKT,美国),CCK8试剂盒(Dojindo,日本),细胞周期检测试剂盒(贝博生物,中国)。
1.1.3 主要仪器多功能酶标仪(Thermo Fisher,美国),Western blot设备(Bio-Rad,美国),冷冻离心机(Eppendorff,德国),激光共聚焦显微镜(Carl Zeiss,德国),CO2细胞孵箱(Thermo Fisher,美国)。
1.2 方法 1.2.1 原代小鼠皮层星形胶质细胞培养与鉴定取出生1~3d内的ICR乳鼠,75%酒精消毒后迅速断头,逐层剪开皮肤及颅骨,从颅底完整取出脑组织置于冰HBSS缓冲液中。体视显微镜下分离大脑皮层,完整剥除脑膜。剪碎皮层组织,0.25%胰蛋白酶37 ℃消化10 min后加入完全培养基(含10%胎牛血清DMEM/F12)终止消化。反复轻柔吹打组织,70 μm滤网过滤。滤液1 000 r/min离心5 min,弃上清,加入新鲜完全培养基重悬细胞后接种于细胞培养瓶中,移入5% CO2、37 ℃孵箱培养。2~3 d换液1次,培养第9天细胞完全融合后,转移至恒温定轨摇床230 r/min、37 ℃摇床22 h后换液,剩余贴壁细胞胰酶消化后接种至激光共聚焦培养皿及6孔板中,行GFAP及S100β双标鉴定,阳性细胞达95%以上。细胞在接种后48 h行LPS及莱菔硫烷分组进行干预。
1.2.2 CCK8法检测星形胶质细胞增殖将纯化的星形胶质细胞按3 000个/孔接种至96孔板中。细胞贴壁18 h后将培养基更换为无血清DMEM/F12细胞处理24 h后转为含1%胎牛血清的DMEM/F12。设空白对照组、LPS刺激组、DMSO+LPS组、LPS+莱菔硫烷(10、15、20 μmol/L)干预组。每组5个复孔,干预24 h。干预结束后各孔分别加入10 μL CCK8溶液,37 ℃ 孵育2 h后,使用多功能酶标仪在450 nm波长读取D(450)值。
1.2.3 免疫荧光双标染色测定Ki67阳性细胞率细胞干预后,4%多聚甲醛固定细胞30 min,PBS漂洗3次,0.25% Triton X-100细胞通透10 min后,5% BSA封闭2 h,羊源GFAP抗体及兔源Ki67抗体分别孵育过夜,PBS漂洗后,孵育相应的荧光二抗、DAPI染核后封片,置激光共聚焦显微镜下观察,计算Ki67、GFAP双标阳性细胞率。
1.2.4 流式细胞仪测定各组细胞周期原代星形胶质细胞接种于6孔板中,细胞70%融合时,施以上述干预,24 h后0.25%胰蛋白酶消化细胞,收集细胞于EP管中,75%冰乙醇-20℃固定1 h,冷PBS洗涤、重悬细胞后加入RNase A溶液,37 ℃水浴30 min,400目筛网过滤后加入400 μL PI,混匀后4 ℃避光孵育30 min,流式细胞仪上机检测,最大激发波长488 nm。
1.2.5 Western blot检测各组PCNA、CyclinD1、P27kip1蛋白表达纯化的原代皮层星形胶质细胞接种于6孔板中,待细胞达80%融合时,按空白对照组、LPS刺激组、DMSO+LPS组、LPS+20 μmol/L SFN组分别施加干预。24 h后,RIPA裂解液裂解细胞提取蛋白,BCA法测定蛋白浓度,取20 μg蛋白样品上样,100 V电泳1.5 h,200 mA转膜2 h,5% BSA室温封闭2 h,加入不同一抗4 ℃孵育过夜;洗膜,室温孵育二抗2 h,Bio-Rad凝胶成像仪显影,使用Image Lab软件分析条带,检测各组PCNA、CyclinD1、P27kip1表达水平。
1.3 统计学分析采用SPSS 18.0软件进行数据分析,数据均以x±s 表示,多组间比较采用单因素方差分析。
2 结果 2.1 星形胶质细胞的培养和免疫荧光鉴定星形胶质细胞贴壁生长,呈铺路石样紧密排列,细胞折光度低(图 1A)。免疫荧光染色显示几乎所有细胞表达均表达胶质细胞标志S100β,95%以上细胞表达星形胶质细胞标志GFAP(图 1B)。
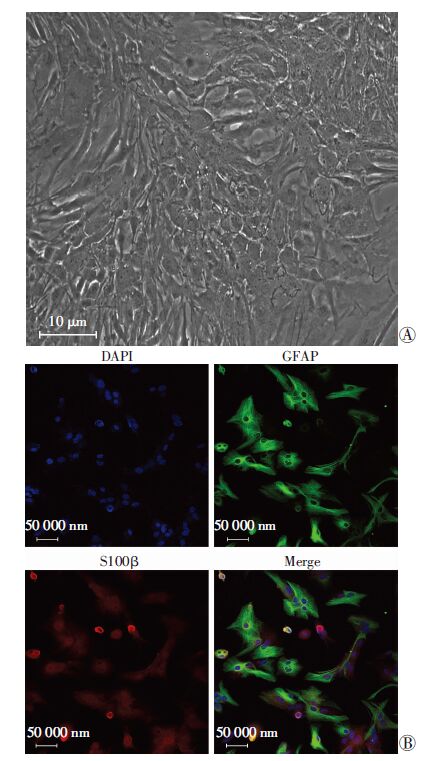
|
| A:相差显微镜下原代培养的星形胶质细胞形态;B:S100β、GFAP免疫荧光双标染色鉴定原代培养的星形胶质细胞 图 1 星形胶质细胞培养与鉴定 |
2.2 SFN对LPS诱导星形胶质细胞增殖的影响
0.1μg/mL LPS可明显刺激星形胶质细胞增殖(P<0.01),DMSO组对LPS刺激的星形胶质细胞增殖无明显影响,10 μmol/L SFN对刺激后星形胶质细胞的增殖较LPS刺激组无明显影响,LPS刺激星形胶质细胞的同时分别给予15、20 μmol/L SFN,可明显抑制LPS诱导的星形胶质细胞增殖(P<0.05),其中20 μmol/L SFN对LPS诱导的星形胶质细胞增殖抑制更明显(P<0.01)。见图 2。
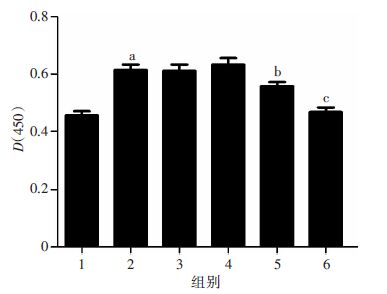
|
| 1:空白对照组;2:LPS组;3:LPS+DMSO组;4:LPS+10 μmol/L SFN组;5:LPS+15 μmol/L SFN组;6:LPS+20 μmol/L SFN组;a:P<0.01,与空白对照组比较; b:P<0.05,c:P<0.01,与LPS组及LPS+DMSO组比较 图 2 CCK8法检测不同浓度SFN对LPS刺激星形胶质细胞增殖的作用 |
2.3 SFN对LPS刺激后星形胶质细胞Ki67阳性率的影响
0.1μg/mL LPS刺激星形胶质细胞24 h后Ki67阳性细胞率较空白对照组明显增加,DMSO组Ki67阳性细胞率较LPS刺激组无明显改变,20 μmol/L SFN组可显著减少LPS刺激下Ki67阳性细胞率。见图 3。
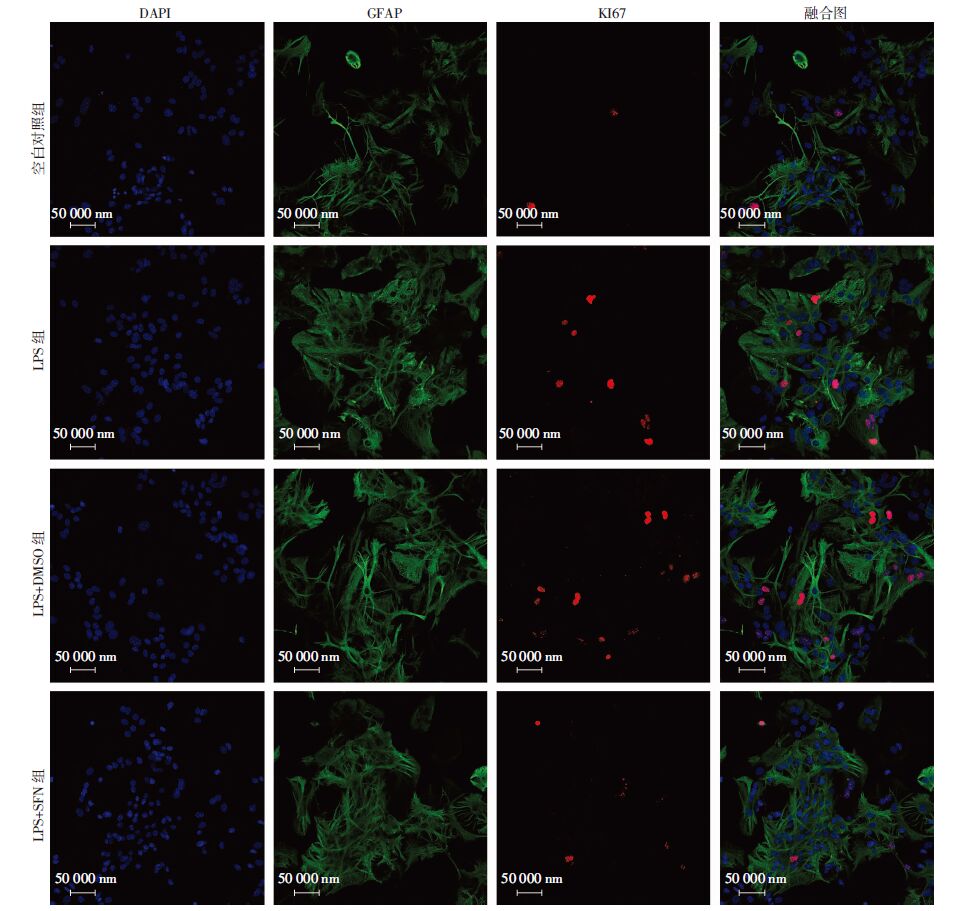
|
| 图 3 Ki67、GFAP双标免疫荧光染色检测各组星形胶质细胞增殖情况 |
2.4 SFN对LPS诱导星形胶质细胞周期的影响
0.1μg/mL LPS刺激使细胞S期比例增加而G1期比例降低(P<0.05),DMSO组各期比例较LPS刺激组无明显变化,给予SFN可降低LPS刺激后处于S期细胞的比例及S期+G2/M期细胞比例(P<0.05),升高G1期细胞比例(P<0.05)。见图 4。
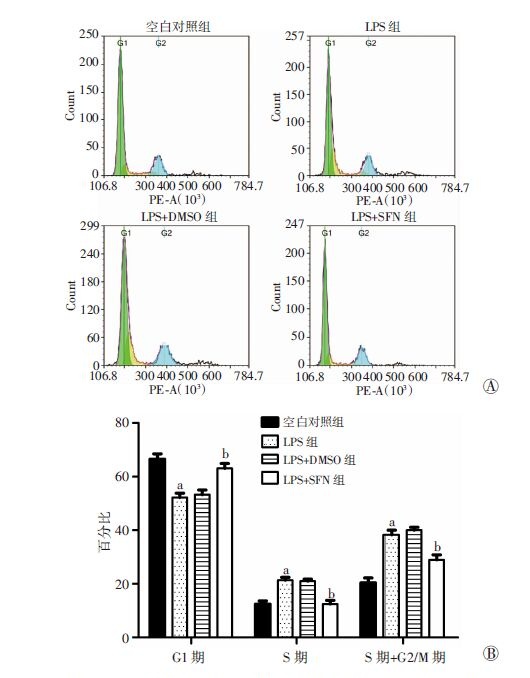
|
| A:流式细胞仪检测结果;B:细胞周期统计结果;a:P<0.05,与空白对照组比较;b:P<0.05,与LPS组和LPS+DMSO组比较 图 4 流式细胞仪检测各组细胞周期 |
2.5 SFN对细胞周期及增殖相关蛋白PCNA、Cyclin D1、P27kip1表达的影响
Western blot检测各组细胞周期相关蛋白,LPS刺激后细胞表达PCNA较空白对照组明显增高(P<0.05),Cyclin D1表达也随LPS刺激明显增高(P<0.05),P27kip1表达较空白对照组下降(P<0.05),加用SFN干预后PCNA及CyclinD1较LPS刺激组降低(P<0.05),P27kip1表达较LPS刺激组有所升高(P<0.05),而DMSO+LPS组 PCNA、Cyclin D1、P27kip1表达较单纯LPS刺激组无明显影响,提示SFN可能通过调控P27kip1、CyclinD1表达进而影响星形胶质细胞增殖。见图 5。

|
| A:Western blot 检测结果 1:空白对照组;2:LPS组;3:LPS+DMSO组;4:LPS+SFN组; B:蛋白表达半定量分析结果;a:P<0.05,与空白对照组比较;b:P<0.05,与LPS组和LPS+溶剂组比较 图 5 Western blot 检测各组P27kip1、Cyclin D1、PCNA蛋白表达 |
3 讨论
莱菔硫烷是来源于天然植物中的活性成分,具有可通过血脑屏障、低毒性等特点。目前的研究证实其在脑卒中[11-12]、帕金森病[13]、阿尔茨海默病[14]等多种中枢神经系统疾病模型中均具有保护作用。而莱菔硫烷良好的抗炎、抗氧化药理作用也提示其在抑制星形胶质细胞过度增殖及胶质瘢痕形成中具有潜在的应用价值。
在离体研究中,LPS刺激诱导星形胶质细胞增殖活化是模拟神经系统损伤后炎症导致的星形胶质细胞增殖活化的常用模型[15-18]。故本实验采用了LPS刺激星形胶质细胞增殖模型,进一步研究莱菔硫烷对炎症诱导的星形胶质细胞增殖的作用。
我们通过CCK8法和Ki67免疫染色测定细胞增殖发现20 μmol/L SFN干预细胞时,可明显抑制LPS诱导的星形胶质细胞增殖;流式细胞周期检测结果提示在LPS的刺激下S期星形胶质细胞明显增多,处于静止状态的G1期细胞相应减少,而加用20 μmol/L SFN处理可以减少LPS刺激下S期细胞的比例,并降低处于增殖状态的细胞(S+G2/M期细胞)比例,溶剂对照组则未显示相应的改变。说明SFN可以通过调控星形胶质细胞的细胞周期,阻滞处于静止状态的G1期细胞向S期转化,从而抑制LPS导致的星形胶质细胞过度增殖。
Zhao等[15]在体外实验中运用LPS刺激星形胶质细胞模拟脊髓损伤后星形胶质细胞的增殖,发现一定剂量的LPS刺激体外培养的星形胶质细胞可以增加细胞内PCNA的表达,并且下调P27kip1从而促进星形胶质细胞增殖。张双伟等[19]发现脊髓损伤后P27kip1表达显著降低,且主要定位于星形胶质细胞,进而推断其可能与脊髓损伤后星形胶质细胞增殖有关。Chung等[20]发现莱菔硫烷可以通过下调SKP2稳定P27kip1,抑制人结肠癌细胞的增殖。我们的Western blot实验结果显示LPS处理星形胶质细胞后细胞增殖相关蛋白:PCNA、CyclinD1蛋白表达水平较对照组显著升高,加用SFN后可以减少PCNA和CyclinD1的表达量;而在LPS刺激下细胞周期负调控因子P27kip1的表达下降,加用SFN干预后P27kip1的表达较单纯LPS刺激组有所上升。这与细胞周期检测、CCK8细胞增殖实验和Ki67免疫荧光染色结果基本一致,说明SFN可能通过某种机制调控P27kip1等细胞周期相关调控蛋白的表达,进而抑制LPS诱导的星形胶质细胞增殖,其具体调控机制有待于进一步的实验探索。
中枢神经系统损伤发病率、致残、致死率高,目前尚缺乏有效的药物治疗手段。而中枢神经系统损伤后星形胶质细胞增殖活化形成的胶质瘢痕是阻碍中枢神经系统损伤后功能恢复的主要障碍之一。我们的体外研究初步揭示了莱菔硫烷对炎症诱导的星形胶质细胞增殖中的作用,为莱菔硫烷在中枢神经系统损伤中的应用提供了初步的基础依据。
| [1] | Escartin C, Bonvento G. Targeted activation of astrocytes: a potential neuroprotective strategy[J]. Mol Neurobiol,2008, 38 (3) : 231 –241. DOI:10.1007/s12035-008-8043-y |
| [2] | Fitch M T, Silver J. CNS injury, glial scars, and inflammation: Inhibitory extracellular matrices and regeneration failure[J]. Exp Neurol,2008, 209 (2) : 294 –301. DOI:10.1016/j.expneurol.2007.05.014 |
| [3] | Goldshmit Y, Kanner S, Zacs M, et al. Rapamycin increases neuronal survival, reduces inflammation and astrocyte proliferation after spinal cord injury[J]. Mol Cell Neurosci,2015, 68 : 82 –91. DOI:10.1016/j.mcn.2015.04.006 |
| [4] | Babaee A, Eftekhar-Vaghefi S H, Asadi-Shekaari M, et al. Melatonin treatment reduces astrogliosis and apoptosis in rats with traumatic brain injury[J]. Iran J Basic Med Sci,2015, 18 (9) : 867 –872. |
| [5] | Sofroniew M V. Molecular dissection of reactive astrogliosis and glial scar formation[J]. Trends Neurosci,2009, 32 (12) : 638 –647. DOI:10.1016/j.tins.2009.08.002 |
| [6] | Burda J E, Sofroniew M V. Reactive gliosis and the multicellular response to CNS damage and disease[J]. Neuron,2014, 81 (2) : 229 –248. DOI:10.1016/j.neuron.2013.12.034 |
| [7] | de Figueiredo S M, Binda N S, Nogueira-Machado J A, et al. The antioxidant properties of organosulfur compounds (sulforaphane)[J]. Recent Pat Endocr Metab Immune Drug Discov,2015, 9 (1) : 24 –39. DOI:10.2174/1872214809666150505164138 |
| [8] | Gali-Muhtasib H, Hmadi R, Kareh M, et al. Cell death mechanisms of plant-derived anticancer drugs: beyond apoptosis[J]. Apoptosis,2015, 20 (12) : 1531 –1562. DOI:10.1007/s10495-015-1169-2 |
| [9] | Lee J, Ahn H, Hong E J, et al. Sulforaphane attenuates activation of NLRP3 and NLRC4 inflammasomes but not AIM2 inflammasome[J]. Cell Immunol,2016, 306-307 : 53 –60. DOI:10.1016/j.cellimm.2016.07.007 |
| [10] | 廖小俊, 袁继超, 朱海涛, 等. 莱菔硫烷对小鼠脊髓损伤后后肢功能的作用[J]. 第三军医大学学报,2016, 38 (10) : 1066 –1072. Liao Xiaojun, Yuan Jichao, Zhu Haitao, et al. Effect of sulforaphane on hindlimb function after spinal cord injury in mice[J]. J Third Mil Med Univ,2016, 38 (10) : 1066 –1072. DOI:10.16016/j.1000-5404.201511182 |
| [11] | 吴雪梅, 巫静娴, 喻姗姗, 等. 莱菔硫烷对神经元氧糖剥夺/复氧损伤的保护作用[J]. 第三军医大学学报,2011, 33 (18) : 1907 –1911. Wu Xuemei, Wu Jingxian, Yu Shanshan, et al. Sulforaphane protects neurons against injury induced by oxygen-glucose deprivation/reoxygenation[J]. J Third Mil Med Univ,2011, 33 (18) : 1907 –1911. |
| [12] | Alfieri A, Srivastava S, Siow R C, et al. Sulforaphane preconditioning of the Nrf2/HO-1 defense pathway protects the cerebral vasculature against blood-brain barrier disruption and neurological deficits in stroke[J]. Free Radic Biol Med,2013, 65 : 1012 –1022. DOI:10.1016/j.freeradbiomed.2013.08.190 |
| [13] | Cook A L, Vitale A M, Ravishankar S, et al. NRF2 activation restores disease related metabolic deficiencies in olfactory neurosphere-derived cells from patients with sporadic Parkinson's disease[J]. PLoS ONE,2011, 6 (7) : e21907 . DOI:10.1371/journal.pone.0021907 |
| [14] | Zhang R, Miao Q W, Zhu C X, et al. Sulforaphane ameliorates neurobehavioral deficits and protects the brain from amyloid β deposits and peroxidation in mice with Alzheimer-like lesions[J]. Am J Alzheimers Dis Other Demen,2015, 30 (2) : 183 –191. DOI:10.1177/1533317514542645 |
| [15] | Zhao J, Zhang S, Wu X, et al. KPC1 expression and essential role after acute spinal cord injury in adult rat[J]. Neurochem Res,2011, 36 (3) : 549 –558. DOI:10.1007/s11064-010-0377-y |
| [16] | Hong P, Jiang M, Li H. Functional requirement of dicer1 and miR-17-5p in reactive astrocyte proliferation after spinal cord injury in the mouse[J]. Glia,2014, 62 (12) : 2044 –2060. DOI:10.1002/glia.22725 |
| [17] | Zhang H, Liu Y, Li Y, et al. The expression of CAP1 after traumatic brain injury and its role in astrocyte proliferation[J]. J Mol Neurosci,2014, 54 (4) : 653 –663. DOI:10.1007/s12031-014-0363-y |
| [18] | Zhao W, Wang Y, Shi W, et al. The expression of FBP1 after traumatic brain injury and its role in astrocyte proliferation[J]. J Mol Neurosci,2013, 51 (3) : 687 –694. DOI:10.1007/s12031-013-0049-x |
| [19] | 张双伟, 黄克伦, 陈毕, 等. p27kip1和Skp2在大鼠脊髓损伤过程中的表达变化及意义[J]. 中华神经外科杂志,2014, 30 (2) : 194 –199. Zhang Shuangwei, Huang Kelun, Chen Bi, et al. The expression and role of p27kip1/Skp2 after spinal cord injury in the rat model[J]. Chin J Neurosurg,2014, 30 (2) : 194 –199. DOI:10.3760/cma.j.issn.1001-2346.2014.02.027 |
| [20] | Chung Y K, Chi-Hung Or R, Lu C H, et al. Sulforaphane down-regulates SKP2 to stabilize p27(KIP1) for inducing antiproliferation in human colon adenocarcinoma cells[J]. J Biosci Bioeng,2015, 119 (1) : 35 –42. DOI:10.1016/j.jbiosc.2014.06.009 |



