肌肉生长抑制素(Myostatin,MSTN)又名生长分化因子8(growth differentiation factor 8,GDF8),属于转化生长因子β(transforming growth factor-β,TGF-β)超家族成员[1]。1997年MSTN首次被Mcpherron等[2]发现,它主要在骨骼肌中表达,控制成肌细胞的增殖和分化,是骨骼肌发育过程的一个重要负性调控因子。研究发现:敲除MSTN基因或MSTN自然突变会导致哺乳动物(鼠、兔、猪、牛等)骨骼肌纤维数量增多,肌细胞肥大,出现“双肌”表型。目前有大量关于成年MSTN敲除动物的研究,成年MSTN敲除动物的体质量、肌肉质量增加,肌纤维增粗[1, 3-5]。导致该表型的可能机制在于过表达MSTN基因会导致生肌调节因子MyoD和 Pax3 的表达下调以及肌萎缩相关基因 Atrogin-1 ,MuRF-1 和 ERK1/2 的表达上调,从而使肌纤维数量减少,体积减小。近年来,随着研究的不断深入,有研究发现MSTN除了影响骨骼肌的发育,还对脂肪分化、脂质聚集有一定的抑制作用,且与肌肉萎缩症、AIDS、心力衰竭等肌肉相关的疾病有关[6-9]。因此,研究MSTN基因的功能及其调控机制不仅有助于阐明骨骼肌生长发育和相关的调控机理,而且对肌肉相关疾病的诊断、治疗和预后有非常重要的临床意义。目前,利用各种基因敲除技术研究MSTN基因功能的报道很多,但主要是成年鼠的研究。本研究拟利用Cre-loxP技术构建MSTN基因敲除小鼠模型,研究MSTN基因敲除对哺乳期幼鼠骨骼肌生长的影响,并初步探讨其相关机制,为后续进行MSTN基因的功能研究提供一个良好的平台。
1 材料与方法 1.1 转基因鼠MSTN-loxP +/-和MCK-Cre+/-基因鼠通过北京维通利华实验动物技术有限公司从美国Jackson lab购买,货号分别为012685和006405。关于两种转基因鼠的属性详见Jackson lab网站介绍( http://jaxmice.jax.org/strain/012685.html ,http://jaxmice.jax.org/strain/006405.html)。
1.2 主要试剂DNA提取试剂盒购自美国KAPA公司;逆转录试剂盒购自日本TaKaRa公司; SYBR Mix、TRIzol购自美国Life Technologies 公司;Laminin抗体购自美国Sigma公司;引物由上海生工生物有限公司合成;牛血清白蛋白购自武汉博士德生物工程有限公司;免疫荧光染色试剂盒-抗兔Alexa Fluor 488、抗荧光淬灭剂购自碧云天生物技术研究所;枸橼酸盐抗原修复液购自北京中杉生物技术有限公司。
1.3 肌肉中MSTN基因敲除小鼠模型构建肌肉中MSTN基因敲除小鼠模型的构建过程如图 1所示。图 1A为两个品系基因鼠的转基因示意图:MSTN-loxP 基因鼠是在MSTN基因外显子3两端插入loxP片段;MCK-Cre 基因鼠是将MCK(一种肌肉特异性肌酐激酶,又称Ckmm)的启动子和Cre 相连,克隆到小鼠染色体上。由于MCK只在骨骼肌细胞中表达,因此,只有骨骼肌细胞中的Cre 能够被启动,从而发挥Cre对loxP的切除作用,特异地敲除骨骼肌细胞内MSTN基因。图 1 B展示了MSTN基因敲除小鼠的培育过程:MSTN-loxP+ / +小鼠与MCK-Cre + / - 小鼠杂交,得到MSTN-loxP + / - MCK-Cre+/- 小鼠,用该基因型小鼠与MSTN-loxP + / +小鼠再次杂交则有可能获得基因型为MSTN- loxP + / + MCK-Cre+/-的实验小鼠。
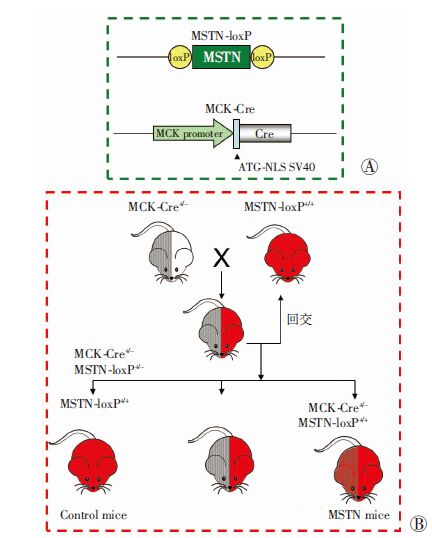
|
| A:两个品系基因鼠的转基因示意图;B:MSTN基因敲除小鼠的培育过程 红色代表loxP,灰色代表Cre 图 1 肌肉中MSTN基因特异性敲除鼠模型的培育示意图 |
1.4 基因型鉴定
操作步骤:(1)小鼠耳洞打孔做标记;(2)剪取小 鼠尾巴0.5~1.0 cm;(3)DNA提取及PCR:按照KAPA HS Mouse Genotyping Kit说明书进行操作。实验所用引物包括MSTN-LoxP(上游:5′-GCTGCAAACCATCCA-TTCTAA-3′,下游:5′-TCAATCGTTCATCCTAACAGG-3′,300 bp)、MCK-Cre(上游:5′-ACAAAAGGTTTTGCCCTCCT-3′,下游:5′-ACAAAAGGTTTTGCCCTCCT-3′,650 bp)以及内参IPC(上游:5′- CAAATGTTGCTTGT-CTGGTG-3′,下游:5′-GTCAGTCGAGTGCACA GTTT-3′,200 bp)。PCR反应: KAPA Mix 12.5 μL、上下游引物各1.25 μL、 样品DNA 1 μL、加ddH2O至总体积25 μL。反应条件为95 ℃预变性3 min,95 ℃ 变性15 s,60 ℃退火15 s,72 ℃延伸10 s,共35个循环,72 ℃ 延伸10 min,4 ℃保持;(4)电泳:根据电泳条带确定小鼠的基因型。
1.5 小鼠体质量与骨骼肌质量检测在特定时间点(第0、7、14、21天)分别称量野生型和MSTN基因敲除组小鼠的体质量,并进行比较;待21 d断奶时取小鼠腿部股四头肌、腓肠肌和胫骨前肌,称取质量,并测量胫骨长度,各块肌肉再分别与胫骨长度标化,比较小鼠肌肉质量。
1.6 采用RT-qPCR检测股四头肌 Atrogin-1 、 MuRF-1 表达使用TRIzol法提取小鼠股四头肌总RNA,用核酸蛋白检测仪测定样品RNA纯度和浓度,D(260)/D(280) 在1.8~2.0为合格样本。将mRNA反转录为cDNA,RT-qPCR检测肌肉萎缩盒F基因(muscle atrophy F-box,MAFbx,Atrogin-1 )(上游:5′-GCAAACACTGCCACATTCTCTC-3′,下游:5′-CTTGAGGGGA-AAGTGAGACG-3′,93 bp)、肌肉环状指基因1(muscle ringfinger-1,MuRF-1 )(上游:5′-GCTGGTGGAAAACATCATTGACAT-3′,下游:5′- CATCGGGTGGCTGCCTTT-3′,76 bp)的表达,反应条件:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 30 s,总40个循环。以β-actin(上游:5′- GTGCTATGTTGCTCTAGACTTCG-3′,下游:5′-ATGCCACAGGATTCCATACC-3′,174 bp)为内参,采用2-△△Ct法相对定量,每组设2个复孔,重复3次,计算平均值。
1.7 免疫荧光法检测肌纤维横截面积分别在21 d将野生型和MSTN基因敲除组小鼠颈椎脱臼处死,固定双下肢,用镊子、剪刀剥离皮毛暴露腿部肌肉,取股四头肌样品,10%福尔马林固定,包埋制成5 μm厚的石蜡切片。切片经脱蜡处理后进行抗原修复92 ℃ 15 min,PBS漂洗后用5%牛血清白蛋白封闭15 min,倒掉封闭液,加入一抗Laminin(兔源,浓度1 :200) 4 ℃孵育过夜,PBS漂洗后二抗Alexa Fluor 488(抗兔,浓度1 :300) 37 ℃孵育1 h,然后PBS漂洗后抗荧光淬灭剂封片,奥林普斯 BX51荧光显微镜下高倍视野观察照相。Image J 1.41软件计算股四头肌纤维横截面积。
1.8 统计学分析数据以x±s表示;采用Origin 8.0软件作图,SPSS 19.0 统计软件进行数据分析;组间比较采用两独立样本t检验,P<0.05 定为差异有统计学意义。
2 结果与分析 2.1 肌肉中MSTN基因敲除小鼠的鉴定肌肉中MSTN基因特异性敲除鼠的基因型为MSTN-loxP+/+MCK-Cre+/-,鉴定如图 1所示。若PCR产物仅300 bp条带,说明基因型为MSTN-loxP+/+,即loxP纯合子(图A中条带5);若PCR产物出现300 bp和363 bp条带,说明基因型为MSTN-loxP+/-,即loxP杂合子(图A中条带2、3、6、7);若PCR产物仅出现363 bp条带,说明基因型为MSTN-loxP -/-,即为野生型小鼠(图A中条带1、4)。同理,若PCR扩增出650 bp 条带,说明含有MCK-Cre(图B中条带b、c、d、e、g),反之,则为野生型小鼠(图B中条带a、f)。因此,若PCR扩增既表现为loxP纯合型又含有MCK-Cre,则表示其为MSTN基因敲除小鼠,基因型为MSTN-loxP+/+MCK-Cre+/-。
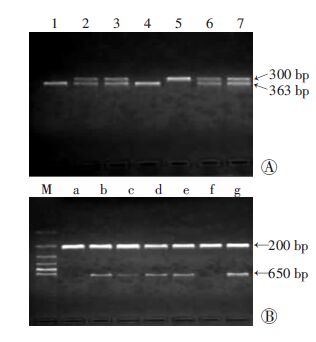
|
| A:loxP基因型鉴定 1、4:野生型(WT);2、3、6、7:loxP杂合型(MSTN-loxP+/-);5:loxP纯合型(MSTN-loxP+/+);B:Cre基因型鉴定 M:600 bp DNA标准;a、f:野生型(WT);b、c、d、e、g:MCK-Cre+/- 图 2 PCR法鉴定肌肉中MSTN基因特异性敲除鼠基因型 |
2.2 敲除MSTN基因对小鼠体质量的影响
仔鼠经鉴定分型后,分别在不同时间点(出生0、7、14、21 d)对野生型对照组(WT)和MSTN基因敲除组(KO)观察称量,MSTN基因敲除组小鼠从出生第1天开始体质量高于对照组,在第7、21天MSTN基因敲除组体质量明显高于对照组,差异具有统计学意义(P<0.05,图 3)。表明敲除MSTN使小鼠体质量显著增加。
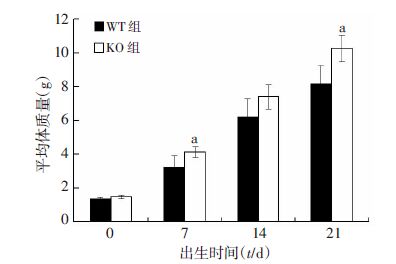
|
| a:P<0.05,与WT组比较 图 3 MSTN基因特异性敲除小鼠与野生型小鼠生长体质量变化 |
2.3 敲除MSTN基因对小鼠骨骼肌质量的影响
与野生型对照组(WT)相比,MSTN基因敲除组(KO)腿部股四头肌、腓肠肌、胫骨前肌的质量明显增加,差异具有统计学意义(P<0.01,图 4A),且分别与胫骨长度标准化后,KO组腿部股四头肌、腓肠肌、胫骨前肌质量显著高于WT组,两者差异具有统计学意义(P<0.01,图 4B)。
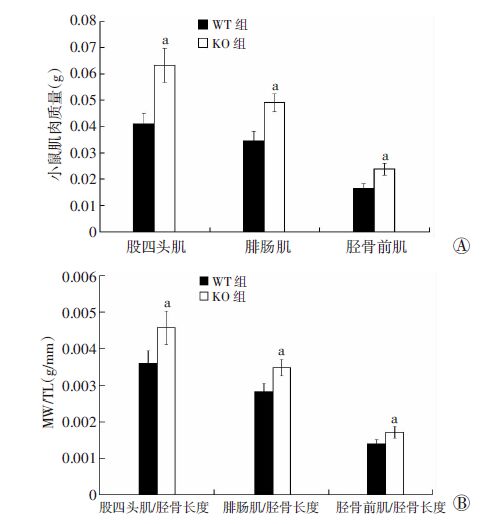
|
| A:WT组和KO组腿部肌肉质量比较;B:WT组和KO组腿部肌肉质量分别与胫骨长度标化后进行比较 a:P<0.01,与WT组比较;MW:肌肉质量;TL:胫骨长 图 4 MSTN基因特异性敲除小鼠与野生型小鼠腿部肌肉质量变化 |
2.4 敲除MSTN基因对小鼠肌纤维大小的影响
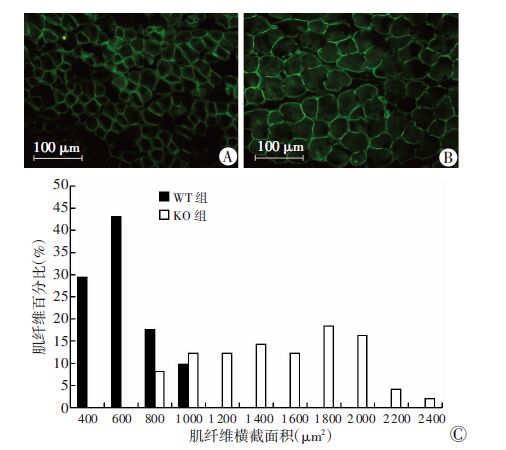
荧光显微镜下(40×)观察股四头肌石蜡切片(图 5A、B),经Laminin染色后,形态上MSTN基因敲除小鼠(KO)肌纤维与野生型小鼠(WT)相比,肌纤维显著增粗;利用Image J 1.41软件计算两组小鼠肌纤维横截面积,从肌纤维分布(图 5C)发现,与WT组相比,KO组肌纤维分布明显向右偏移,表示横截面积大的肌纤维数量比例增多;KO组肌纤维横截面积均值较WT组增大了149.18%,差异具有统计学意义[(1 535.46± 411.67) μm2 vs (616.22±179.09)μm2,P<0.01]。表明敲除MSTN会使小鼠骨骼肌纤维显著增粗(肌肥大)。
|
| A:WT组;B: KO组;C:肌纤维分布 图 5 免疫荧光观察敲除MSTN基因对小鼠肌纤维大小的影响 |
2.5 敲除MSTN基因对小鼠肌肉相关基因表达的影响
qPCR检测 Atrogin-1 和 MuRF-1 表达,发现MSTN基因敲除组(KO)的 Atrogin-1 和 MuRF-1 表达 显著低于对照组,差异具有统计学意义(WT)[(1.00± 0.05) vs (0.30±0.04)、(1.01±0.15) vs (0.31±0.07),P<0.01]。 Atrogin-1 和 MuRF-1 均属于泛素蛋白连接酶,它们与骨骼肌蛋白质的分解代谢关系最为密切。因此,敲除MSTN后小鼠的体质量 增加,原因可能与 Atrogin-1 和 MuRF-1 的mRNA水平显著下调从而使骨骼肌的分解代谢减少有关。
3 讨论基因编辑技术是对基因进行精确定点改造的一项新手段,也是研究基因生物学功能的一个重要方法。该技术具有构建时间短、花费成本低、应用范围广等优点。目前常用的基因编辑技术有Cre-loxP重组酶系统、锌指蛋白核酸酶(zinc finger nuclease ,ZFN)、类转录激活样因子效应物核酸酶(transcription activator 1ike effector nuclease,TALEN)和成簇规律间隔短回文重复序列(clustered regularly interspaced short palindromic repeats/CRISPR-Associated Proteins,CRISPR)技术等,其中对于转基因动物的构建应用最广泛的是Cre-loxP重组酶系统[10]。Cre-LoxP重组酶系统包括Cre重组酶和含LoxP位点的基因两个组成部分,其原理是Cre重组酶首先识别同向排列的34 bp大小LoxP序列,然后将两个位点之间的序列删除,造成移码突变,使目的基因不表达或无功能表达从而达到敲除基因的目的[11]。本研究将引进的MSTN-loxP +/-小鼠采用自交和回交的方法得到基因型为MSTN-loxP+/+MCK-Cre+/-的小鼠,成功地构建了MSTN基因敲除的小鼠模型,为下一步进行该基因功能研究创造了一个良好平台。
MSTN作为TGF-β超家族成员之一,对于骨骼肌的发育至关重要。相关研究表明,MSTN基因的缺失会使其对成肌细胞增殖和分化的抑制作用消失,在动物上表现出明显的双肌表型[12-13]。与普通动物相比,含有双肌表型的动物不仅生长速度快、瘦肉含量高、脂肪低等特点,还具有采食量低、饲料利用率高等特点[14-16]。因此,在畜牧业方面,敲减或敲除MSTN基因已经成为培育高产肉量家畜品种的一种有效技术手段。Guo T等[17]研究表明,敲除MSTN使小鼠肌肉含量增加,脂肪含量减少,其原因可能与Mstn-/-小鼠的葡萄糖利用率和胰岛素敏感性增加有关。与上述研究结果一致,本研究将小鼠MSTN基因敲除后,其体质量显著增加,同时免疫荧光结果显示敲除MSTN会使小鼠骨骼肌纤维显著增大。此外,关于肌肉表型与小鼠性别的关系,我们研究发现,与野生型小鼠相比,MSTN基因敲除后雌雄小鼠体质量及骨骼肌质量均有增加,且有统计学差异,而敲除组中雌雄两种性别小鼠相比,体质量却无统计学差异(具体数据未列出),说明敲除MSTN后,雌雄两种性别小鼠均存在肌肉表型。因此,文中后续研究并未区分雌雄小鼠性别。
MSTN由376个氨基酸组成,包含3个外显子和2个内含子,结构具有典型的TGF-β家族特征。活化的MSTN可与细胞膜上的activinⅡA 型受体(ActR-ⅡA)或ActR-ⅡB结合,通过信号通路进入细胞核,从而对靶基因进行调控。MSTN参与的信号通路主要有三条:第一条是Smad途径。MSTN与ActR-ⅡB结合后,导致Smad磷酸化使Smad7与其相结合并转入细胞核,从而抑制生肌调节因子MRF家族成员如MyoD、Myf5等的表达,进而抑制肌细胞的分化。第二条是PI3K/Akt/Foxo途径。MSTN可通过调控IGF-1抑制PI3K的活性,从而使AKT磷酸化减少,叉头型转录因子(Foxo)表达上调,进而诱导E3泛素连接酶 MuRF-1 和 Atrogin-1 的表达增加,使肌球蛋白合成减少。第三条是MAPK途径。MSTN可分别通过JNK/P38MAPK/ERK1/2途径进入细胞核,抑制肌肉增生相关基因的表达。另外,MSTN还能调控肌腱组织的结构与功能。MSTN缺失型动物的肌腱较野生型的小,且I型胶原表达量以及成纤维细胞的密度均低,容易造成动物肌肉拉伤[18]。
为了进一步研究MSTN敲除导致小鼠骨骼肌纤维及体质量变化的具体机制,本研究采用qPCR法检测了肌肉中相关基因的表达,发现MSTN敲除组小鼠中泛素连接酶 Atrogin-1 和 MuRF-1 mRNA的表达水平较野生型小鼠显著降低,分别降低了70%和69%。骨骼肌含量的维持主要通过两种方式:蛋白质合成和降解。体内蛋白质降解主要有3种途径:溶酶体-蛋白酶体途 径、泛素-蛋白酶体途径和钙依赖-蛋白酶体途径。参与泛素-蛋白酶体途径的泛素连接酶 MuRF-1 和 Atrogin-1 ,受Akt/Foxo信号通路的调控。而MSTN激活后可抑制P13K活性以及Akt的磷酸化,从而激活Foxo[19-20]。本研究将小鼠MSTN敲除后,由于可能解除了MSTN对PI3K活性的抑制,促进了Akt的磷酸化,从而抑制了Foxo的活性,导致泛素连接酶 MuRF-1 和 Atrogin-1 表达下调,最终导致蛋白降解减少。因此,敲除小鼠MSTN会导致小鼠骨骼肌纤维增粗,体质量增加。此外,Zhu X等[21]研究发现,虽然敲除MSTN基因导致了大鼠骨骼肌纤维数量增多,肌纤维增粗,但其肌肉力量反而减弱。其可能的机制主要有两个方面:一方面,MSTN失活后会解除其对肌肉增生相关基因表达的抑制,从而使动物骨骼肌增生或肌细胞肥大;另一方面,MSTN基因缺陷却会造成肌肉中线粒体DNA减少,使肌肉有氧呼吸减弱,进而导致肌力下降。Amthor等[22]研究发现MSTN突变型小鼠虽然肌纤维数量大量增加,但肌肉的最大强直性张力并没有增加,且肌肉收缩与舒张速率增加,肌肉力量减弱。
下一步我们还将继续检测 Pax7、Myf5、MyoD 等生肌相关调节因子以及Smad和PI3K/AKT信号通路的表达情况,验证MSTN基因敲除后小鼠肌力及肌张力等肌肉功能的变化,以便更深入了解敲除MSTN后导致小鼠骨骼肌生长的相关机制。
综上所述,本研究利用Cre-loxP系统成功构建了MSTN基因敲除的小鼠模型,并发现敲除MSTN使哺乳期幼鼠骨骼肌纤维增粗,体质量增加,其机制可能与泛素连接酶 MuRF-1 和 Atrogin-1 的表达下调有关。该研究结果将为下一步进行MSTN功能的研究提供一个良好的平台,也为后续进一步研究MSTN调控骨骼肌生长的具体机制打下了基础。
| [1] | Gu H, Cao Y, Qiu B, et al. Establishment and phenotypic analysis of an Mstn knockout rat[J]. Biochem Biophys Res Commun,2016, 477 (1) : 115 –122. DOI:10.1016/j.bbrc.2016.06.030. |
| [2] | Mcpherron A C, Lawler A M, Lee S J. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member[J]. Nature,1997, 387 (6628) : 83 –90. DOI:10.1038/387083a0 |
| [3] | Welle S, Bhatt K, Pinkert C A, et al. Muscle growth after postdevelopmental myostatin gene knockout[J]. Am J Physiol Endocrinol Metab,2007, 292 (4) : E985 –E991. DOI:10.1152/ajpendo.00531.2006 |
| [4] | Jones J C, Kroscher K A, Dilger A C. Reductions in expression of growth regulating genes in skeletal muscle with age in wild type and myostatin null mice[J]. BMC Physiol,2014, 14 : 3 . DOI:10.1186/1472-6793-14-3 |
| [5] | Rao S, Fujimura T, Matsunari H, et al. Efficient modification of the myostatin gene in porcine somatic cells and generation of knockout piglets[J]. Mol Reprod Dev,2016, 83 (1) : 61 –70. DOI:10.1002/mrd.22591 |
| [6] | Argiles J M, Orpi M, Busquets S, et al. Myostatin: more than just a regulator of muscle mass[J]. Drug Discov Today,2012, 17 (13-14) : 702 –709. DOI:10.1016/j.drudis.2012.02.001 |
| [7] | Amthor H, Hoogaars W M. Interference with myostatin/ActRIIB signaling as a therapeutic strategy for Duchenne muscular dystrophy[J]. Curr Gene Ther,2012, 12 (3) : 245 –259. DOI:10.2174/156652312800840577 |
| [8] | Bish L T, George I, Maybaum S, et al. Myostatin is elevated in congenital heart disease and after mechanical unloading[J]. PLoS One,2011, 6 (9) : e23818 . DOI:10.1371/journal.pone.0023818 |
| [9] | Zhou X, Wang J L, Lu J, et al. Reversal of cancer cachexia and muscle wasting by ActRIIB antagonism leads to prolonged survival[J]. Cell,2010, 142 (4) : 531 –543. DOI:10.1016/j.cell.2010.07.011 |
| [10] | Bi Y, Hua Z, Liu X, et al. Isozygous and selectable marker-free MSTN knockout cloned pigs generated by the combined use of CRISPR/Cas9 and Cre/LoxP[J]. Sci Rep,2016, 6 : 31729 . DOI:10.1038/srep31729 |
| [11] | 李嘉蕙, 葛佳, 汪丽君, 等. Cre/Loxp系统在转基因拟南芥杂交后代中的删除效率分析[J]. 西南师范大学学报(自然科学版),2015 (07) : 61 –68. Li Jiahui, Ge Jia, Wang Lijun, et al. Recombination Efficiency Analysis of Cre/Loxp System in Hybrid Progenies of Arabidopsis thaliana[J]. Journal of Southwest China Normal University(Natural Science Edition),2015 (07) : 61 –68. DOI:10.13718/j.cnki.xsxb.2015.07.012 |
| [12] | Hu S, Ni W, Sai W, et al. Knockdown of myostatin expression by RNAi enhances muscle growth in transgenic sheep[J]. PLoS One,2013, 8 (3) : e58521 . DOI:10.1371/journal.pone.0058521 |
| [13] | 高丽, 谌颜, 扈廷茂, 等. 肌肉生长抑制素基因在哺乳动物中的最新研究进展[J]. 生物技术进展,2014 (06) : 381 –388. Gao Li, Chen Yan, Hu Tingmao, et al. The Latest Research Progress of Myostatin in Mammals[J]. Progress in Biotechnology,2014 (06) : 381 –388. DOI:10.3969/j.issn.2095-2341.2014.06.01 |
| [14] | Qian L, Tang M, Yang J, et al. Targeted mutations in myostatin by zinc-finger nucleases result in double-muscled phenotype in Meishan pigs[J]. Sci Rep,2015, 5 : 14435 . DOI:10.1038/srep14435 |
| [15] | Luo J, Song Z, Yu S, et al. Efficient generation of myostatin (MSTN) biallelic mutations in cattle using zinc finger nucleases[J]. PLoS One,2014, 9 (4) : e95225 . DOI:10.1371/journal.pone.0095225 |
| [16] | Mosher D S, Quignon P, Bustamante C D, et al. A mutation in the myostatin gene increases muscle mass and enhances racing performance in heterozygote dogs[J]. PLoS Genet,2007, 3 (5) : e79 . DOI:10.1371/journal.pgen.0030079 |
| [17] | Guo T, Jou W, Chanturiya T, et al. Myostatin inhibition in muscle, but not adipose tissue, decreases fat mass and improves insulin sensitivity[J]. PLoS One,2009, 4 (3) : e4937 . DOI:10.1371/journal.pone.0004937 |
| [18] | Mendias C L, Bakhurin K I, Faulkner J A. Tendons of myostatin-deficient mice are small, brittle, and hypocellular[J]. Proc Natl Acad Sci U S A,2008, 105 (1) : 388 –393. DOI:10.1073/pnas.0707069105 |
| [19] | Steculorum S M, Ruud J, Karakasilioti I, et al. AgRP Neurons Control Systemic Insulin Sensitivity via Myostatin Expression in Brown Adipose Tissue[J]. Cell,2016, 165 (1) : 125 –138. DOI:10.1016/j.cell.2016.02.044 |
| [20] | Mcfarlane C, Plummer E, Thomas M, et al. Myostatin induces cachexia by activating the ubiquitin proteolytic system through an NF-kappaB-independent, FoxO1-dependent mechanism[J]. J Cell Physiol,2006, 209 (2) : 501 –514. DOI:10.1002/jcp.20757 |
| [21] | Zhu X, Hadhazy M, Wehling M, et al. Dominant negative myostatin produces hypertrophy without hyperplasia in muscle[J]. FEBS Lett,2000, 474 (1) : 71 –75. DOI:10.1016/S0014-5793(00)01570-2 |
| [22] | Amthor H, Macharia R, Navarrete R, et al. Lack of myostatin results in excessive muscle growth but impaired force generation[J]. Proc Natl Acad Sci U S A,2007, 104 (6) : 1835 –1840. DOI:10.1073/pnas.0604893104 |



