肺纤维化又称间质性肺炎,病理特点是肺实质细胞减少,结缔组织进行性增多,肺结构功能丧失,最终导致呼吸衰竭。近年来肺纤维化的发病率显著上升,引起广泛关注。其发病原因复杂,机制不明,尚缺乏有效的治疗药物。临床上主要以应用肾上腺皮质激素及免疫抑制药为主,而这种疗法常伴随严重的副反应并容易引起继发感染,所以寻找一种安全有效改善肺纤维化的药物亟须解决。
虾青素 (astaxanthin, AX) 亦称“虾黄素”,是一种抗氧化能力极强的脂溶性类胡萝卜素,全称3, 3′-二羟基-β, β′-胡萝卜素-4, 4′-二酮基,分子式为C40H52O4。AX广泛存在于自然界中,如虾、蟹、海藻及鸟类羽毛等。因其具有抗氧化、抗炎、抗肿瘤及增强免疫力等多种药理作用,而被广泛应用于各种疾病的研究[1-2]。近年研究表明,AX可抑制肺纤维化,但其作用机制尚未完全清楚[3-6]。本研究旨在观察AX对大鼠肺纤维化的治疗效果,并初步探讨其作用机制。
1 材料与方法 1.1 材料 1.1.1 试药与仪器羟脯氨酸检测试剂盒 (南京建成,A030-2)、大鼠TGF-β1检测试剂盒 (博士德,EK0514)、α-SMA (Abcam,ab5694)、p-Smad2(Abcam,188334)、p-Smad3(CST,9520)、Smad2/3(SANTA,sc-398844)、p-ERK1/2(CST,4370)、ERK1/2(CST,4695)、虾青素 (Astaxanthin,阿拉丁,纯度>98%,CAS:472-61-7)、盐酸博来霉素 (日本化药株式会社,规格15 mg/瓶,批号640412)、植物油。全波长酶标仪 (美国Thermo公司)、倒置显微镜 (日本Nikon公司)、凝胶成像系统 (美国BIO-RAD公司)。
1.1.2 实验动物由第三军医大学实验动物中心提供无病原体 (SPF) 级SD雄性大鼠[生产许可证号:SGXK (渝)2012-0003],8~10周龄,体质量 (200±20) g,分笼饲养,自由饮水及进食。
1.2 方法 1.2.1 动物分组及肺纤维化模型的构建32只SD雄性大鼠采用随机数字表法分为4组:Sham组 (假手术组)、BLM组、AX组、AX+BLM组,每组8只。动物造模前一晚禁食,手术前2 h禁水。大鼠用1%戊巴比妥钠 (45 mg/kg) 腹腔注射麻醉,仰卧固定于手术台上,剪去颈部毛发,碘伏及乙醇消毒后逐层分离并暴露气管,1 mL注射器经气管软骨环间隙朝向心端刺入气管,注入一定体积的博莱霉素生理盐水溶液 (5 mg/kg) (BLM组和AX+BLM组) 或生理盐水 (Sham组),并继续注入0.1 mL的空气,然后立即将动物直立并旋转3 min,使药液在肺内均匀分布。造模第2天AX组及AX+BLM组灌服AX (2 mg/kg) 油溶液,BLM组给予等体积植物油,口服体积为1 mL/100 g大鼠体质量,Sham组给予正常饲养。
1.2.2 肺组织病理检测各组大鼠分别于给药14 d后取全肺,称重,按公式“肺系数=肺湿质量/体质量”计算肺系数。左下肺以4%多聚甲醛固定,常规病理学方法经脱水、包埋、切片,进行HE染色及Masson染色。肺炎症程度评分参照Szapiel等[7]方法,肺纤维化程度评分参照Ashcroft等[8]的方法进行。
1.2.3 肺组织羟脯胺酸检测采用碱水解法测肺组织样本中羟脯氨酸 (HYP) 含量,严格按照试剂盒说明书 (南京建成,A030-2) 操作:精确称取右肺组织80~100 mg,加入裂解液,沸水浴水解20 min,调pH至6.0~6.8,加活性炭离心,取1 mL上清液依次加反应试剂,水浴反应15 min,离心后取上清于550 nm处测定光密度值。
1.2.4 免疫组化检测切片常规脱蜡,抗原修复,滴加单克隆α-SMA抗体 (工作浓度1:80),于4 ℃过夜孵育,DAB显色,苏木精复染,于显微镜下观察α-SMA表达情况。
1.2.5 酶联免疫夹心 (ELISA) 检测加样品和标准品,37 ℃反应90 min;加生物素标记抗体,37 ℃反应60 min;洗涤缓冲液洗涤3次;加亲和素-过氧化物酶复合物,37 ℃反应30 min;洗涤缓冲液洗涤5次;TMB显色液37 ℃反应30 min;加入TMB终止液,酶标仪测光密度值。
1.2.6 Western blot检测采用液氮研磨法提取肺组织蛋白,BCA法蛋白定量,沸水浴变性5 min,每份样品取30 μg上样,SDS-PAGE凝胶电泳分离蛋白后转移至PVDF膜上,5%BSA封闭2 h,加p-Smad2、p-Smad3、Smad2/3、p-ERK1/2、ERK1/2等单克隆一抗4 ℃孵育过夜,PBST洗3次,辣根过氧化物酶标记的二抗 (1:5 000) 孵育2 h,PBST洗3次,ECL化学发光法检测目的条带,GAPDH为内参对照。
1.3 统计学分析采用SPSS 19.0进行统计分析,计量资料以x±s表示,多组均数间比较采用单因素方差分析,计数资料采用非参数秩和检验,以P<0.05为差异具有统计学意义。
2 结果 2.1 肺组织病理观察肺部拍照结果显示:Sham组与AX组双肺呈粉红色,肺泡壁光滑有弹性;BLM组双肺呈暗红色,局部呈灰白色,有点状淤血斑点均匀分布;AX+BLM组情况较模型组有好转,双肺较红润,只见少量斑点出现 (图 1)。

|
| 图 1 各组大鼠肺部大体、HE染色及Masson染色观察 |
肺系数结果显示:BLM组肺系数较Sham组及AX组明显升高,差异有统计学意义 (P<0.01);AX+BLM组肺系数较模型组有所降低,但无统计学差异 (表 1)。
| 组别 | 肺系数 (mg/g) | 炎症程度 | 纤维化程度 |
| Sham组 | 0.60±0.15 | 1.14±0.11 | 0.14±0.03 |
| AX组 | 0.47±0.03 | 1.10±0.10 | 0.10±0.01 |
| BLM组 | 1.19±0.37a | 3.60±0.42a | 7.14±0.24a |
| AX+BLM组 | 0.96±0.18 | 2.26±0.15b | 5.54±0.44b |
| a:P<0.01, 与Sham组比较; b:P<0.01, 与BLM组比较 | |||
HE结果显示:Sham组及AX组肺泡结构完整,肺泡壁薄,无充血及炎症细胞浸润;BLM组肺泡大量塌陷,肺泡间隔增厚,甚至融合为大肺泡,肺泡内有充血及炎症细胞浸润,与Sham组及AX组比较,其炎症程度显著升高 (P<0.01);AX+BLM组肺泡结构尚能保持,但局部可见肺泡间隔增厚,少量肺泡有融合,与模型组比较,其炎症程度明显降低 (P<0.01,图 1,表 1)。
Masson结果显示:Sham组及AX组肺泡结构完整,肺泡间隙未见明显的蓝色胶原沉积;与Sham组及AX组相比,BLM组双肺大部分肺泡结构丧失,肺部明显实变,间质可见大量蓝色胶原沉积,其纤维化程度显著升高 (P<0.01);AX+BLM组肺泡间隔可见少量胶原沉积,其纤维化程度显著降低 (P<0.01,图 1,表 1)。
2.2 AX降低肺组织中HYP含量羟脯氨酸的测定结果显示:与Sham组与AX组比较,BLM组HYP含量明显上升,差异有统计学意义 (P<0.01);与BLM组比较,AX+BLM组HYP含量明显降低,差异有统计学意义 (P<0.01,图 2)。
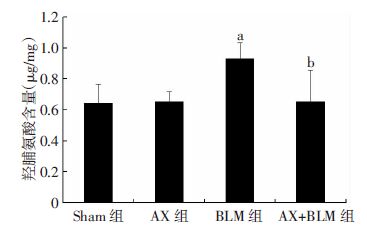
|
| a:P<0.01, 与Sham组比较; b:P<0.01, 与BLM组比较 图 2 各组大鼠肺组织HYP含量 (n=8,x±s) |
2.3 AX降低肺组织中α-SMA的表达
BLM组肺组织α-SMA表达 (棕黄色区域) 较Sham组及AX组明显增高,尤其在肺泡塌陷区域及肺间隔呈蜂窝状分布;AX+BLM组α-SMA表达较BLM组低,仅在肺泡隔增厚处有少量表达 (图 3)。
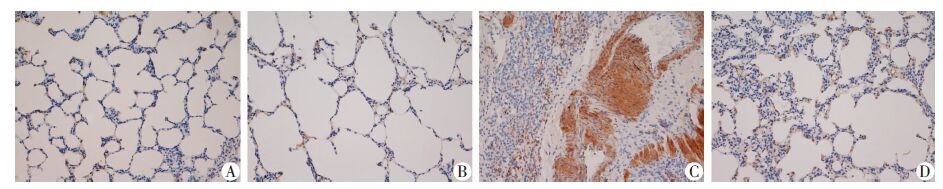
|
| A:Sham组; B:AX组; C:BLM组; D:AX+BLM组 图 3 各组大鼠肺组织α-SMA蛋白表达 (×200) |
2.4 AX降低血清中TGF-β1水平
与Sham组和AX组比较,BLM组血清TGF-β1水平明显升高 (P<0.01),而AX+BLM组TGF-β1水平较模型组明显降低 (P<0.05,图 4)。

|
| a:P<0.01, 与Sham组比较; b:P<0.05, 与BLM组比较 图 4 各组大鼠血清TGF-β1表达水平 (n=8,x±s) |
2.5 AX降低肺组织Smad2/3、ERK1/2蛋白磷酸化水平
实验结果显示:BLM组磷酸化Smad2(p-Smad2)、磷酸化ERK1/2(p-ERK1/2) 表达明显升高,而磷酸化Smad3(p-Smad3) 则变化不明显;与BLM组比较,AX+BLM组p-Smad2、p-Smad3、p-ERK1/2表达均降低 (图 5)。
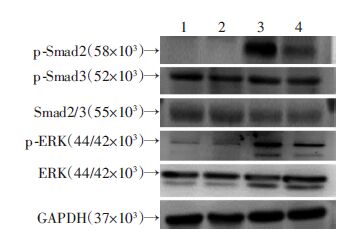
|
| 1:Sham组; 2:AX组; 3:BLM组; 4:AX+BLM组 图 5 Western blot检测大鼠肺组织Smad2/3与ERK1/2蛋白 |
3 讨论
肺纤维化的病理特点主要以肺成纤维细胞聚集及细胞外基质 (extracellular matrix, ECM) 进行性过度沉积取代正常肺组织结构主。博莱霉素致大鼠肺纤维化模型病理学改变与人类肺纤维化极为相似。有文献报道[8-9],大鼠气管注射博来霉素造模后第14天即可形成肺纤维化。本实验造模14 d后肺组织病理结果观察到,BLM组肺系数升高 (P<0.01),肺部病变明显;HE结果显示肺泡结构塌陷,有充血及炎症,肺泡间隙有成纤维样细胞增生;肺组织Masson染色结果亦发现胶原蛋白沉积明显增多。同时羟脯氨酸 (HYP) 检测结果也显示BLM组HYP明显升高 (P<0.01),而HYP是胶原纤维代谢的重要指标,可间接反映组织胶原含量[10]。这些结果都表明BLM造模成功,而AX可明显减轻BLM引起的炎症反应,抑制胶原蛋白沉积及成纤维样细胞增生,同时降低肺组织中HYP含量 (P<0.01),表明AX能明显改善BLM所致肺纤维化。
肺纤维化病灶主要由肺成纤维细胞及肺肌成纤维细胞组成,而肺肌成纤维细胞是肺纤维化的主要效应细胞。α-平滑肌肌动蛋白 (α-SMA) 是肺肌成纤维细胞的标志性蛋白,可通过检测α-SMA的表达间接衡量肺肌成纤维细胞 (MFB) 的生成情况[11]。本实验观察到,与Sham组及AX组比较,BLM组肺组织α-SMA表达明显升高,而AX+BLM组α-SMA表达较BLM组明显降低。此结果也表明AX可降低肺纤维化程度。
以往对于AX抑制肺纤维化的作用主要是以其抗氧化作用为线索进行研究,并发现AX可促进肌成纤维细胞的凋亡来抑制肺纤维化的形成[2-5]。但是肺纤维化的发生机制十分复杂,是多种因素共同作用的结果,其中最关键的因素就是转化生长因子β1(TGF-β1)。它可促进成肺成纤维细胞过度增殖、分化并转化为肌成纤维细胞,促ECM分泌,最终导致肺间质胶原的过度沉积,肺结构实质化[12]。但是AX对TGF-β1的作用及其相关信号通路的研究还未见报道。研究报道TGF-β1诱导肺纤维化的发生与其下游的Smads蛋白家族信号通路相关。活性TGF-β1通过与其受体TβRⅡ、TβRI结合形成三聚体复合物,使磷酸化Smad2/3增多,磷酸化的Smad2/3与TβRI受体分离,即与Smad4结合形成复合体,携带信号从细胞质进入胞核激活转录,促进肺纤维化的发生[13];同时,MAPKs丝裂原活化蛋白激酶家族的ERK1/2通路也是促纤维化发生的重要通路,被认为与Smads通路存在协同作用[14]。TGF-β1/Smad信号通路的激活过程受ERK通路的调控,Smad2/3含有ERK磷酸化的位点,可被ERK磷酸化,促进磷酸化的Smad2/3与Smad4的结合并转录。同时,ERK通路受Smads通路调控,促使ERK通路相关细胞因子或激酶的转录,从而激活ERK信号传导通路,使磷酸化的ERK1/2参与细胞的增殖、分化和转化,从而促进肺纤维化发生。本课题组通过检测肺纤维化大鼠血清TGF-β1水平,发现BLM诱导的肺纤维化TGF-β1水平明显升高 (P<0.01),表明BLM可能是通过引起TGF-β1水平升高,从而诱导肺纤维化的发生,而AX可明显降低TGF-β1水平 (P<0.05)。同时本实验也检测了Smad2/3蛋白与ERK1/2蛋白,发现BLM组Smad2/3蛋白与ERK1/2蛋白的磷酸化水平明显升高,而AX+BLM组Smad2/3蛋白与ERK1/2蛋白磷酸化水平较BLM组明显降低。这些结果提示AX抑制肺纤维化的作用机制可能与其降低TGF-β1水平,从而下调Smads/ERK通路有关。
综上所述,AX能明显抑制肺纤维化,其作用机制可能与降低TGF-β1水平,从而下调Smads/ERK通路有关。本实验研究了AX对TGF-β1介导的Smads/ERK通路的影响,为肺纤维化的防治提供了理论依据。但本实验只进行了动物在体研究,后期还需进行细胞水平的研究予以论证。
| [1] | Yuan J P, Peng J, Yin K, et al. Potential health-promoting effects of astaxanthin: A high-value carotenoid mostly from microalgae[J]. Molecular Nutrition & Food Research,2010, 55 (1) : 150 –165. DOI:10.1002/mnfr.201000414 |
| [2] | Wang M, Zhang J, Song X, et al. Astaxanthin ameliorates lung fibrosis in vivo and in vitro by preventing transdifferentiation, inhibiting proliferation, and promoting apoptosis of activated cells[J]. Food Chem Toxicol,2013, 56 : 450 –458. DOI:10.1016/j.fct.2013.03.004 |
| [3] | Song X, Wang B, Lin S, et al. Astaxanthin inhibits apoptosis in alveolar epithelial cells type II in vivo and in vitro through the ROS-dependent mitochondrial signalling pathway[J]. J Cell Mol Med,2014, 18 (11) : 2198 –2212. DOI:10.1111/jcmm.12347 |
| [4] | Zhang J, Xu P, Wang Y, et al. Astaxanthin prevents pulmonary fibrosis by promoting myofibroblast apoptosis dependent on Drp1-mediated mitochondrial fission[J]. Journal of Cellular and Molecular Medicine,2015 . DOI:10.1111/jcmm.12609 |
| [5] | Yang Y, Kim B, Park Y K, et al. Astaxanthin prevents TGFβ1-induced pro-fibrogenic gene expression by inhibiting Smad3 activation in hepatic stellate cells[J]. Biochim Biophys Acta,2015, 1850 (1) : 178 –185. DOI:10.1016/j.bbagen.2014.10.014 |
| [6] | Szapiel S V, Elson N A, Fulmer J D, et al. Bleomycin-induced interstitial pulmonary disease in the nude, athymic mouse[J]. Am Rev Respir Dis,1979, 120 (4) : 893 –899. DOI:10.1164/arrd.1979.120.4.893 |
| [7] | Ashcroft T, Simpson J M, Timbrell V. Simple method of estimating severity of pulmonary fibrosis on a numerical scale[J]. J Clin Pathol,1988, 41 (4) : 467 –470. DOI:10.1136/jcp.41.4.467 |
| [8] | 王响英, 吴淑燕, 李苏安, 等. 实验性大鼠肺纤维化病理形态及超微结构观察[J]. 苏州大学学报 (医学版),2005, 25 (3) : 379 –382. Wang Xiangying, Wu Shuyan, Li Suan, et al. Study on Pathomorphology and Ultrastructure of Rat Pulmonary Fibrosis Model[J]. Suzhou University Journal of Medical Science,2005, 25 (3) : 379 –382. DOI:10.3969/j.issn.1673-0399.2005.03.010 |
| [9] | 柴文戍, 李永春, 刘玉玲, 等. 博来霉素致肺纤维化大鼠形态学变化的实验研究[J]. 中国实验动物学报,2003, 11 (2) : 77 –80. Chai Wenshu, Li Yongchun, Liu Yuling, et al. Morphologic Study of Bleomycin-induced Pulmonary Fibrosis in Rats[J]. Acta Lab Anim Sci Sin,2003, 11 (2) : 77 –80. DOI:10.3969/j.issn.1005-4847.2003.02.004 |
| [10] | 马荣林, 王尉平, 蒋小岗, 等. 黄芩总黄酮对博莱霉素致大鼠肺纤维化的干预作用[J]. 中国药理学通报,2011, 27 (4) : 537 –542. Ma Ronglin, Wang Weiping, Jiang Xiaogang, et al. Effects of total flavonoids of scutellaria baicalensis georgi (TFSB) on bleomycin-induced pulmonary fibrosis in rats[J]. Chinese Pharmacological Bulletin,2011, 27 (4) : 537 –542. DOI:10.3969/j.issn.1001-1978.2011.04.023 |
| [11] | Jiang D, Jiang Z, Han F, et al. HGF suppresses the production of collagen type III and alpha-SMA induced by TGF-beta1 in healing fibroblasts[J]. Eur J Appl Physiol,2008, 103 (5) : 489 –493. DOI:10.1007/s00421-008-0733-7 |
| [12] | 肖颖, 杨涛涛, 周卫民, 等. TGF-β/Smad与Wnt/β-catenin在博莱霉素致大鼠肺纤维化中的表达及相互作用[J]. 中国比较医学杂志,2014, 24 (2) : 63 –69. Xiao Ying, Yang Taotao, Zhou Weimin, et al. Expression and interaction of TGF-β/Smad and Wnt/β-catenin signaling pathway-related genes in bleomycin-induced pulmonary fibrosis in rats[J]. Chinese Journal of Comparative Medicine,2014, 24 (2) : 63 –69. |
| [13] | Massagu J, Seoane J, Wotton D. Smad transcription factors[J]. Genes Dev,2005, 19 (23) : 2783 –2810. DOI:10.1101/gad.1350705 |
| [14] | 万磊.基于TGF-β1/Smads和ERK通路cross-talk研究新风胶囊改善AA大鼠肺功能的机理.湖北中医药大学, 2013. Wan Lei. Mechanism Research of Xinfeng Capsule on Pulmonary Function Based on the Cross-talk of TGF-β1/Smads and ERK Pathway in a Rat Model of Adjuvant Arthritis. Wuhan, Hubei Province, China: Hubei University of Chinese Medicine, 2013. |



