血管平滑肌细胞(vascular smooth muscle cells,VSMCs)大量增殖和迁移是动脉粥样硬化和血管支架植入术后再狭窄的重要细胞学基础[1]。研究发现,VSMCs的表型转化是比增殖和迁移发生更早的关键性起始步骤[2]。VSMCs分为收缩型和合成型两种表型。生理条件下动脉内的VSMCs主要为收缩型,没有增殖和迁移能力。而病理条件下(如高血压、机械压力、炎症、异物等),收缩型可以向合成型转化(表型转化),由血管中膜迁移到内膜并大量增殖,并分泌大量细胞外基质,导致管腔狭窄。研究表明,血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)参与了血管重构的病理生理过程[3-4]。AngⅡ可诱导VSMCs的表型转化[5],促进VSMCs的增殖,诱导了血管损伤中的炎症反应[6],并且可促进VSMCs分泌细胞外基质[7]。
过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors, PPAR)-γ为核受体转录因子,是PPARs家族的一个成员,主要分布于脂肪细胞。此外,PPAR-γ在血管内皮细胞、血管平滑肌细胞(VSMCs)也有丰富表达。动物实验及早期临床研究表明,PPAR-γ可抑制高血压、血管损伤后再狭窄、动脉粥样硬化过程的血管重构[8-12],罗格列酮(rosiglitazone,RSG)作为PPAR-γ特异性激动剂,已被证实可以抑制AngⅡ诱导VSMCs的增殖、分泌细胞外基质及血管炎症反应[13-14]。本研究旨在探讨罗格列酮激活PPAR-γ后是否可以抑制AngⅡ诱导VSMCs的表型转化及可能的机制。
1 材料与方法 1.1 主要药物和试剂DMEM培养基、胰蛋白酶购自Invitrogen公司,青链霉素混合液、胎牛血清购自Gibco公司,鬼笔环肽-iFluorTM 488偶联物购自江苏凯基公司,反转录试剂盒、SYBR® Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)购自TaKaRa公司,TRIzol Reagent购自Ambion公司,AngⅡ、罗格列酮及GW9662购自Sigma公司,DAPI染色液、RIPA裂解液购自上海碧云天公司,RT-qPCR引物由上海生工生物公司合成。PPAR-γ、PKGⅠα、SM22α抗体均为兔抗小鼠来源,购自美国Abcam公司,二抗为羊抗兔IgG,购自Sigma公司。
1.2 实验动物雄性野生型C57BL/6J小鼠(wild type,WT)购自第三军医大学大坪医院野战外科研究所实验动物中心。
1.3 原代细胞分离和培养采用组织贴块法培养小鼠原代VSMCs,小鼠处死后取胸主动脉,剥离动脉外膜后将血管剪碎为2 mm左右碎片,均匀贴在培养瓶底,用含10%FBS及1%青链霉素双抗混合液的DMEM培养基培养于含5%CO2的37 ℃恒温孵箱内。待VSMCs爬出组织块后进行传代培养,选取3~7代状态良好的细胞用于实验。
1.4 Transwell小室检测细胞迁移体外培养的VSMCs分为3组:对照组、AngⅡ处理组、RSG+AngⅡ处理组。用不含血清的DMEM培养基制成细胞悬液,调整密度为5×104/mL。取200 μL细胞悬液加入上室,下室中加入含10% FBS的培养液500 μL,上下室加入Ang Ⅱ(100 nmol/L)刺激或用罗格列酮(20 μmol/L)预处理2 h后加入AngⅡ,继续培养16 h后弃去上室培养基,PBS缓冲液轻轻冲洗小室,并用湿棉签擦去微孔膜上层细胞。用4%多聚甲醛在室温下固定30 min,苏木精染液染色5 min,伊红染色1 min,蒸馏水冲洗,晾干后在显微镜下观察,每个小室随机选取5个高倍视野(×400)计细胞数。
1.5 激光共聚焦显微镜分析细胞骨架按3×104/mL细胞量接种至35 mm玻璃底培养皿(NEST,产品编号:801001),细胞贴壁后换不含血清DMEM培养基,加入Ang Ⅱ(100 nmol/L)刺激或用罗格列酮(20 μmol/L)预处理1 h后加入AngⅡ继续培养3 h,弃去培养基,PBS冲洗后用4%多聚甲醛在室温下固定10 min,PBS缓冲液冲洗后加0.2% Triton X-100透膜5 min,在4 ℃环境中避光染色过夜,PBS冲洗后加DAPI染色液在室温下避光染色10 min,弃去DAPI后PBS冲洗,在激光共聚焦显微镜下观察细胞微丝骨架结构。
1.6 RT-qPCR检测PPAR-γ、PKG Ⅰα和SM22α mRNA水平按2×105/孔细胞量接种至6孔板,细胞贴壁后换不含血清DMEM培养基培养24 h进行血清饥饿,加入Ang Ⅱ(100 nmol/L)或罗格列酮(20 μmol/L)刺激或用罗格列酮(20 μmol/L)预处理4 h后加入AngⅡ继续培养24 h,弃去培养基,应用TRIzol提取细胞总RNA,每样品取不超过1 μg总RNA,使用TaKaRa反转录试剂盒(编号:RR047A)反转录为cDNA。使用Mx3000P RT-qPCR仪进行实时荧光定量PCR反应,反应体系配制如下:SYBR® Premix Ex TaqⅡ(Tli RNaseH Plus,2×)12.5 μL、上游引物(10 μmol/L)1 μL、下游引物(10 μmol/L)1 μL、RT反应液(cDNA溶液)2 μL、dH2O (灭菌蒸馏水)8.5 μL,总反应体系25 μL。扩增反应条件:95 ℃ 30 s解链,60 ℃ 30 s退火,72 ℃ 20 s延伸,50个循环。反应结束后根据Ct值(2-△△Ct)来计算目的基因的相对表达水平。引物序列见表 1。
| 基因 | 上游引物 | 下游引物 |
| PPAR-γ | CAGGAGCAGAGCAAAGAGGT | TGGACACCATACTTGAGCAGA |
| PKGⅠα | CACCCACAGACACAAGCAAT | GCAAGGCAGAAGCAGGTAAG |
| SM22α | TCTAATGGCTTTGGGCAGTT | GCAGTTGGCTGTCTGTGAAG |
| GAPDH | GGTGAAGGTCGGTGTGAACG | CTCGCTCCTGGAAGATGGTG |
1.7 Western blot检测PPAR-γ、PKGⅠα和SM22α蛋白表达
按2×105/孔细胞量接种至6孔板,细胞贴壁后换不含血清DMEM培养基培养24 h进行血清饥饿,将Ang Ⅱ(100 nmol/L)加入到用罗格列酮(5、10、20 μmol/L)预处理4 h,或先使用GW9662(5 μmol/L)预处理30 min,再在罗格列酮刺激4 h后的细胞中继续培养24 h,采用RIPA裂解法提取细胞总蛋白,BCA测定蛋白浓度并调至一致。蛋白上样后行SDS-PAGE凝胶电泳,将蛋白转移到PVDF膜上,5%脱脂奶粉室温封闭2 h,加入用5%脱脂奶粉稀释的PPAR-γ(1:500)、PKGⅠα(1:500)、SM22α(1:600)和标准内参GAPDH (1:1 000)一抗4 ℃孵育过夜。次日TBST洗膜10 min×4次,二抗室温孵育1.5 h,TBST洗膜10 min×4次,ECL法显影,运用Image J软件进行灰度分析。
1.8 统计学分析实验均重复3次,数据以x±s表示,采用SPSS 16.0统计软件进行分析,多组间均数的比较采用方差分析,两组间均数比较采用t检验,检验水准α=0.05。
2 结果 2.1 罗格列酮对AngⅡ诱导VSMCs迁移的影响Transwell检测结果显示:经AngⅡ(100 nmol/L)处理后,高倍镜下(×400)观察到细胞数量较对照组增多,差异具有统计学意义(P < 0.05),提示AngⅡ(100 nmol/L)促进VSMCs的迁移。经罗格列酮(20 μmol/L)预处理2 h后可抑制AngⅡ诱导VSMCs的迁移作用(P < 0.05,图 1)。
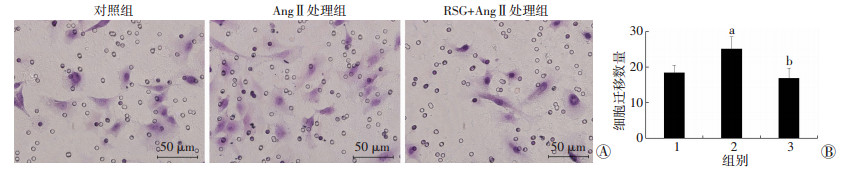
|
| A:细胞迁移形态学观察;B:细胞迁移数量;1:对照组;2:AngⅡ处理组;3:RSG+AngⅡ处理组;a: P < 0.05,与对照组比较;b:P < 0.05,与AngⅡ处理组比较 图 1 Transwell检测细胞迁移能力 |
2.2 罗格列酮对AngⅡ诱导VSMCs微丝骨架F-actin的影响
对照组VSMCs细胞微丝骨架F-actin部分呈点状分布,部分聚集为丝状应力纤维,微丝数量较少、较细。AngⅡ处理后的VSMCs与对照组相比,F-actin聚集为丝状应力纤维,微丝增粗、数量增多,荧光强度增强,可见伪足伸出。用罗格列酮预处理1 h后再用AngⅡ刺激VSMCs,细胞微丝骨架溶解为点状,未见明显丝状应力纤维,荧光强度降低,伪足消失(图 2)。
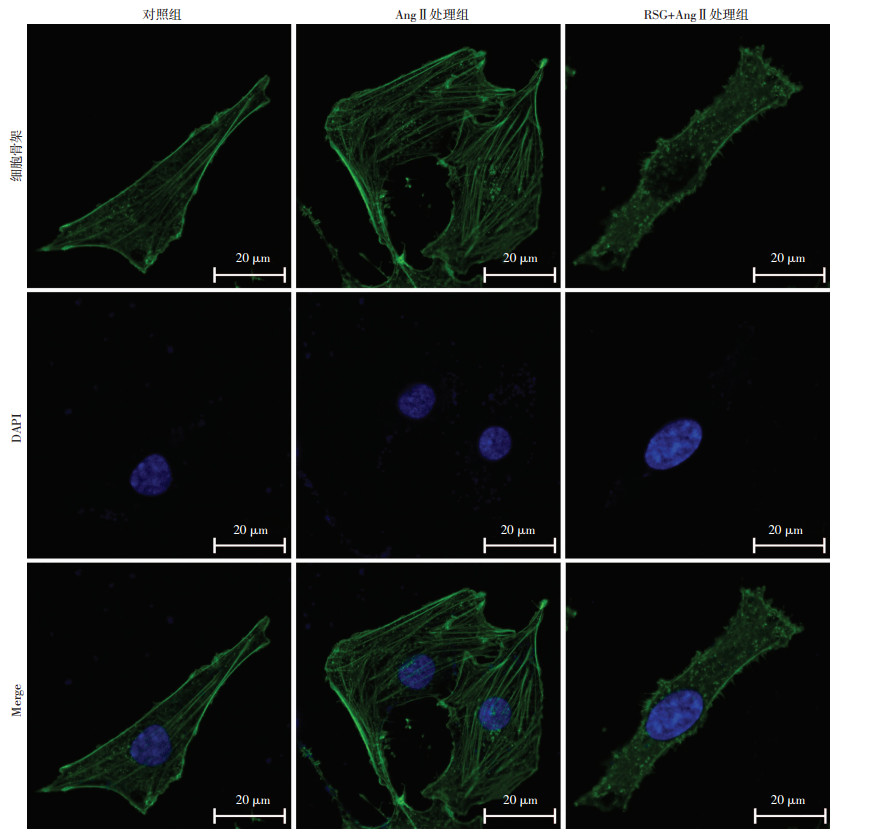
|
| 图 2 激光共聚焦显微镜下观察细胞微丝 |
2.3 罗格列酮对AngⅡ诱导VSMCs表型标志因子蛋白及mRNA水平的影响
与对照组相比,AngⅡ明显降低VSMCs收缩型标志因子SM22α蛋白水平和mRNA水平(P < 0.05),提示AngⅡ诱导了VSMCs的表型转化。与AngⅡ处理组相比,罗格列酮预处理呈浓度依赖性地促进PPAR-γ和SM22α的蛋白表达,使用5 μmol/L浓度的罗格列酮预处理即可促进SM22α的蛋白表达(P < 0.05,图 3)。RT-qPCR检测结果表明,20 μmol/L的罗格列酮预处理在提高PPAR-γ转录水平的同时也提高了SM22α的mRNA水平(P < 0.05,图 4)。
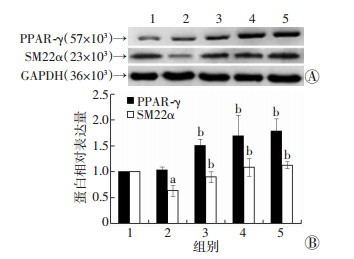
|
| A:Western blot检测结果;B:半定量分析;1:对照组;2:Ang Ⅱ处理组;3:AngⅡ+RSG (5 μmol/L)处理组;4:AngⅡ+RSG (10 μmol/L)处理组;5:AngⅡ+RSG (20 μmol/L)处理组;a: P < 0.05,与对照组比较;b:P < 0.05,与AngⅡ处理组比较 图 3 Western blot检测各组血管平滑肌细胞PPAR-γ和SM22α蛋白表达水平 |
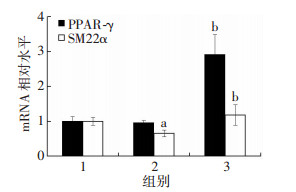
|
| 1:对照组;2:AngⅡ处理组;3:AngⅡ+ RSG (20 μmol/L)处理组a: P < 0.05,与对照组比较;b:P < 0.05,与AngⅡ处理组比较 图 4 RT-qPCR检测各组血管平滑肌细胞PPAR-γ和SM22α的mRNA水平 |
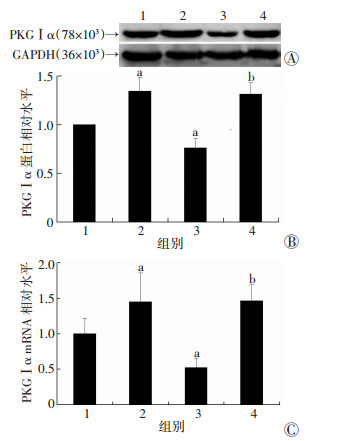
2.4 罗格列酮对AngⅡ诱导VSMCs中PKGⅠα蛋白及mRNA水平的影响
与对照组相比,AngⅡ处理组VSMCs的PKGⅠα蛋白水平及mRNA水平降低(P < 0.05)。与AngⅡ处理组相比,20 μmol/L的罗格列酮预处理后显著提高了PKGⅠα蛋白和mRNA水平(P < 0.05)。即使对于正常培养的VSMCs (对照组),20 μmol/L的罗格列酮也可明显上调PKGⅠα蛋白水平及mRNA水平(P < 0.05,图 5)。
|
| A:Western blot检测结果;B:PKGⅠα蛋白水平半定量分析;C:PKGⅠα mRNA表达水平;1:对照组;2:RSG (20 μmol/L)处理组;3:AngⅡ处理组;4:AngⅡ+RSG (20 μmol/L)处理组;a: P < 0.05,与对照组比较;b:P < 0.05,与AngⅡ处理组比较 图 5 Western blot和RT-qPCR检测各组血管平滑肌细胞PKGⅠα蛋白和mRNA水平 |
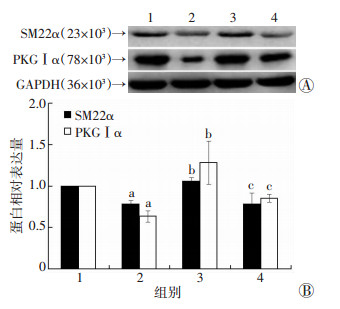
2.5 PPAR-γ抑制剂对罗格列酮促进SM22α和PKG Ⅰα表达作用的影响
同2.3及2.4 Western blot结果,20 μmol/L的罗格列酮预处理后显著抑制了AngⅡ诱导VSMCs中SM22α和PKGⅠα的下调作用(P < 0.05),在给予罗格利酮刺激之前使用PPAR-γ抑制剂GW9662(5 μmol/L)预处理30 min,SM22α和PKGⅠα蛋白表达显著下降(P < 0.05,图 6)。这提示罗格列酮通过PPAR-γ途径拮抗AngⅡ诱导VSMCs SM22α和PKG Ⅰα的下调。
|
| A:Western blot检测结果;B:半定量分析;1:对照组;2:AngⅡ处理组;3:AngⅡ+RSG (20 μmol/L)处理组;4:AngⅡ+ RSG (20 μmol/L)+ GW9662(5 μmol/L)处理组;a: P < 0.05,与对照组比较;b:P < 0.05,与AngⅡ处理组比较;c: P < 0.05,与AngⅡ+ RSG (20 μmol/L)处理组比较 图 6 Western blot检测各组血管平滑肌细胞SM22α和PKGⅠα蛋白相对水平 |
3 讨论
噻唑烷二酮类药物如罗格列酮、吡格列酮是PPAR-γ高亲和力的激动剂,目前临床上主要应用于2型糖尿病的治疗。近年越来越多的研究表明,PPAR-γ激动剂具有心血管保护作用,明确PPAR-γ激动剂发挥血管保护作用的机制有重要的临床意义。目前针对PPAR-γ对心血管系统保护作用的体外研究多集中于细胞增殖、迁移、凋亡和炎症反应,本研究主要从VSMCs表型转化的角度来探究PPAR-γ发挥血管保护作用的机制,并将细胞表型转化与细胞迁移及细胞骨架分析相结合。
本研究用AngⅡ成功诱导了VSMCs的迁移及表型转化,用PPAR-γ激动剂罗格列酮预处理后可逆转AngⅡ的上述作用。同时,我们在对细胞骨架分析时也发现:用AngⅡ诱导VSMCs迁移时,VSMCs微丝数量增加,直径变粗,这一结果与Chen等[15]的研究相一致。而当VSMCs迁移能力被罗格列酮抑制后,VSMCs微丝骨架溶解为点状,激光共聚焦显微镜下很少观察到丝状应力纤维。目前有研究表明AngⅡ通过AT1受体途径诱导VSMCs表型转化[16-17]。文献[18-20]认为PPAR-γ能拮抗AngⅡ诱导的血管重构是由于调低了AT1受体的表达水平,文献[21-22]发现罗格列酮激活PPAR-γ后对AT1受体水平无显著影响,因此我们需要探究PPAR-γ抑制AngⅡ诱导VSMCs的表型转化的其他机制。PKG是一种环鸟苷酸(cGMP)依赖的蛋白激酶,分为胞质可溶性Ⅰ型和膜结合性Ⅱ型,其中Ⅰ型又分为α和β 2个亚型。近年来的研究显示PKGⅠα途径对肺动脉平滑肌细胞(PASMCs)表型起重要的调节作用。Yi等[23]发现:Ad-PKGⅠα转染PASMCs后,可抑制缺氧诱导的PASMCs表型转化,使体外培养的合成型肺动脉平滑肌细胞转化为收缩表型,不但细胞形态学明显发生变化,而且一些表型标志基因的表达也产生相应的变化,如SM-MHC、SMA-actin和calponin等基因表达上调。Yang等[24]使用PKG抑制剂后发现VSMCs收缩型标志因子Calponin、α-SMA水平降低,合成型标志因子Thrombospondin水平升高。本研究发现,AngⅡ降低SM22α水平的同时也抑制了PKGⅠα的表达,PPAR-γ激动剂罗格列酮调高SM22α水平的同时也促进了PKGⅠα的表达,提示罗格列酮激活PPAR-γ后可能通过调高PKGⅠα来抑制AngⅡ诱导VSMCs的表型转化。
综上所述,本研究表明PPAR-γ激动剂罗格列酮可抑制小鼠血管平滑肌细胞的细胞迁移和微丝骨架的形成,激活PPAR-γ可能通过上调PKGⅠα途径来抑制AngⅡ诱导血管平滑肌细胞的表型转化。目前关于罗格列酮应用于心血管治疗的安全性还存在争议,因为PPAR-γ激动剂可导致液体潴留,增加心脏负荷,有Meta分析和大型临床研究表明罗格列酮可增加2型糖尿病患者心衰的风险[25-26],因此需要我们在下一步研究中更深入探讨相关的分子机制和信号通路,为临床上心脑血管疾病的药物治疗和介入术后的病患管理寻找新的策略。
| [1] | Ceriello A. Thiazolidinediones as anti-inflammatory and anti-atherogenic agents[J]. Diabetes Metab Res Rev,2008, 24 (1) : 14 –26. DOI:10.1002/dmrr.790 |
| [2] | Lagna G, Ku M M, Nguyen P H, et al. Control of phenotypic plasticity of smooth muscle cells by bone morphogenetic protein signaling through the myocardin-related transcription factors[J]. J Biol Chem,2007, 282 (51) : 37244 –37255. DOI:10.1074/jbc.M708137200 |
| [3] | Lin G, Chow S, Lin J, et al. Effect of cell passage and density on protein kinase G expression and activation in vascular smooth muscle cells[J]. J Cell Biochem,2004, 92 (1) : 104 –112. DOI:10.1002/jcb.20043 |
| [4] | Yoshida T, Owens G K. Molecular determinants of vascular smooth muscle cell diversity[J]. Circ Res,2005, 96 (3) : 280 –291. DOI:10.1161/01.RES.0000155951.62152.2e |
| [5] | Zhang Z, Wang M, Fan X H, et al. Upregulation of TRPM7 channels by angiotensin Ⅱ triggers phenotypic switching of vascular smooth muscle cells of ascending aorta[J]. Circ Res,2012, 111 (9) : 1137 –1146. DOI:10.1161/CIRCRESAHA.112.273755 |
| [6] | Lim S, Park S. Erratum: Role of vascular smooth muscle cell in the inflammation of atherosclerosis[J]. BMB Rep,2016, 49 (2) : 134 . |
| [7] | Gao D, Hao G, Meng Z, et al. Rosiglitzone suppresses angiotensin Ⅱ-induced production of KLF5 and cell proliferation in rat vascular smooth muscle cells[J]. PLoS One,2015, 10 (4) : e0123724 . DOI:10.1371/journal.pone.0123724 |
| [8] | Iglarz M, Touyz R M, Amiri F, et al. Effect of peroxisome proliferator-activated receptor-alpha and -gamma activators on vascular remodeling in endothelin-dependent hypertension[J]. Arterioscler Thromb Vasc Biol,2003, 23 (1) : 45 –51. DOI:10.1161/01.ATV.0000047447.67827.CD |
| [9] | Silva-Junior Gde O, Torres Tda S, Mendonca Lde S, et al. Rosiglitazone (peroxisome proliferator-activated receptor-gamma) counters hypertension and adverse cardiac and vascular remodeling in 2K1C hypertensive rats[J]. Exp Toxicol Pathol,2011, 63 (1/2) : 1 –7. DOI:10.1016/j.etp.2009.09.001 |
| [10] | Qin H D, Huang D, Weng X D, et al. Upregulation of peroxisome proliferator-activated receptor-gamma and NADPH oxidases are involved in restenosis after balloon injury[J]. J Cell Physiol,2009, 221 (2) : 387 –393. DOI:10.1002/jcp.21865 |
| [11] | Gizard F, Bruemmer D. Transcriptional Control of Vascular Smooth Muscle Cell Proliferation by Peroxisome Proliferator-Activated Receptor-gamma: Therapeutic Implications for Cardiovascular Diseases[J]. PPAR Res,2008, 2008 : 429123 . DOI:10.1155/2008/429123 |
| [12] | 杨源瑞, 郑波, 周振华, 等. 猪颈动脉支架植入术后PPAR-γ的表达变化及对血管平滑肌表型转化的影响[J]. 第三军医大学学报,2014, 36 (4) : 321 –325. |
| [13] | Kim J S, Kim I K, Lee S Y, et al. Anti-proliferative effect of rosiglitazone on angiotensin Ⅱ-induced vascular smooth muscle cell proliferation is mediated by the mTOR pathway[J]. Cell Biol Int,2012, 36 (3) : 305 –310. DOI:10.1042/CBI20100524 |
| [14] | Ji Y, Liu J, Wang Z, et al. PPARgamma agonist, rosiglitazone, regulates angiotensin Ⅱ-induced vascular inflammation through the TLR4-dependent signaling pathway[J]. Lab Invest,2009, 89 (8) : 887 –902. DOI:10.1038/labinvest.2009.45 |
| [15] | Chen H F, Xie L D, Xu C S. The signal transduction pathways of heat shock protein 27 phosphorylation in vascular smooth muscle cells[J]. Mol Cell Biochem,2010, 333 (1/2) : 49 –56. DOI:10.1007/s11010-009-0203-5 |
| [16] | Ayari H, Legedz L, Cerutti C, et al. Mutual amplification of corticosteroids and angiotensin systems in human vascular smooth muscle cells and carotid atheroma[J]. J Mol Med (Berl),2014, 92 (11) : 1201 –1208. DOI:10.1007/s00109-014-1193-7 |
| [17] | Sabri A, Levy B I, Poitevin P, et al. Differential roles of AT1 and AT2 receptor subtypes in vascular trophic and phenotypic changes in response to stimulation with angiotensin Ⅱ[J]. Arterioscler Thromb Vasc Biol,1997, 17 (2) : 257 –264. DOI:10.1161/01.ATV.17.2.257 |
| [18] | Yi B, Cui J, Ning J N, et al. Over-expression of PKGIalpha inhibits hypoxia-induced proliferation, Akt activation, and phenotype modulation of human PASMCs: the role of phenotype modulation of PASMCs in pulmonary vascular remodeling[J]. Gene,2012, 492 (2) : 354 –360. DOI:10.1016/j.gene.2011.11.010 |
| [19] | Sugawara A, Takeuchi K, Uruno A, et al. Transcriptional suppression of type 1 angiotensin Ⅱ receptor gene expression by peroxisome proliferator-activated receptor-gamma in vascular smooth muscle cells[J]. Endocrinology,2001, 142 (7) : 3125 –3134. DOI:10.1210/endo.142.7.8272 |
| [20] | Takeda K, Ichiki T, Tokunou T, et al. Peroxisome proliferator-activated receptor gamma activators downregulate angiotensin Ⅱ type 1 receptor in vascular smooth muscle cells[J]. Circulation,2000, 102 (15) : 1834 –1839. DOI:10.1161/01.CIR.102.15.1834 |
| [21] | Gao D F, Niu X L, Hao G H, et al. Rosiglitazone inhibits angiotensin Ⅱ-induced CTGF expression in vascular smooth muscle cells-role of PPAR-gamma in vascular fibrosis[J]. Biochem Pharmacol,2007, 73 (2) : 185 –197. DOI:10.1016/j.bcp.2006.09.019 |
| [22] | Sugawara A, Takeuchi K, Uruno A, et al. Differential effects among thiazolidinediones on the transcription of thromboxane receptor and angiotensin Ⅱ type 1 receptor genes[J]. Hypertens Res,2001, 24 (3) : 229 –233. DOI:10.1291/hypres.24.229 |
| [23] | Yi B, Cui J, Ning J N, et al. Over-expression of PKGIalpha inhibits hypoxia-induced proliferation, Akt activation, and phenotype modulation of human PASMCs: the role of phenotype modulation of PASMCs in pulmonary vascular remodeling[J]. Gene,2012, 492 (2) : 354 –360. DOI:10.1016/j.gene.2011.11.010 |
| [24] | Yang H M, Kim B K, Kim J Y, et al. PPAR γ modulates vascular smooth muscle cell phenotype via a protein kinase G-dependent pathway and reduces neointimal hyperplasia after vascular injury[J]. Exp Mol Med,2013, 45 (11) : e65 . DOI:10.1038/emm.2013.112 |
| [25] | Krentz A. Thiazolidinediones: effects on the development and progression of type 2 diabetes and associated vascular complications[J]. Diabetes Metab Res Rev,2009, 25 (2) : 112 –126. DOI:10.1002/dmrr.937 |
| [26] | Home P D, Pocock S J, Beck-Nielsen H, et al. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open-label trial[J]. Lancet,2009, 373 (9681) : 2125 –2135. DOI:10.1016/S0140-6736(09)60953-3 |



